Legea nr. 95/2006 privind reforma în domeniul sănătății
EMITENT: PARLAMENT
Publicat în M.O. nr. 372 din 28 aprilie 2006
Parlamentul României adopta prezenta lege.
Titlul I - Sănătatea publică
Capitolul I - Dispoziții generale
Art. 1 - Obiectul prezentului titlu îl constituie reglementarea domeniului sănătății publice, obiectiv de interes social major.
Art. 2 - (1) Asistența de sănătate publică reprezintă efortul organizat al societății în vederea protejării și promovării sănătății populației. Asistența de sănătate publică se realizează prin ansamblul măsurilor politico-legislative, al programelor și strategiilor adresate determinantilor stării de sănătate, precum și prin organizarea instituțiilor pentru furnizarea tuturor serviciilor necesare.
(2) Scopul asistenței de sănătate publică îl constituie promovarea sănătății, prevenirea imbolnavirilor și îmbunătățirea calității vieții.
(3) Strategia sistemului sănătății publice urmărește asigurarea sănătății populației în cadrul unor comunități sanatoase.
(4) Asistența de sănătate publică este o componenta a sistemului de sănătate publică.
(5) Ministerul Sănătății Publice reprezintă autoritatea centrala în domeniul sănătății publice.
(6) În cuprinsul actelor normative în vigoare denumirea „Ministerul Sănătății” se înlocuiește cu denumirea „Ministerul Sănătății Publice”, iar sintagma „ministrul sănătății”, cu sintagma „ministrul sănătății publice”.
(7) Asistența de sănătate publică este coordonata de către Ministerul Sănătății Publice și se realizează prin toate tipurile de unități sanitare de stat sau private, constituite și organizate conform legii.
(8) Responsabilitatea pentru asigurarea sănătății publice revine Ministerului Sănătății Publice, autorităților de sănătate publică teritoriale, precum și autorităților de sănătate publică din cadrul ministerelor și instituțiilor cu rețea sanitară proprie.
(9) Asistența de sănătate publică este garantată de stat și finanțată de la bugetul de stat, bugetele locale, bugetul Fondului național unic de asigurări sociale de sănătate sau din alte surse, după caz, potrivit legii.
Art. 3 - Protecția sănătății publice constituie o obligație a autorităților administrației publice centrale și locale, precum și a tuturor persoanelor fizice și juridice.
Art. 4 - (1) În înțelesul prezentului titlu, termenii și notiunile folosite au următoarea semnificație:
a) sănătatea publică – starea de sănătate a populației în raport cu determinantii stării de sănătate: socio-economici, biologici, de mediu, stil de viața, asigurarea cu servicii de sănătate, calitatea și accesibilitatea serviciilor de sănătate;
b) promovarea sănătății – procesul care oferă individului și colectivităților posibilitatea de a-și controla și îmbunătăți sănătatea sub raport fizic, psihic și social și de a contribui la reducerea inechitatilor în sănătate;
c) supravegherea – activitatea de colectare sistematica și continua, analiza, interpretarea și diseminarea datelor privind starea de sănătate a populației, bolile transmisibile și netransmisibile, pe baza cărora sunt identificate prioritățile de sănătate publică și sunt instituite măsurile de prevenire și control;
d) evaluarea riscurilor pentru sănătate – estimarea gradului în care expunerea la factorii de risc din mediul natural, de viața și de muncă și la cei rezultați din stilul de viața individual și comunitar influențează starea de sănătate a populației;
e) inspecția sanitară – exercitarea controlului aplicării prevederilor legale de sănătate publică;
f) principiul precautiei – instrumentul prin care autoritatea de sănătate publică decide și intervine în situații în care se apreciază ca exista un potențial risc pentru sănătatea populației, în condițiile unei argumentatii științifice insuficiente.
(2) În sensul prevederilor prezentului titlu, precum și al prevederilor din cuprinsul prezentei legi, prin ministere și instituții cu rețele sanitare proprii se înțelege autoritățile și instituțiile care au în subordine unități sanitare, altele decât Ministerul Sănătății Publice, respectiv Ministerul Apărării Naționale, Ministerul Administrației și Internelor, Ministerul Justiției, Ministerul Transporturilor, Construcțiilor și Turismului, Serviciul Roman de Informații, Serviciul de Informații Externe, Serviciul de Telecomunicații Speciale și Academia Română.
Art. 5 - Funcțiile principale ale asistenței de sănătate publică vizează:
a) dezvoltarea politicilor, strategiilor și programelor vizând asigurarea sănătății publice;
b) monitorizarea și analiza stării de sănătate a populației;
c) planificarea în sănătatea publică;
d) supravegherea epidemiologica, prevenirea și controlul bolilor;
e) managementul și marketingul strategic al serviciilor de sănătate publică;
f) reglementarea domeniului sănătății publice, aplicarea și controlul aplicării acestei reglementări;
g) asigurarea calității serviciilor de sănătate publică;
h) cercetarea-dezvoltarea și implementarea de soluții inovatoare pentru sănătatea publică;
i) prevenirea epidemiilor, inclusiv instituirea stării de alerta epidemiologica;
j) protejarea populației împotriva riscurilor din mediu;
k) informarea, educarea și comunicarea pentru promovarea sănătății;
l) mobilizarea partenerilor comunitari în identificarea și rezolvarea problemelor de sănătate;
m) evaluarea calității, eficacitatii, eficientei și accesului la serviciile medicale;
n) dezvoltarea și planificarea resurselor umane și dezvoltarea instituțională pentru sănătate publică;
o) integrarea prioritatilor de sănătate publică în politicile și strategiile sectoriale de dezvoltare durabila;
p) asigurarea capacităților de răspuns la dezastre sau la amenintarile la adresa vieții și sănătății populației, inclusiv prin introducerea de restrictii de circulație a persoanelor și bunurilor.
Art. 6 - Principalele domenii de intervenție ale asistenței de sănătate publică sunt următoarele:
a) prevenirea, supravegherea și controlul bolilor transmisibile și netransmisibile prin:
1. asigurarea imunizarilor;
2. controlul epidemiilor;
3. supravegherea bolilor;
4. supravegherea factorilor de risc comportamentali;
5. prevenirea accidentelor;
b) monitorizarea stării de sănătate prin:
1. monitorizarea indicatorilor stării de sănătate;
2. monitorizarea determinantilor stării de sănătate;
3. monitorizarea eficacitatii și eficientei activităților din domeniul sănătății publice;
4. evaluarea nevoilor populației privind serviciile de sănătate publică;
c) promovarea sănătății și educația pentru sănătate prin:
1. campanii de informare-educare-comunicare;
2. programe de educație pentru sănătate și promovare a sănătății în comunități;
3. dezvoltarea și implicarea comunităților locale;
4. pledoaria pentru sănătatea publică;
d) sănătatea ocupationala prin:
1. definirea standardelor de sănătate ocupationala;
2. controlul aplicării reglementărilor sănătății în munca;
e) sănătatea în relație cu mediul prin:
1. monitorizarea factorilor de mediu în relație cu sănătatea;
2. reglementarea calității principalilor factori de mediu;
3. stabilirea normelor de igiena și sănătate publică comunitare;
4. controlul aplicării reglementărilor referitoare la calitatea factorilor de mediu;
f) reglementarea primara și secundară în domeniul sănătății publice prin:
1. elaborarea, revizuirea, adaptarea și implementarea legislației din domeniul sănătății publice;
2. reglementarea circulației bunurilor și serviciilor cu potențial impact asupra sănătății publice;
g) managementul sănătății publice bazat pe:
1. managementul politicilor, planificarii și dezvoltării sistemului de sănătate publică;
2. formularea și implementarea politicilor de sănătate publică pe baze științifice;
3. cercetarea în domeniul sănătății publice și al sistemelor de sănătate;
4. colaborarea și cooperarea internationala în domeniul sănătății publice;
h) servicii de sănătate publică specifice:
1. servicii de sănătate școlară;
2. servicii de urgenta în caz de dezastre și calamitati;
3. servicii de laborator în domeniul sănătății publice;
4. servicii de planificare familială;
5. servicii de screening pentru depistarea precoce a bolilor;
6. servicii prenatale și postnatale;
7. servicii de consiliere în domeniul sănătății publice;
8. servicii de sănătate publică în transporturi.
Capitolul II - Principiile asistenței de sănătate publică
Art. 7 - Principiile care stau la baza asistenței de sănătate publică sunt următoarele:
a) responsabilitatea societății pentru sănătatea publică;
b) focalizarea pe grupurile populationale și prevenirea primara;
c) preocuparea pentru determinantii stării de sănătate: sociali, de mediu, comportamentali și servicii de sănătate;
d) abordarea multidisciplinara și intersectoriala;
e) parteneriat activ cu populația și cu autoritățile publice centrale și locale;
f) decizii bazate pe cele mai bune dovezi științifice existente la momentul respectiv (sănătate publică bazată pe dovezi);
g) în condiții specifice, decizii fundamentate conform principiului precautiei;
h) descentralizarea sistemului de sănătate publică;
i) existenta unui sistem informațional și informatic integrat pentru managementul sănătății publice.
Art. 8 - Modalitățile de implementare a principiilor de sănătate publică sunt:
a) activitatea de reglementare în domeniile sănătății publice;
b) activitatea de inspecție;
c) activitățile desfășurate în cadrul programelor de sănătate publică;
d) avizarea/autorizarea/notificarea activităților și produselor cu impact asupra sănătății populației;
e) evaluarea impactului asupra sănătății în relație cu programe, strategii, politici ale altor sectoare de activitate cu efecte conexe asupra sănătății populației.
Art. 9 - (1) Programele naționale de sănătate reprezintă cadrul implementarii obiectivelor politicii și strategiei sănătății publice de către Ministerul Sănătății Publice, ca autoritate centrala a domeniului de sănătate publică.
(2) Programele naționale de sănătate se adresează populației și sunt orientate către promovarea sănătății, prevenirea imbolnavirilor și prelungirea vieții de buna calitate.
(3) Programele naționale de sănătate publică se adresează domeniilor de intervenție ale sănătății publice și răspund prioritatilor naționale identificate.
(4) Programele naționale de sănătate sunt finanțate de la bugetul de stat, bugetul Fondului național unic de asigurări sociale de sănătate, din fonduri externe rambursabile și nerambursabile, din venituri proprii, donații și sponsorizări, precum și din alte surse, potrivit legii.
(5) Programele naționale de sănătate sunt organizate, monitorizate și supuse controlului Ministerului Sănătății Publice.
Art. 10 - (1) Autoritatea centrala în domeniul sănătății publice elaborează proiecte de acte normative în domeniul sănătății publice și avizează reglementări ale altor ministere și instituții referitoare la activități cu impact asupra sănătății publice.
(2) Principalele domenii pentru care autoritatea centrala de sănătate publică elaborează sau participa la elaborarea, după caz, a unor proiecte de acte normative sunt:
a) calitatea principalilor factori de mediu: apa potabilă și de imbaiere, aerul ambiant și interior, zgomot, locuinta și habitat, substanțe chimice, produse cosmetice, radiatii ionizante, vectori, deșeuri etc.;
b) monitorizarea stării de sănătate;
c) promovarea sănătății;
d) calitatea alimentului;
e) calitatea unităților și serviciilor turistice;
f) calitatea mediului de muncă și sănătatea în munca;
g) colectivitatile de copii și tineri;
h) evaluarea efectelor factorilor de mediu asupra sănătății populației;
i) asigurarea condițiilor de igiena în unități sanitare;
j) servicii de laborator;
k) planificare familială;
l) siguranța transfuziei sanguine;
m) norme privind alte domenii ale sănătății publice;
n) prevenirea consumului ilegal de droguri.
(3) Ministerul Sănătății Publice, prin aparatul propriu și prin autoritățile de sănătate publică județene și a municipiului București și ale ministerelor și instituțiilor cu rețea sanitară proprie, verifica respectarea reglementărilor în domeniul sănătății publice, iar în caz de nereguli sau neconformitate, aplica măsuri conform legii.
Capitolul III - Autoritățile sistemului de sănătate publică
Art. 11 - Ministerul Sănătății Publice este organ de specialitate al administrației publice centrale, cu personalitate juridică, în subordinea Guvernului, cu sediul în municipiul București, str. Cristian Popisteanu nr. 1-3, sectorul 1.
Art. 12 - Autoritățile de sănătate publică județene și a municipiului București sunt servicii publice deconcentrate ale Ministerului Sănătății Publice, cu personalitate juridică, reprezentând autoritatea de sănătate publică la nivel local. În mod similar se pot organiza autorități de sănătate publică în cadrul ministerelor care colaborează cu unitățile deconcentrate ale Ministerului Sănătății Publice.
Art. 13 - (1) Institutele sau centrele de sănătate publică sunt instituții publice regionale sau naționale, cu personalitate juridică, în subordinea Ministerului Sănătății Publice, și care coordonează tehnic și metodologic activitatea de specialitate în domeniul fundamentarii, elaborării și implementarii strategiilor privitoare la prevenirea imbolnavirilor, controlul bolilor transmisibile și netransmisibile și a politicilor de sănătate publică din domeniile specifice, la nivel național și/sau regional.
(2) Institutele naționale de cercetare-dezvoltare în domeniile sănătății publice sunt instituții publice cu personalitate juridică, în coordonarea Ministerului Sănătății Publice.
Art. 14 - Se înființează Centrul național pentru organizarea și asigurarea sistemului informațional și informatic în domeniul sănătății, instituție publică de specialitate, cu personalitate juridică, în subordinea Ministerului Sănătății Publice.
Art. 15 - (1) Ministerul Sănătății Publice stabilește, prin ordine ale ministrului sănătății publice, și alte instituții aflate în coordonarea sau în subordonarea sa pentru a desfășura activități de sănătate publică la nivel regional și local.
(2) Prin hotărâre a Guvernului se stabilesc și alte instituții care să desfășoare activități de sănătate publică la nivel național.
Art. 16 - Ministerul Sănătății Publice, ca autoritate centrala în domeniul asistenței de sănătate publică, are următoarele atribuții și responsabilități:
a) asigura fundamentarea, elaborarea și implementarea politicii naționale de sănătate publică;
b) elaborează sau avizează reglementări pentru protecția sănătății în relație cu mediul natural, alimentul, condițiile de viața și de muncă și pentru promovarea sănătății publice;
c) elaborează și avizează reglementări privind organizarea și funcționarea serviciilor de asistența medicală și de sănătate publică;
d) autorizeaza și controlează condițiile de funcționare a furnizorilor de servicii medicale prin autoritățile locale de sănătate publică;
e) stabilește prioritățile naționale de sănătate publică, elaborează programele naționale de sănătate publică finanțate de la bugetul de stat, coordonează și monitorizează implementarea acestora;
f) elaborează normele privind înființarea, organizarea și funcționarea unităților de distribuție a medicamentelor, autorizeaza și controlează activitatea și condițiile de funcționare a acestora;
g) autorizeaza și controlează condițiile de funcționare a farmaciilor de stat și private și, respectiv, avizează Nomenclatorul medicamentelor și produselor biologice de uz uman, în condițiile legii;
h) elaborează împreună cu Casa Naționala de Asigurări de Sănătate, denumita în continuare CNAS, cu consultarea Colegiului Farmacistilor din România, lista medicamentelor de care beneficiază asigurații, cu sau fără contribuție personală;
i) elaborează normele de organizare și funcționare a unităților care asigura asistența de sănătate publică, autorizeaza și controlează activitatea instituțiilor de sănătate publică și asigura finanțarea unităților din subordine;
j) asigura controlul calității serviciilor medicale prin autoritățile locale de sănătate publică;
k) evalueaza periodic indicatorii stării de sănătate a populației și ai programelor de sănătate publică, indicatorii de performanță ai unităților sanitare și prezintă informări periodice Guvernului;
l) stabilește care sunt instituțiile sau organismele care pot fi delegate pentru realizarea de atribuții și responsabilități specifice în domeniul sănătății publice, pe bază de selecție de oferta și recomandare profesională;
m) stabilește sau avizează liste de substanțe ori produse destinate sau folosite pentru uz uman și controlează respectarea condițiilor legale prin care produsele pot fi oferite spre consum sau folosință populației;
n) avizează codurile deontologice profesionale și ghidurile de practica în domeniul sănătății publice;
o) reprezintă statul român în relațiile cu organismele internaționale din domeniul sănătății publice;
p) organizează și coordonează sistemul național de supraveghere și control al bolilor;
q) organizează și coordonează rețeaua naționala de promovare a sănătății, în scopul adoptării de către populație a comportamentelor favorabile sănătății;
r) avizează și controlează activitatea de supraveghere a stării de sănătate a personalului expus profesional;
s) participa la activitățile de promovare și protecție a sănătății familiilor și categoriilor de populație defavorizate;
t) participa la activitățile de protecție familială, planificare familială și protecția copilului;
u) organizează și coordonează activitatea de inspecție sanitară de stat;
v) organizează și coordonează Sistemul național informațional și informatic privind sănătatea publică;
w) organizează și coordonează implementarea unor activități de protecție a mediului, conform reglementărilor legale.
Art. 17 - (1) Autoritățile de sănătate publică județene și a municipiului București sunt servicii publice deconcentrate, cu personalitate juridică, subordonate Ministerului Sănătății Publice, care pun în aplicare politica și programele naționale de sănătate publică pe plan local, identifica problemele locale prioritare de sănătate publică, elaborează și implementeaza acțiuni locale de sănătate publică.
(2) În scopul îndeplinirii acestor obiective, autoritățile de sănătate publică județene și a municipiului București au, în principal, următoarele atribuții:
a) controlează și evalueaza modul de asigurare a asistenței medicale curative și profilactice;
b) controlează aplicarea normelor de funcționare a unităților medicale și farmaceutice, indiferent de forma de organizare, și aplica măsuri în caz de neconformitate;
c) urmăresc aplicarea criteriilor de control al calității serviciilor medicale;
d) coordonează și controlează asistența gravidei, lauzei și nou-nascutului;
e) evalueaza resursele umane de la nivelul asistenței medicale în relație cu nevoile comunitare identificate prin acțiuni specifice;
f) participa activ la programele de instruire a personalului din serviciile de sănătate publică și a populației;
g) organizează acțiuni de prevenire a imbolnavirilor și de promovare a sănătății;
h) organizează activitățile preventive în teritoriul județului și, respectiv, al municipiului București;
i) colectează și înregistrează date privind sănătatea populației, utilizând informațiile în scopul identificarii problemelor de sănătate ale acesteia;
j) identifica posibilele probleme de sănătate publică sau amenințări la adresa sănătății unei comunități;
k) intervin în rezolvarea problemelor de sănătate publică apărute în rândul persoanelor aparținând grupurilor defavorizate;
l) coordonează studii asupra problemelor de sănătate ale populației din teritoriul dat;
m) stabilesc relații de colaborare cu instituții și organizații în vederea desfășurării de acțiuni comune în domeniul sănătății publice;
n) colectează și înregistrează datele privind tipurile, cantitatea și modul de gestionare a deșeurilor generate în unitățile medicale din zona de jurisdicție.
Art. 18 - (1) În subordinea autorităților de sănătate publică funcționează unități sanitare publice de pe raza teritoriului arondat, cu excepția unităților sanitare publice de interes național sau a celor aparținând ministerelor ori instituțiilor cu rețele sanitare proprii.
(2) Autoritățile de sănătate publică județene și a municipiului București coordonează serviciile de ambulanta județene și al municipiului București, organizează și coordonează asistența medicală în caz de calamitati, catastrofe și situații deosebite.
Art. 19 - Autoritățile de sănătate publică județene și a municipiului București colaborează cu autoritățile locale în asigurarea asistenței medicale.
Art. 20 - (1) Autoritățile de sănătate publică județene și a municipiului București organizează culegerea și prelucrarea informațiilor statistice medicale primite de la unitățile sanitare publice sau private și transmit rapoarte statistice lunare către instituțiile desemnate în acest scop.
(2) Autoritățile de sănătate publică teritoriale întocmesc rapoarte privind starea de sănătate a comunității, care sunt înaintate Ministerului Sănătății Publice, precum și partenerilor institutionali la nivel local.
Art. 21 - Autoritățile de sănătate publică județene și a municipiului București coordonează la nivel local implementarea activităților care decurg din obligațiile asumate prin Tratatul de aderare a României la Uniunea Europeană și planurile de implementare a actelor comunitare referitoare la domeniul sănătății.
Art. 22 - Regulamentul de organizare și funcționare, precum și structura organizatorică ale autorităților de sănătate publică județene și a municipiului București se stabilesc prin ordin al ministrului sănătății publice.
Art. 23 - Institutele/centrele naționale și/sau regionale prevăzute la art. 13 și 14, aflate în subordinea și/sau în coordonarea Ministerului Sănătății Publice, îndeplinesc, în principal, următoarele atribuții:
a) asigura îndrumarea tehnica și metodologică a rețelei de sănătate publică, în funcție de domeniul lor de competența;
b) participa la elaborarea strategiilor și politicilor din domeniul lor de competența;
c) elaborează proiecte de acte normative, norme, metodologii și instrucțiuni privind domeniile specifice din cadrul sănătății publice;
d) efectuează expertize, oferă asistența tehnica și realizează servicii de sănătate publică, la solicitarea unor persoane fizice sau juridice;
e) supraveghează starea de sănătate a populației, bolile transmisibile și netransmisibile, pentru identificarea problemelor de sănătate comunitara;
f) asigura sistemul de supraveghere epidemiologica, precum și de alerta precoce și răspuns rapid și participa la schimbul de informații în cadrul rețelei europene de supraveghere epidemiologica în domeniul bolilor transmisibile;
g) participa la efectuarea de investigații epidemiologice de teren, din proprie inițiativă, la solicitarea Ministerului Sănătății Publice sau a autorităților locale de sănătate publică;
h) elaborează metodologia, instrumentele și indicatorii de monitorizare și evaluare a serviciilor și programelor de sănătate publică, de promovare a sănătății și de educație pentru sănătate;
i) participa la procesul de învățământ medical de specializare și perfecționare în domeniile specifice din cadrul sănătății publice;
j) desfășoară activități de cercetare-dezvoltare în domeniul sănătății publice și al managementului sanitar;
k) colectează, analizează și disemineaza date statistice privind sănătatea publică;
l) asigura existenta unui sistem informațional și informatic integrat pentru managementul sănătății publice.
Art. 24 - (1) Instituțiile și unitățile sanitare care asigura asistența de sănătate publică, în cazul apariției unui focar de boala transmisibila, precum și în situația iminentei izbucnirii unei epidemii, au obligația sa dispună măsuri specifice.
(2) Măsurile privind prevenirea și gestionarea situațiilor de urgenta generate de epidemii, precum și bolile transmisibile pentru care declararea, tratamentul sau internarea sunt obligatorii se stabilesc prin ordin al ministrului sănătății publice.
Capitolul IV - Inspecția sanitară de stat
Art. 25 - (1) Activitatea de inspecție sanitară de stat se organizează pe domenii specifice de activitate coordonate de către direcțiile de specialitate din cadrul Ministerului Sănătății Publice și în cadrul structurilor de specialitate din serviciile publice deconcentrate de la nivel local și din ministerele cu rețea sanitară proprie, conform competentelor, după cum urmează:
a) inspecția farmaceutica;
b) inspecția dispozitivelor medicale;
c) inspecția pentru controlul calității serviciilor de asistența medicală;
d) inspecția de sănătate publică.
(2) Activitatea de inspecție sanitară de stat consta, în principal, în:
a) verificarea conformitatii amplasamentelor, activităților, proceselor, serviciilor, produselor, factorilor de mediu;
b) verificarea respectării reglementărilor privind starea de sănătate a personalului, cunoștințele, atitudinile și practicile acestuia în raport cu normele igienico-sanitare;
c) depistarea și evaluarea riscurilor pentru sănătate și impunerea măsurilor de eliminare sau, după caz, de diminuare a acestora;
d) comunicarea datelor despre existenta și dimensiunea riscului identificat persoanelor responsabile cu managementul riscului, consumatorilor și altor potențiali receptori interesați.
Art. 26 - (1) Activitatea de inspecție sanitară de stat se exercită de către personalul de specialitate împuternicit de către Ministerul Sănătății Publice, conform normelor stabilite de către acesta.
(2) Pentru exercitarea activității de inspecție, inspectorii sanitari de stat au drept de:
a) acces în orice tip de unități, la documente, informații, conform competentelor;
b) recoltare a produselor care pot constitui un risc pentru sănătatea publică;
c) a constata și a sanctiona contravențiile privind normele de igiena și sănătate publică.
(3) În situații de risc pentru sănătatea publică, inspectorii sanitari de stat pot interzice punerea în consum, pot decide retragerea produselor, suspendarea temporară sau definitivă a activităților, retragerea sau anularea autorizației sanitare de funcționare.
(4) În situații de risc epidemiologic, inspectorii sanitari de stat pot dispune măsuri speciale pentru bolnavii, suspectii și contactii de boli transmisibile sau purtatorii de germeni patogeni, precum și alte măsuri de limitare a circulației persoanelor.
(5) Concluziile activităților de inspecție sanitară de stat, abaterile de la normele legale, recomandările și termenele de remediere a deficiențelor, precum și alte măsuri legale aplicate se vor consemna în procese-verbale de constatare a condițiilor igienico-sanitare, rapoarte de inspecție sau procese-verbale de constatare a contravenției.
(6) În exercitarea activității inspectorii sanitari de stat vor asigura păstrarea confidențialității datelor, cu excepția situațiilor care constituie un risc pentru sănătatea publică.
Art. 27 - Activitatea de avizare, autorizare și notificare a activităților și produselor cu impact asupra sănătății populației are ca scop certificarea conformarii cu normele de sănătate publică a produselor, serviciilor și activităților, în scopul protejării sănătății populației.
Art. 28 - Activitatea de evaluare a impactului asupra sănătății în relație cu programe, strategii, politici ale altor sectoare de activitate cu efecte conexe asupra sănătății populației reprezintă instrumentul de integrare a prioritatilor de sănătate publică în dezvoltarea durabila a societății.
Capitolul V - Asistența medicală
Art. 29 - Asistența medicală profilactica și curativă se asigura prin:
a) cabinete medicale ambulatorii ale medicilor de familie și de alte specialități, centre de diagnostic și tratament, centre medicale, centre de sănătate, laboratoare, precum și prin alte unități sanitare publice și private;
b) unități sanitare publice și private cu paturi.
Art. 30 - Activitatea medicală de recuperare se asigura prin unități medicale de specialitate cu personalitate juridică, secții, compartimente și laboratoare de recuperare, unități ambulatorii de recuperare, publice sau private, precum și prin societăți de turism balnear și de recuperare, constituite conform legii.
Art. 31 - Asistența medicală de urgenta se asigura de unități specializate de urgenta și transport sanitar publice sau private, precum și prin structurile de primire a urgentelor, organizate în acest scop.
Art. 32 - Asistența medicală de hemotransfuziologie, transfuzie sanguina sau alte servicii de asistența medicală și prestații autorizate se asigura prin unități specializate în acest scop.
Art. 33 - Asistența medicală preventivă din colectivitatile de copii preșcolari, școlari și studenți se asigura prin cabinetele medicale organizate, conform legii, în unitățile de învățământ preșcolar, școlar sau universitar, publice ori private, sau prin cabinetele individuale ale medicilor de familie, după caz.
Art. 34 - Activitățile de asistența de sănătate publică se finanțează de la bugetul de stat, de la bugetul Fondului național unic de asigurări sociale de sănătate, de la bugetele locale, din venituri proprii, fonduri externe rambursabile și nerambursabile, contracte cu terții, precum și din contribuții personale și plati directe, după caz, potrivit legii.
Capitolul VI - Asistența farmaceutica
Art. 35 - Asistența farmaceutica se asigura în cadrul sistemului de sănătate publică, potrivit legii, prin prepararea și eliberarea medicamentelor și a altor produse stabilite prin ordin al ministrului sănătății publice, cum ar fi: cosmetice, dispozitive medicale, suplimente alimentare și alte asemenea produse.
Art. 36 - Punerea pe piața a medicamentelor, precum și activitatea de farmacovigilenta se realizează conform legii.
Capitolul VII - Obligațiile persoanelor fizice și juridice
Art. 37 - Orice persoană fizica sau juridică, având calitatea de angajator, este obligată să asigure fondurile și condițiile necesare pentru:
a) efectuarea controlului medical periodic, conform normelor de sănătate publică și securitate în munca;
b) aplicarea măsurilor de igiena, dezinfecție, dezinsecție și deratizare periodică;
c) vaccinarea și profilaxia specifică impusa de riscurile de la locul de muncă.
Art. 38 - Cetățenii români și orice altă persoană aflată pe teritoriul României, precum și unitățile și agenții economici au obligația să se supună măsurilor de prevenire și combatere a bolilor transmisibile, să respecte întocmai normele de igiena și sănătate publică, să ofere informațiile solicitate și să aplice măsurile stabilite privind instituirea condițiilor pentru prevenirea imbolnavirilor și pentru promovarea sănătății individului și a populației.
Art. 39 - (1) Informațiile privind sănătatea persoanelor se păstrează la autoritățile de sănătate publică teritoriale, la autoritățile de sănătate publică ale ministerelor cu rețea sanitară proprie, precum și la instituțiile desemnate și pot fi folosite în scopul întocmirii rapoartelor statistice nenominalizate, în vederea evaluării stării de sănătate a populației.
(2) Folosirea în alte scopuri a informațiilor înregistrate se poate admite numai dacă este îndeplinită una dintre următoarele condiții:
a) exista o dispoziție legală în acest sens;
b) exista acordul persoanei în cauza;
c) datele sunt necesare pentru prevenirea imbolnavirii unei persoane sau a comunității, după caz;
d) datele sunt necesare pentru efectuarea urmăririi penale.
(3) Păstrarea confidențialității informațiilor referitoare la persoane este obligatorie pentru toți salariații care prin activitatea pe care o desfășoară au acces la acestea în mod direct sau indirect.
Art. 40 - (1) Pentru situații speciale cu implicații asupra sănătății publice se constituie rezerva Ministerului Sănătății Publice, care cuprinde medicamente, seruri, vaccinuri, dezinfectante, insecticide, dispozitive medicale și alte materiale specifice, iar la nivelul autorităților de sănătate publică județene și a municipiului București, rezerva antiepidemica.
(2) Normele metodologice de constituire, păstrare și utilizare a rezervei Ministerului Sănătății Publice și a rezervei antiepidemice se stabilesc prin ordin al ministrului sănătății publice.
Art. 41 - (1) Pentru servicii de asistența de sănătate publică, efectuate de către autoritățile de sănătate publică la cererea unor persoane fizice și juridice, se percep tarife potrivit reglementărilor în vigoare.
(2) Veniturile proprii obținute potrivit alin. (1) se folosesc în condițiile legii.
Capitolul VIII - Utilizarea mass-media în interesul sănătății publice
Art. 42 - (1) Campaniile de informare, educare și comunicare cu privire la teme care privesc sănătatea publică trebuie să fie avizate de Ministerul Sănătății Publice.
(2) Societatea Română de Radiodifuziune și Societatea Română de Televiziune sunt obligate ca în cadrul grilelor de programe sa rezerve gratuit spațiul de emisie necesar promovării campaniilor de informare, educare și comunicare referitoare la teme care privesc sănătatea publică.
(3) În termen de 30 de zile de la intrarea în vigoare a prezentei legi, Ministerul Sănătății Publice sau, după caz, ministerele cu rețea sanitară proprie, împreună cu Societatea Română de Radiodifuziune și Societatea Română de Televiziune vor stabili, în baza unui protocol, modalitățile și spațiul acordat în grila de programe pentru promovarea campaniilor pe teme care privesc sănătatea publică.
Capitolul IX - Dispoziții tranzitorii și finale
Art. 43 - (1) În termen de 3 zile de la intrarea în vigoare a prezentului titlu, ministrul sănătății publice va emite ordinul privind restructurarea actualelor direcții de sănătate publică județene și a municipiului București, precum și ordinul pentru aprobarea Normelor de organizare și funcționare a inspecției sanitare de stat.
(2) În termenul prevăzut la alin. (1), Ministerul Sănătății Publice va elabora reglementările legale privind organizarea și funcționarea instituțiilor prevăzute la art. 13 și 14, pe care le va supune Guvernului spre aprobare.
Art. 44 - (1) Prevederile prezentului titlu se aplică și ministerelor cu rețea sanitară proprie.
(2) La data intrării în vigoare a prezentei legi se abroga Legea nr. 3/1978 privind asigurarea sănătății populației, publicată în Buletinul Oficial, Partea I, nr. 54 din 10 iulie 1978, cu modificările ulterioare, Legea nr. 100/1998 privind asistența de sănătate publică, publicată în Monitorul Oficial al României, Partea I, nr. 204 din 1 iunie 1998, cu modificările și completările ulterioare, precum și orice alte dispoziții contrare.
Titlul II - Programele naționale de sănătate
Capitolul I - Dispoziții generale
Art. 45 - (1) Programele naționale de sănătate reprezintă un ansamblu de acțiuni organizate în scopul prevenirii și controlului bolilor cu impact major asupra stării de sănătate a populației.
(2) Ministerul Sănătății Publice asigura proiectarea și coordonarea realizării programelor naționale de sănătate, în acord cu politicile și strategiile naționale de sănătate.
(3) Autoritățile de sănătate publică din ministerele cu rețea sanitară proprie coordonează realizarea programelor de sănătate specifice ministerului, cu impact asupra sănătății, în concordanta cu strategia Ministerului Sănătății Publice.
Art. 46 - Elaborarea programelor naționale de sănătate are la baza următoarele obiective:
a) rezolvarea cu prioritate a problemelor de sănătate, în conformitate cu Strategia naționala de sănătate a Ministerului Sănătății Publice;
b) utilizarea eficienta a resurselor alocate pentru îndeplinirea obiectivelor și indicatorilor aprobați;
c) fundamentarea programelor pe nevoile populației, evidentiate din date obiective;
d) asigurarea concordanței cu politicile, strategiile și recomandările instituțiilor și organizațiilor internaționale în domeniu.
Art. 47 - (1) Pentru proiectarea și realizarea programelor naționale de sănătate se înființează Agenția Naționala pentru Programe de Sănătate, care funcționează în structura Ministerului Sănătății Publice, cu rang de direcție.
(2) Pentru realizarea atribuțiilor, Agenția Naționala pentru Programe de Sănătate colaborează cu Casa Naționala de Asigurări de Sănătate, Ministerul Muncii, Solidarității Sociale și Familiei, precum și cu alte instituții și organizații guvernamentale și neguvernamentale.
Art. 48 - Programele naționale de sănătate, respectiv subprogramele de sănătate, se aproba anual prin ordin comun al ministrului sănătății publice și al președintelui Casei Naționale de Asigurări de Sănătate. În ordin sunt precizate obiectivele, activitățile, indicatorii specifici, unitățile sanitare prin care se derulează programele și subprogramele naționale de sănătate, precum și normele metodologice de organizare, finanțare și monitorizare a acestora.
Art. 49 - Programele naționale de sănătate se derulează prin unități de specialitate selectate pe baza criteriilor stabilite prin ordin al ministrului sănătății publice.
Capitolul II - Atribuții în realizarea programelor naționale de sănătate
Art. 50 - Ministerul Sănătății Publice, ca autoritate centrala în domeniul asistenței de sănătate, asigura coordonarea tuturor programelor naționale de sănătate prin îndeplinirea următoarelor atribuții:
a) aproba domeniile prioritare de acțiune și strategia programelor naționale de sănătate pe termen scurt, mediu și lung;
b) aproba obiectivele anuale ale programelor naționale de sănătate și ale subprogramelor de sănătate;
c) aproba structura programelor naționale de sănătate și a subprogramelor de sănătate;
d) aproba necesarul de resurse financiare pentru realizarea programelor naționale de sănătate și a subprogramelor de sănătate;
e) aproba normele tehnice de implementare a programelor naționale de sănătate;
f) stabilește programele naționale de sănătate și subprogramele de sănătate pentru care se organizează licitații la nivel național și răspunde de organizarea acestora.
Art. 51 - Agenția Naționala pentru Programe de Sănătate are următoarele atribuții:
a) propune spre aprobare ministrului sănătății publice domeniile prioritare de acțiune în structurarea programelor naționale de sănătate, pe baza evaluării nevoilor reale ale populației și a problemelor de sănătate identificate;
b) elaborează și propune spre aprobare ministrului sănătății publice strategia programelor naționale de sănătate, de organizare și desfășurare a acestora;
c) elaborează structura programelor și subprogramelor de sănătate, în colaborare cu direcțiile de specialitate din Ministerul Sănătății Publice și Casa Naționala de Asigurări de Sănătate;
d) fundamentează necesarul de resurse financiare în raport cu obiectivele și activitățile cuprinse în programele de sănătate;
e) elaborează și propune spre aprobare ministrului sănătății publice norme tehnice de implementare și evaluare a programelor naționale de sănătate;
f) evalueaza trimestrial și anual realizarea obiectivelor programelor naționale de sănătate și face propuneri pentru îmbunătățirea acestora în scopul îndeplinirii obiectivelor aprobate.
Art. 52 - Casa Naționala de Asigurări de Sănătate asigura organizarea și monitorizarea programelor naționale de sănătate cu scop curativ finanțate din bugetul Fondului național unic de asigurări sociale de sănătate, având următoarele atribuții:
a) implementeaza programele naționale de sănătate cu scop curativ finanțate din bugetul Fondului național unic de asigurări sociale de sănătate, conform strategiei aprobate de Ministerul Sănătății Publice;
b) răspunde de asigurarea, urmărirea și controlul fondurilor alocate pentru derularea programelor și subprogramelor de sănătate cu scop curativ, precum și de monitorizarea, controlul și analiza indicatorilor fizici și de eficienta, prin intermediul caselor de asigurări de sănătate județene;
c) transmite Agenției Naționale pentru Programe de Sănătate, trimestrial, anual și ori de câte ori este nevoie, analiza modului în care au fost derulate programele naționale de sănătate cu scop curativ finanțate din bugetul Fondului național unic de asigurări sociale de sănătate.
Art. 53 - (1) Programele naționale de sănătate sunt implementate și coordonate la nivel național de Agenția Naționala pentru Programe de Sănătate.
(2) Coordonatorii regionali și locali din cadrul institutelor și centrelor de sănătate publică, respectiv din cadrul autorităților de sănătate publică județene și a municipiului București, asigura implementarea și monitorizarea programelor naționale de sănătate la nivel regional, respectiv local.
Capitolul III - Finanțarea programelor naționale de sănătate
Art. 54 - (1) Finanțarea programelor naționale de sănătate se realizează cu fonduri de la bugetul de stat, bugetul Fondului național unic de asigurări sociale de sănătate, precum și din alte surse, inclusiv din donații și sponsorizări, în condițiile legii.
(2) Sumele alocate programelor naționale de sănătate sunt aprobate anual prin legea bugetului de stat.
Art. 55 - (1) Sumele alocate pentru programele naționale de sănătate, respectiv pentru subprograme, sunt cuprinse în bugetele de venituri și cheltuieli ale unităților sanitare prin care acestea se derulează și se utilizează potrivit destinațiilor stabilite.
(2) Sumele menționate la alin. (1) vor fi publicate pe site-ul Ministerului Sănătății Publice împreună cu bugetul de venituri și cheltuieli și execuția acestuia.
Art. 56 - Unitățile care derulează programele naționale de sănătate, respectiv subprograme, au obligația utilizării fondurilor în limita bugetului alocat și potrivit destinației specificate, cu respectarea dispozițiilor legale, precum și obligația gestionării eficiente a mijloacelor materiale și bănești și a organizării evidentei contabile a cheltuielilor pentru fiecare subprogram și pe subdiviziunile clasificației bugetare, atât pentru bugetul aprobat, cat și în execuție.
Art. 57 - Ministerul Sănătății Publice, respectiv Casa Naționala de Asigurări de Sănătate, asigura fondurile pentru finanțarea programelor naționale de sănătate, respectiv a subprogramelor, pe baza cererilor fundamentate ale ordonatorilor de credite secundari și terțiari, care vor solicita finanțarea în funcție de realizarea indicatorilor.
Capitolul IV - Dispoziții finale
Art. 58 - În termen de 3 zile de la intrarea în vigoare a prezentului titlu, se aproba Regulamentul de organizare și funcționare a Agenției Naționale pentru Programe de Sănătate, prin ordin al ministrului sănătății publice.
Titlul III - Asistența medicală primara
Capitolul I - Dispoziții generale
Art. 59 - (1) Obiectul prezentului titlu îl constituie reglementarea domeniului asistenței medicale primare, asigurata prin serviciile de medicina de familie.
(2) Termenul asistența medicală primara defineste furnizarea ingrijirilor de sănătate cuprinzatoare, de prim-contact, indiferent de natura problemei de sănătate, în contextul unei relații continue cu pacientii, în prezenta bolii sau în absenta acesteia.
(3) Domeniul definit la alin. (2) face obiectul specialitatii medicina de familie.
Art. 60 - În înțelesul prezentului titlu, termenii și notiunile folosite au următoarea semnificație:
a) asistența medicală primara – segmentul de asistența medicală care furnizează îngrijiri ce întrunesc toate caracteristicile menționate la art. 59 alin. (2) și având ca furnizor specializat și de sine statator cabinetul de medicina de familie;
b) medicina de familie – specialitatea medicală clinica, de practica publică autorizata, dobandita în condițiile legii;
c) medicul specialist de medicina de familie – medicul care a obținut specialitatea medicina de familie, în condițiile legii;
d) medicul de medicina generală – absolventul de învățământ medical superior, cu diploma de licență obținută anterior promotiei 2005, care nu a urmat pregătirea într-o specialitate și care a dobândit drept de libera practica în baza reglementărilor anterioare prezentei legi;
e) medic de familie – medicul specialist de medicina de familie și, prin asimilare, medicul de medicina generală; acest termen nu constituie un titlu profesional;
f) cabinetul de medicina de familie – cabinetul specializat în furnizarea de servicii medicale în asistența medicală primara și care are ca reprezentant legal/titular un medic de familie;
g) grupul de practica – asocierea formala a doi sau mai mulți medici de familie titulari de cabinete de medicina de familie, în vederea furnizarii de servicii și/sau a utilizării în comun a unor resurse;
h) patrimoniul de afectatiune profesională – totalitatea bunurilor, drepturilor și obligațiilor medicului afectate scopului exercitării profesiei sale, constituite ca o fracțiune distinctă a patrimoniului medicului, separată de gajul general al creditorilor acestuia;
i) praxisul de medicina de familie – reuneste patrimoniul de afectatiune profesională, infrastructura cabinetului, aflată în proprietatea sau în folosință medicului, și clientela;
j) episodul de îngrijire – totalitatea consultatiilor/ interventiilor determinate de o problemă de sănătate, din momentul apariției sale până la remisiunea completa;
k) serviciile de medicina de familie – serviciile furnizate de un cabinet de medicina de familie unei populații desemnate;
l) cabinete santinela – cabinete de medicina de familie care utilizează sisteme speciale de înregistrare continua a episoadelor de îngrijire la nivelul asistenței medicale primare, pentru populatiile deservite.
Capitolul II - Medicul de familie
Art. 61 - (1) Medicul de familie este furnizorul de îngrijiri de sănătate care coordonează și integreaza serviciile medicale furnizate pacientilor de către el însuși sau de către alți furnizori de servicii de sănătate.
(2) Medicul de familie asigura accesul în sistemul sanitar pentru pacientii săi, la nivelurile de competența cele mai adecvate nevoilor acestora.
Art. 62 - Medicul de familie acorda îngrijiri persoanelor în contextul familiei și, respectiv, familiilor în cadrul comunității, fără discriminare.
Art. 63 - Caracteristicile asistenței acordate de medicul de familie sunt următoarele:
a) constituie punctul de prim-contact în cadrul sistemului de sănătate, oferind acces nediscriminatoriu pacientilor și ocupandu-se de toate problemele de sănătate ale acestora;
b) folosește eficient resursele sistemului de sănătate, coordonând asistența medicală acordată pacientilor; colaborează cu ceilalți furnizori de servicii din asistența medicală primara și asigura legătură cu celelalte specialități;
c) este orientata către individ, familie și comunitate;
d) se bazează pe comunicarea directa medic-pacient, care conduce în timp la stabilirea unei relații interumane de încredere, în care pacientul devine un partener responsabil al medicului pentru menținerea/restabilirea propriei sănătăți;
e) asigura continuitatea actului medical și a ingrijirilor determinate de nevoile pacientilor;
f) rezolva problemele de sănătate acute și cronice ale pacientilor;
g) promovează sănătatea și starea de bine a pacientilor prin intervenții adecvate și eficiente;
h) urmărește rezolvarea problemelor de sănătate ale comunității.
Art. 64 - (1) Medicul de familie este competent din punct de vedere profesional sa furnizeze ingrijirile cuprinzatoare de care are nevoie o persoană.
(2) Începând cu promotia 2005 de absolvenți licentiati ai instituțiilor de învățământ superior medical, competentele profesionale în specialitatea medicina de familie se dobândesc numai prin rezidentiat.
(3) Medicii de medicina generală prevăzuți la art. 60 lit. d), care la data aderării României la Uniunea Europeană furnizează servicii de asistența medicală primara în sistemul asigurărilor sociale de sănătate, își pot continua activitatea în aceleași condiții și după această dată.
Art. 65 - Pentru medicii de medicina generală cu drept de libera practica, care la data intrării în vigoare a prezentei legi nu sunt confirmati rezidenți în specialitatea medicina de familie, dar furnizează în regim salarial sau independent servicii de medicina de familie în cabinete acreditate în cadrul sistemului de asigurări sociale de sănătate, sau care au întrerupt temporar, în condițiile legii, exercitarea profesiei, vor fi organizate modalități flexibile de formare în specialitatea medicina de familie.
Capitolul III - Cabinetul de medicina de familie
Art. 66 - Asistența medicală primara se desfășoară în cabinete de medicina de familie înființate în condițiile legii.
Art. 67 - Asistența medicală primara se poate asigura prin practica individuală a medicilor de familie sau prin diferite forme de asociere a cabinetelor în grupuri de practica, în locatii comune sau prin integrarea funcțională a unor cabinete cu locatii distincte.
Art. 68 - Activitatea cabinetelor de medicina de familie se desfășoară prin medicii titulari, personalul angajat și colaboratorii externi.
Art. 69 - (1) Autorizarea infiintarii unui nou cabinet de medicina de familie într-o localitate se realizează în conformitate cu prevederile legale. Începând cu data aderării României la Uniunea Europeană, autorizarea infiintarii unui nou cabinet de medicina de familie se va face numai pentru medicii specialiști de medicina de familie. Metodologia se stabilește prin norme aprobate prin hotărâre a Guvernului.
(2) Preluarea activității unui praxis existent de către un alt medic de familie, în condițiile încetării activității medicului titular, se face prin vânzarea patrimoniului de afectatiune profesională. Noul titular va aduce la cunoștința autorităților de sănătate publică teritoriale, caselor de asigurări de sănătate, respectiv pacientilor, preluarea praxisului. Criteriile și metodologia de preluare se stabilesc prin norme aprobate prin ordin al ministrului sănătății publice.
Art. 70 - (1) Un medic de familie poate fi titularul unui singur cabinet.
(2) Cabinetele de medicina de familie acreditate pot deschide puncte de lucru. Criteriile și metodologia vor fi precizate în normele prevăzute la art. 69 alin. (1).
Capitolul IV - Serviciile furnizate în cadrul asistenței medicale primare
Art. 71 - Cabinetul de medicina de familie furnizează servicii medicale către pacientii:
a) asigurați, înscriși pe lista proprie sau a altor cabinete;
b) neasigurati.
Art. 72 - Cabinetul de medicina de familie poate desfășura următoarele activități:
a) intervenții de prima necesitate în urgentele medico-chirurgicale;
b) activități de medicina preventivă;
c) activități medicale curative;
d) activități de îngrijire la domiciliu;
e) activități de îngrijiri paliative;
f) activități de consiliere;
g) alte activități medicale, în conformitate cu atestatele de studii complementare;
h) activități de învățământ în specialitatea medicina de familie, în cabinetele medicilor instructori formatori;
i) activități de cercetare științifică;
j) activități de suport.
Art. 73 - Activitățile medicale se pot desfășura la sediul cabinetului, la domiciliul pacientilor, în centrele de permanenta, în alte locatii special amenajate și autorizate sau la locul solicitării, în cazul interventiilor de prima necesitate în urgentele medico-chirurgicale ori în caz de risc epidemiologic.
Art. 74 - Cabinetul de medicina de familie poate oferi servicii medicale esențiale, servicii medicale extinse și servicii medicale adiționale.
Art. 75 - (1) Serviciile medicale esențiale sunt acele servicii, definitorii pentru domeniul de competența al asistenței medicale primare, care sunt oferite de toți medicii de familie în cadrul consultatiei medicale.
(2) Serviciile prevăzute la alin. (1) sunt următoarele:
a) intervenții de prima necesitate în urgentele medico-chirurgicale;
b) asistența curenta a solicitărilor acute;
c) monitorizarea bolilor cronice, care cuprinde: supraveghere medicală activa pentru cele mai frecvente boli cronice, prescripții de tratament medicamentos și/sau igieno-dietetic, coordonarea evaluărilor periodice efectuate de către medici de alta specialitate decât cea de medicina de familie;
d) servicii medicale preventive, precum: imunizari, monitorizarea evoluției sarcinii și lauziei, depistare activa a riscului de imbolnavire pentru afecțiuni selecționate conform dovezilor științifice, supraveghere medicală activa, la adulti și copii asimptomatici cu risc normal sau ridicat, pe grupe de vârsta și sex.
Art. 76 - Serviciile medicale extinse sunt acele servicii care pot fi furnizate la nivelul asistenței medicale primare în mod optional și/sau în anumite condiții de organizare, precum:
a) servicii speciale de consiliere;
b) planificare familială;
c) unele proceduri de mica chirurgie;
d) servicii medico-sociale: îngrijiri la domiciliu, îngrijiri terminale.
Art. 77 - Serviciile medicale adiționale reprezintă manopere și tehnici însușite de medicii practicieni, certificate prin atestate de studii complementare și/sau care necesita dotări speciale.
Art. 78 - (1) Colectarea și transmiterea de date pentru supravegherea bolilor comunicabile se realizează prin sisteme informationale de rutina, care cuprind un set minimal de date, într-un format unic, obligatoriu a fi transmise de către toți furnizorii de servicii medicale și al căror conținut, metodologie de colectare și raportare se stabilesc prin hotărâre a Guvernului.
(2) Supravegherea epidemiologica detaliată și colectarea de date privind utilizarea serviciilor medicale de către pacienti reprezintă un serviciu distinct și se realizează prin cabinetele santinela. Acestea pot contracta servicii cu instituțiile interesate.
Art. 79 - Cabinetele de medicina de familie în care își desfășoară activitatea medici formatori de medicina de familie pot oferi prestații de formare medicală, în cadrul colaborării cu instituții de învățământ superior medical sau cu organizații acreditate ca furnizori de educație medicală continua, precum și activități de cercetare, conform dispozițiilor legale în vigoare.
Capitolul V - Finanțarea medicinei de familie
Art. 80 - Cabinetul de medicina de familie poate realiza venituri din:
a) contracte încheiate cu casele de asigurări de sănătate din cadrul sistemului de asigurări sociale de sănătate, pentru serviciile esențiale definite în prezenta lege, decontate din fondul destinat asistenței medicale primare;
b) contracte încheiate cu casele de asigurări de sănătate din cadrul sistemului de asigurări sociale de sănătate, pentru serviciile extinse și adiționale definite în prezenta lege și decontate din fondurile destinate acestora;
c) contracte încheiate cu societățile de asigurări private de sănătate;
d) contracte pentru servicii furnizate în cadrul programelor de sănătate publică;
e) contracte încheiate cu autoritățile teritoriale de sănătate publică, pentru servicii de medicina comunitara;
f) contracte încheiate cu terți, pentru servicii aferente unor competente suplimentare;
g) plata directa de la consumatori, pentru serviciile necontractate cu terți plătitori;
h) coplata aferentă unor activități medicale;
i) contracte de cercetare;
j) contracte pentru activitatea didactica în educația universitară și postuniversitară;
k) donații, sponsorizări;
l) alte surse, conform dispozițiilor legale, inclusiv din valorificarea aparaturii proprii, uzata fizic sau moral.
Art. 81 - Sumele alocate pentru finanțarea cabinetelor de medicina de familie din Fondul național unic de asigurări sociale de sănătate vor fi stabilite în cadrul negocierii Normelor de aplicare a contractului-cadru anual, conform prevederilor legale.
Capitolul VI - Rolul și obligațiile asistenței medicale primare în sistemul sanitar
Art. 82 - În procesul de furnizare de servicii cabinetele medicilor de familie colaborează cu toate celelalte specialități medicale, cu respectarea specificului specialitatii și asigurarea transmiterii reciproce a tuturor datelor relevante cu privire la starea pacientului.
Art. 83 - Obligațiile personalului și cabinetelor de medicina de familie se reglementează prin acte normative, după cum urmează:
a) obligațiile de etica și deontologie profesională – prin legile și codurile de deontologie profesională care guvernează exercitarea profesiilor reglementate în sistemul sanitar;
b) obligațiile privind sănătatea publică – conform reglementărilor legale în vigoare și dispozițiilor autorităților de sănătate publică;
c) obligațiile față de sistemul asigurărilor sociale de sănătate – prin contractul-cadru, normele anuale de aplicare și contractele cu casele de asigurări;
d) obligațiile privind relațiile de muncă – prin contractul de muncă anual la nivel de ramura sanitară și contractele individuale/colective de muncă ale angajaților, precum și prin alte prevederi legale speciale;
e) obligațiile față de pacienti – prin îndeplinirea prevederilor specifice din actele normative prevăzute la lit. a) și c), precum și din legislația privind drepturile pacientului;
f) obligațiile privind managementul evidentei medicale primare și a informatiei medicale gestionate – prin reglementările legale în vigoare;
g) obligațiile privind protecția mediului și gestionarea deșeurilor rezultate din activitatea medicală – prin reglementările legale în vigoare;
h) obligația de educație/formare continua și de dezvoltare profesională a resursei umane din asistența medicală primara – prin reglementările legale în vigoare.
Capitolul VII - Dispoziții finale
Art. 84 - În termen de 60 de zile de la intrarea în vigoare a prezentului titlu, Ministerul Sănătății Publice va elabora norme metodologice de aplicare a prezentului titlu, aprobate prin hotărâre a Guvernului.
Art. 85 - La data intrării în vigoare a prezentului titlu, orice dispoziție contrară prevederilor prezentei legi se abroga.
Titlul IV - Sistemul național de asistența medicală de urgenta și de prim ajutor calificat
Capitolul I - Dispoziții generale
Secţiunea 1 - Definiții
Art. 86 - (1) În înțelesul prezentului titlu, în sistemul național de servicii medicale de urgenta și de prim ajutor calificat, termenii și notiunile folosite au următoarea semnificație:
a) Sistemul național de servicii medicale de urgenta și prim ajutor calificat – ansamblul de structuri, forte, mecanisme și relații, organizate după aceleași principii și reguli, care utilizează proceduri integrate de management specializat și/sau calificat;
b) asistența publică integrată de urgenta – asistența asigurata de instituțiile publice de stat aflate în structurile Ministerului Sănătății Publice, Ministerului Administrației și Internelor și/sau în structura autorităților publice locale, precum și de Serviciul de Telecomunicații Speciale prin Direcția pentru apel unic de urgenta 1-1-2. Ea include ansamblul de măsuri și activități cu caracter logistic, tehnic și medical, destinate în principal salvării și păstrării vieții;
c) asistența medicală privată de urgenta – ansamblul de măsuri și activități cu caracter logistic și medical, având ca scop principal salvarea și păstrarea vieții, asigurata de serviciile private de urgenta aparținând unor organizații nonguvernamentale, care funcționează în scop umanitar, nonprofit, sau unor firme, asociații ori persoane fizice, care funcționează în scop comercial;
d) asistența medicală de urgenta – ansamblul de măsuri diagnostice și terapeutice întreprinse de către personal medical calificat. Ea poate fi acordată la diferite niveluri de către medici și asistenți medicali cu diferite grade de pregătire;
e) urgenta medicală – accidentarea sau îmbolnăvirea acuta, care necesita acordarea primului ajutor calificat și/sau a asistenței medicale de urgenta, la unul sau mai multe niveluri de competența, după caz. Ea poate fi urgenta cu pericol vital, unde este necesară/sunt necesare una sau mai multe resurse de intervenție în faza prespitaliceasca, continuand ingrijirile într-un spital local, județean ori regional, sau urgenta fără pericol vital, unde ingrijirile pot fi efectuate, după caz, cu sau fără utilizarea unor resurse prespitalicesti, la un centru ori cabinet medical autorizat sau, după caz, la un spital;
f) pacient critic – pacientul cu funcțiile vitale instabile sau cu afecțiuni care pot avea complicatii ireversibile și care necesita intervenție medicală de urgenta sau îngrijiri într-o secție de terapie intensiva generală sau specializată;
g) primul ajutor de baza – efectuarea unor acțiuni salvatoare de viața unor persoane care au suferit o accidentare sau imbolnavire acuta, de către persoane fără pregătire medicală, fără utilizarea unor echipamente specifice acestui scop. Primul ajutor de baza se acordă de orice persoană instruita în acest sens sau de persoane fără instruire, la indicațiile personalului din dispeceratele de urgenta;
h) primul ajutor calificat – efectuarea unor acțiuni salvatoare de viața unor persoane care au suferit o accidentare sau imbolnavire acuta, de către personal paramedical care a urmat cursuri speciale de formare și care are în dotare echipamentele specifice acestui scop, inclusiv defibrilatoare semiautomate, funcționând sub forma de echipe de prim ajutor într-un cadru institutionalizat;
i) defibrilator semiautomat – defibrilatorul care are drept caracteristici minime efectuarea analizei ritmului cardiac într-un mod automat sau în urma apasarii unui buton de către salvator, alegerea energiei socului în vederea defibrilarii în mod automat, încărcarea la nivelul energiei necesare pentru defibrilare în mod automat, urmând ca declanșarea socului să se efectueze de către salvator, la comanda verbală și/sau scrisă a defibrilatorului;
j) spital local/centru local de urgenta – spitalul la nivelul unui municipiu, al unui oraș, respectiv centru de permanenta, cu competentele și resursele umane și materiale necesare rezolvarii unei părți din urgentele locale, urmând ca urgentele ce nu pot fi rezolvate definitiv să fie stabilizate și transferate către spitalul județean sau direct către spitalul regional, după caz, în conformitate cu protocoalele în vigoare;
k) spital județean de urgenta – spitalul aflat în reședința unui județ, care deține competentele și resursele umane și materiale în vederea asigurării ingrijirilor medicale definitive de urgenta pentru majoritatea cazurilor care provin din județul respectiv și care nu pot fi tratate definitiv la nivel local, în spitalele municipale sau orășenești ori în centrele de permanenta, în conformitate cu protocoalele în vigoare;
l) spital regional de urgenta – spitalul clinic județean cu competente interjudetene, care deține competentele și resursele umane și materiale suplimentare necesare în vederea asigurării ingrijirilor medicale definitive pentru cazurile medicale complexe, mai ales în cazul urgentelor și al pacientilor aflați în stare critica, pentru toate cazurile ce nu pot fi rezolvate local, în spitalele municipale și orășenești, la nivelul județului respectiv, precum și pentru toate cazurile din județele arondate, ce nu pot fi rezolvate definitiv la nivelul spitalelor județene din cauza lipsei de resurse materiale și/sau umane ori din cauza complexității cazului, în conformitate cu protocoalele în vigoare. Spitalul regional de urgenta îndeplinește rolul spitalului județean de urgenta în județul în care se afla;
m) serviciul de ambulanta județean, respectiv al municipiului București – unitățile sanitare publice de importanța strategica, cu personalitate juridică, aflate în coordonarea departamentului de specialitate din Ministerul Sănătății Publice și a autorităților de sănătate publică județene, respectiv a municipiului București, având în structura lor un compartiment pentru asistența medicală de urgenta și transport medical asistat, cu echipaje medicale de urgenta, cu sau fără medic, și un compartiment pentru consultații medicale de urgenta la domiciliu și transport sanitar neasistat. Compartimentul pentru asistența medicală de urgenta funcționează în regim de lucru continuu, în asteptarea solicitărilor de asistența medicală de urgenta;
n) transport medical asistat – transportul de urgenta al pacientilor care necesita monitorizare și îngrijiri medicale pe durata transportului, asigurate de medic sau asistent medical, utilizând ambulante tip B sau C;
o) transport sanitar neasistat – transportul pacientilor care nu se afla în stare critica și nu necesita monitorizare și îngrijiri medicale speciale pe durata transportului. Transportul sanitar neasistat se efectuează cu ambulante tip A1 sau A2, precum și cu alte tipuri de autovehicule decât ambulantele tip B și C, aflate în dotarea serviciilor de ambulanta;
p) ambulanta tip C – ambulanta destinată intervenției medicale de urgenta la cel mai înalt nivel și transportului medical asistat al pacientului critic, fiind dotată cu echipamente, materiale și medicamente de terapie intensiva. Echipajul ambulantei tip C este condus obligatoriu de un medic special pregătit, iar vehiculul este astfel construit încât să permită accesul la pacientul aflat în vehicul din toate părțile, targa fiind amplasata în mijloc, cu posibilitatea mutării acesteia la dreapta și la stanga și ridicării ei la o înălțime care să permită acordarea asistenței medicale de urgenta în mod corespunzător. Ambulantele de transport al nou-nascutilor aflați în stare critica fac parte din categoria ambulantelor tip C;
q) ambulanta tip B – ambulanta destinată intervenției de urgenta și transportului medical asistat al pacientilor. Ea poate fi, după caz, utilizata în acordarea primului ajutor calificat sau în acordarea asistenței medicale de urgenta. Dotarea ambulantei tip B este formată din echipamente și materiale sanitare care includ, după caz, un defibrilator semiautomat sau un defibrilator manual și medicamentele necesare resuscitarii și acordării asistenței medicale de urgenta;
r) ambulanta tip A1 – ambulanta destinată transportului sanitar neasistat al unui singur pacient, fiind dotată cu echipamentele și materialele minime necesare acordării primului ajutor în caz de nevoie;
s) ambulanta tip A2 – ambulanta destinată transportului sanitar neasistat al unuia sau al mai multor pacienti pe targa și/sau scaune, fiind dotată cu echipamentele și materialele minime necesare acordării primului ajutor în caz de nevoie;
t) Serviciul mobil de urgenta, reanimare și descarcerare (SMURD) – unitatea de intervenție publică integrată, de importanța strategica, fără personalitate juridică, având în structura sa echipe integrate de reanimare, specializate în acordarea asistenței medicale și tehnice de urgenta, precum și echipe cu personal paramedical, specializat în acordarea primului ajutor calificat. SMURD funcționează în cadrul inspectoratelor pentru situații de urgenta, având ca operator aerian structurile de aviatie ale Ministerului Administrației și Internelor, în colaborare cu spitalele județene, regionale și cu autoritățile publice locale;
u) unitate de primire a urgentelor (UPU) – secția sau secția clinica aflată în structura unui spital județean, regional sau în structura spitalelor aparținând ministerelor și instituțiilor cu rețele sanitare proprii, cu personal propriu, special pregătit, destinată triajului, evaluării și tratamentului de urgenta al pacientilor cu afecțiuni acute, care se prezintă la spital spontan sau care sunt transportați de ambulante;
v) compartiment de primire a urgentelor (CPU) – secția aflată în structura unui spital orasenesc, municipal sau în structura spitalelor aparținând ministerelor și instituțiilor cu rețele sanitare proprii, cu personal propriu, special pregătit, destinată triajului, evaluării și tratamentului de urgenta al pacientilor cu afecțiuni acute, care se prezintă la spital spontan sau care sunt transportați de ambulante;
w) Sistemul național unic pentru apeluri de urgenta – 1-1-2 ansamblul integrat de puncte publice de acces al cetățeanului la sistemul public de urgenta prin care este activat răspunsul adecvat de urgenta. Punctul public de acces este realizat prin integrarea centrului unic de apel de urgenta și a dispeceratelor serviciilor publice specializate de intervenție;
x) centrul unic de apel de urgenta – structura specializată de preluare și transfer al apelurilor de urgenta primite la numărul unic de apel 1-1-2 și la numărul de apel 961 redirectionat către 1-1-2 până la transformarea acestuia în număr comercial la dispoziția serviciilor de ambulanta județene și al municipiului București;
y) dispecerat medical de urgenta – structura specializată de preluare și tratare a apelurilor de urgenta cu caracter medical, primite prin centrul unic de apel de urgenta sau la un număr propriu, în cazul serviciilor private de ambulanta. Dispeceratele medicale de urgenta sunt coordonate de personal cu pregătire medicală superioară, în serviciu permanent;
z) dispeceratul integrat de urgenta – structura specializată care, pe lângă preluarea apelului la numărul de urgenta, asigura alarmarea și coordonarea echipajelor de intervenție ale tuturor serviciilor specializate de intervenție, cu caracter medical și nemedical, din aceeași locatie fizica. Coordonarea se face de către personal special pregătit, având un coordonator medical cu studii superioare din cadrul serviciului de ambulanta sau SMURD, în serviciu permanent.
(2) În înțelesul prezentului titlu, în sistemul național de servicii medicale de urgenta și de prim ajutor calificat, termenii și notiunile folosite au următoarea semnificație:
a) centre de expertiza și coordonare medicală la distanta centrele aflate în structura unor dispecerate medicale sau în structura unor centre de apel unic 1-1-2, destinate furnizarii de informații de specialitate specifice necesare echipajelor de urgenta din teren și/sau spitalelor de urgenta, precum și coordonării la distanta a echipajelor de prim ajutor calificat, pe baza informațiilor primite telefonic de la membrii echipajelor sau pe baza informațiilor și a datelor primite prin sistemele telemedicale de transmisie de date;
b) misiuni de salvare aeriană – intervenții primare sau secundare ce se desfășoară utilizând aeronave special dotate, respectând standardele în vigoare, în vederea salvării unei/unor vieți aflate în pericol din cauza unei accidentari sau îmbolnăviri acute ori care se afla într-un mediu ostil vieții;
c) misiuni de ambulanta aeriană – transporturi sanitare, planificate în prealabil, în care starea pacientului sau a pacientilor nu impune efectuarea unei misiuni de salvare aeriană. Misiunile de ambulanta aeriană pot include și cazurile critice transportate pe distanțe lungi, ce nu pot fi efectuate decât cu avionul sanitar;
d) misiuni de salvare navala – misiuni primare sau secundare care se desfășoară în zone accesibile mai rapid sau numai prin utilizarea de ambarcatiuni special dotate, respectând standardele în vigoare, în vederea salvării persoanelor aflate în pericol din cauza unei accidentari sau îmbolnăviri acute;
e) consultatia de urgenta la domiciliu – asistența medicală de urgenta acordată de compartimentul de consultații și transport sanitar neasistat al serviciilor de ambulanta, în colaborare cu medicii de familie, cazurilor medicale de urgenta care nu pun viața pacientului în pericol imediat și care, cel mai probabil, nu necesita transportul la o unitate sanitară;
f) personal paramedical – personalul fără pregătire medicală, instruit special la diferite niveluri în acordarea primului ajutor calificat, utilizând echipamente specifice, inclusiv defibrilatoarele semiautomate externe, activând în echipe, într-un cadru institutionalizat;
g) ambulantierul – personal fără pregătire medicală care a absolvit cursurile de ambulantieri, autorizate de Ministerul Sănătății Publice, pentru a activa în cadrul serviciilor de ambulanta;
h) accident colectiv – evenimentul care implica un număr de victime, care necesita declanșarea unui plan special de intervenție utilizând forte de intervenție suplimentare față de cele aflate de garda la momentul respectiv. Numărul victimelor pentru care este necesară declanșarea unui plan special de intervenție diferă de la caz la caz, luându-se în considerare resursele umane și materiale de intervenție disponibile în zona în care are loc accidentul.
Secţiunea a 2-a - Primul ajutor de baza și primul ajutor calificat
Art. 87 - (1) Acordarea primului ajutor de baza, fără echipamente specifice, se efectuează de orice persoană instruita în acest sens sau de persoane fără instruire prealabilă actionand la indicațiile personalului specializat din cadrul dispeceratelor medicale de urgenta sau al serviciilor de urgenta prespitaliceasca de tip SMURD și serviciului de ambulanta județean sau al municipiului București, având ca scop prevenirea complicatiilor și salvarea vieții până la sosirea unui echipaj de intervenție.
(2) Fiecare cetățean are obligația sa anunțe direct sau să se asigure ca un caz de urgenta a fost anuntat deja, la numărul 1-1-2, înainte sau concomitent cu acordarea primului ajutor, fiind obligat să respecte indicațiile specializate oferite de personalul dispeceratului de urgenta.
(3) Acordarea primului ajutor calificat se efectuează în regim public, este o datorie a statului și un drept al cetățeanului și nu poate fi efectuată în scop comercial.
(4) Primul ajutor calificat se acordă într-un cadru institutionalizat, de echipe aflate sub coordonarea inspectoratelor pentru situații de urgenta, în colaborare cu autoritățile publice locale și structurile Ministerului Sănătății Publice.
(5) Echipele de prim ajutor calificat vor fi dotate cu echipamente specifice, inclusiv pentru defibrilare semiautomata.
(6) Personalul din cadrul echipajelor de prim ajutor calificat și ambulantierii vor fi formati și autorizați în utilizarea defibrilatoarelor semiautomate.
(7) Echipele de prim ajutor pot opera utilizând ambulante tip B, conform normelor și standardelor naționale și europene în vigoare, și autospeciale de intervenție fără capacitate de transport pacient, dotate cu echipamentele specifice, inclusiv defibrilatoare semiautomate.
(8) Acordarea primului ajutor calificat este organizată astfel încât timpul maxim de sosire la locul intervenției de la apelul de urgenta sa nu depășească:
a) 8 minute, pentru echipajele de prim ajutor calificat, în zonele urbane, la cel puțin 90% din cazurile de urgenta;
b) 12 minute, pentru echipajele de prim ajutor calificat, în zonele rurale, la cel puțin 75% din cazurile de urgenta.
(9) Organizațiile nonguvernamentale și cele nonprofit pot participa în aceasta activitate, pe baza unor protocoale de colaborare cu inspectoratele pentru situații de urgenta și cu autoritățile publice locale.
(10) Salvamontul, Salvamarul, Jandarmeria montană, Unitatea Specială de Intervenție în Situații de Urgenta din subordinea Inspectoratului General pentru Situații de Urgenta și alte instituții publice similare pot avea personal instruit în primul ajutor calificat, care acționează în cadrul misiunilor specifice de salvare asigurate de aceste instituții.
Art. 88 - (1) Persoanele fără pregătire medicală care acorda primul ajutor de baza în mod voluntar, pe baza indicațiilor furnizate de un dispecerat medical sau a unor cunoștințe în domeniul primului ajutor de baza, actionand cu buna-credința și cu intenția de a salva viața sau sănătatea unei persoane, nu răspund penal sau civil.
(2) Personalul paramedical nu răspunde penal ori civil, după caz, dacă se constata, potrivit legii, îndeplinirea de către acesta, cu buna-credința, a oricărui act în legătură cu acordarea primului ajutor calificat, cu respectarea competentei acordate, protocoalelor și procedurilor stabilite în condițiile legii.
Art. 89 - (1) Personalul paramedical care activează în cadrul echipajelor de prim ajutor calificat este pregătit în instituțiile de învățământ și în centrele de formare specializate aflate în structura Inspectoratului General pentru Situații de Urgenta și/sau în alte centre de formare autorizate și acreditate aflate în structura instituțiilor publice care dețin echipaje de prim ajutor calificat conform prezentei legi.
(2) Formarea personalului specializat în acordarea primului ajutor calificat se va efectua pe baza unui program aprobat de inspectorul general al Inspectoratului General pentru Situații de Urgenta, acreditat și autorizat de Ministerul Sănătății Publice și Ministerul Educației și Cercetării. Acesta include condițiile de certificare și recertificare a personalului, precum și necesitățile de formare continua.
Art. 90 - Finanțarea activității echipajelor de prim ajutor calificat și dotarea acestora se fac de la bugetul de stat, bugetul autorităților publice locale și din alte resurse financiare prevăzute în lege, inclusiv sponsorizări și donații.
Secţiunea a 3-a - Asistența medicală publică de urgenta
Art. 91 - (1) Asistența medicală publică de urgenta în faza prespitaliceasca este asigurata de serviciile de ambulanta județene și de cel al municipiului București, precum și de echipajele integrate ale Serviciilor mobile de urgenta, reanimare și descarcerare (SMURD), aflate în structura inspectoratelor pentru situații de urgenta, a autorităților publice locale și a spitalelor județene și regionale.
(2) Personalul medical, precum și personalul nemedical ambulantieri, pompieri și conducatori auto – din cadrul echipajelor care participa la acordarea asistenței medicale publice de urgenta în faza prespitaliceasca vor fi pregătite în centre de formare acreditate și autorizate de Ministerul Sănătății Publice.
(3) Personalul din cadrul centrelor de apel unic de urgenta 1-1-2, precum și din cadrul dispeceratelor medicale va fi special pregătit în centre de formare acreditate și autorizate de Ministerul Sănătății Publice, Ministerul Administrației și Internelor și Serviciul de Telecomunicații Speciale.
(4) Centrele de apel unic de urgenta 1-1-2 și dispeceratele medicale pot avea în structura lor centre de expertiza regionale, în vederea furnizarii unor informații specifice, precum și în vederea coordonării la distanta a activității echipajelor de prim ajutor calificat aflate în misiune, pe baza informațiilor obținute telefonic sau prin sisteme de transmisie de date.
(5) Asistența medicală publică de urgenta în faza prespitaliceasca se va acorda utilizând ambulante tip B și C, construite și dotate conform standardelor și normelor europene în vigoare. În acordarea asistenței medicale publice de urgenta se pot utiliza și autospeciale de transport echipaj medical, fără capacitate de transport pacient, nave, aeronave, precum și alte mijloace autorizate de Ministerul Sănătății Publice.
(6) Asistenții medicali din cadrul echipajelor de urgenta prespitaliceasca vor fi instruiti și autorizați în utilizarea defibrilatoarelor semiautomate, iar medicii vor fi unicii autorizați în utilizarea defibrilatoarelor manuale.
(7) Asistența medicală publică de urgenta în faza spitaliceasca este asigurata de spitalele orășenești, municipale, județene și regionale aflate în structura Ministerului Sănătății Publice și/sau a autorităților publice locale.
Art. 92 - (1) Acordarea asistenței medicale publice de urgenta, la toate nivelurile ei, este o datorie a statului și un drept al cetățeanului. Aceasta va include și misiunile de salvare aeriană și navala.
(2) Acordarea asistenței medicale publice de urgenta nu poate avea un scop comercial.
(3) Asistența medicală de urgenta în prespital va fi organizată astfel încât timpul maxim de sosire la locul intervenției de la apelul de urgenta sa nu depășească:
a) 15 minute, pentru echipajele de urgenta sau de terapie intensiva, în zonele urbane, la cel puțin 90% din cazurile de urgenta;
b) 20 de minute, pentru echipajele de urgenta sau de terapie intensiva, în zonele rurale, la cel puțin 75% din cazurile de urgenta.
Art. 93 - (1) Finanțarea acordării asistenței medicale publice de urgenta se face de la bugetul de stat, prin bugetul Ministerului Sănătății Publice și bugetul Ministerului Administrației și Internelor, din bugetul Fondului național unic de asigurări sociale de sănătate, din bugetul autorităților publice locale, precum și din alte surse prevăzute prin lege, inclusiv donații și sponsorizări.
(2) Donațiile și sponsorizarile către serviciile publice de urgenta nu pot fi efectuate în vederea obținerii unor privilegii care duc la discriminare în acordarea asistenței de urgenta, cum ar fi: asigurarea asistenței medicale de urgenta sau a primului ajutor calificat în mod preferențial donatorului, sponsorului sau altor persoane.
(3) Serviciile medicale publice de urgenta pot achizitiona echipamente, autospeciale și alte mijloace de intervenție direct, în sistem leasing sau contractand credite având ca sursa de finanțare veniturile proprii și/sau bugetul de stat, precum și alte surse prevăzute de lege, inclusiv donații și sponsorizări.
(4) În cadrul sumelor alocate de la bugetul de stat potrivit alin. (1), Ministerul Sănătății Publice va asigura în cadrul programelor de sănătate fonduri pentru spitalele regionale de urgenta și spitalele județene de urgenta de grad II, pentru îngrijirea cazurilor critice ale căror costuri nu pot fi acoperite din fondurile obținute pe baza contractelor cu casele de asigurări de sănătate.
(5) Unitățile și compartimentele de primire a urgentelor din cadrul spitalelor de urgenta sunt finanțate în mod distinct cu sumele necesare acordării asistenței medicale de urgenta sub forma unui procent calculat din veniturile obținute de spitalul în structura căruia se afla, în baza contractelor încheiate cu casele de asigurări de sănătate, luându-se în considerare numărul total al pacientilor, procentul cazurilor critice și nivelul de competența al personalului care activează în UPU sau CPU. Stabilirea procentului se face prin normele de aplicare a prezentului titlu.
Secţiunea a 4-a - Asistența medicală privată de urgenta
Art. 94 - (1) Asistența medicală privată de urgenta în faza prespitaliceasca este asigurata de serviciile private de ambulanta, pe baza unui contract direct cu beneficiarul, cu asiguratorul privat al acestuia sau la solicitarea directa a beneficiarului ori a oricărei alte persoane, cu consimțământul acestuia.
(2) Personalul medical, precum și personalul nemedical care participa la acordarea asistenței medicale private de urgenta în faza prespitaliceasca sunt pregătite în centre de formare acreditate și autorizate de Ministerul Sănătății Publice. Programele de formare prevăd condițiile de certificare a personalului medical, necesitățile de formare continua și recertificarea acestuia.
Art. 95 - (1) Asistența medicală privată de urgenta în faza spitaliceasca este asigurata de spitalele private, pe baza unui contract direct cu beneficiarul, cu asiguratorul privat al acestuia sau la solicitarea directa a beneficiarului ori a apartinatorilor acestuia. În cazul pacientilor cu funcțiile vitale în pericol, spitalele private au obligația de a acorda gratuit primul ajutor, până la transferul acestora în condiții de siguranță la un spital public.
(2) Asistența medicală privată de urgenta este acordată de instituții private, cu respectarea standardelor minime de calitate și de operare impuse serviciilor publice de Ministerul Sănătății Publice.
(3) Asistența medicală privată de urgenta include și misiuni de ambulanta aeriană asigurate în baza unor contracte cu beneficiarii sau cu asiguratorii privati ai acestora.
Art. 96 - Publicitatea și reclama pentru asistența medicală privată de urgenta cu scop comercial vor specifică întotdeauna, în mod clar, ca numerele de apel nu sunt gratuite și ca serviciile se prestează contra cost.
Capitolul II - Acordarea asistenței publice medicale și tehnice de urgenta și a primului ajutor calificat
Art. 97 - Asistența publică de urgenta prespitaliceasca este coordonata la nivel județean sau regional de dispeceratele medicale specializate, utilizând infrastructura Sistemului național unic pentru apeluri de urgenta, în conformitate cu prevederile legale în vigoare și cu normele de aplicare a prezentei legi. În activitatea de dispecerizare se utilizează clasificarea unica a cazurilor de urgenta, denumita index medical, și setul de indicații și planuri de acțiune și coordonare asociate indexului medical și specificului local, care sunt aprobate de Ministerul Sănătății Publice, Ministerul Administrației și Internelor și Serviciul de Telecomunicații Speciale.
Art. 98 - (1) Asistența publică de urgenta prespitaliceasca se organizează la nivel rural, urban, județean/al municipiului București și regional.
(2) Asistența publică de urgenta prespitaliceasca se acordă la diferite niveluri de competența, începând cu primul ajutor calificat, asigurat de echipajele aflate la nivel rural, până la nivelul intervenției de salvare aeriană cu personal medical specializat, care operează la nivel regional.
(3) Competentele și atribuțiile echipajelor publice de intervenție de diferite niveluri în faza prespitaliceasca se stabilesc prin ordin comun al ministrului sănătății publice și al ministrului administrației și internelor.
(4) Ministerele și instituțiile cu rețele sanitare proprii pot avea în administrarea lor servicii proprii de ambulanta, sub forma de proprietate publică sau privată a statului.
(5) La nivel spitalicesc, asistența medicală de urgenta se asigura în spitalele orășenești, municipale, județene și regionale și ale municipiului București, precum și ale ministerelor și instituțiilor publice cu rețele sanitare proprii.
(6) În spitale pot opera unități proprii de transport sanitar medicalizat, pentru transportul interclinic al pacientilor proprii, precum și al nou-nascutilor aflați în stare critica. Modul de organizare și funcționare a acestor unități se va stabili prin normele de aplicare a prezentului titlu.
(7) Primul ajutor calificat și asistența medicală de urgenta se acordă fără nici o discriminare legată de, dar nu limitată la, venituri, sex, vârsta, etnie, religie, cetățenie sau apartenența politică, indiferent dacă pacientul are sau nu calitatea de asigurat medical.
(8) Personalul medical și cel paramedical instruit în primul ajutor calificat au obligația ca în afară programului, indiferent de loc, sa acorde primul ajutor, spontan sau la cerere, persoanelor aflate în pericol vital, până la preluarea acestora de către un echipaj de intervenție specializat.
(9) Echipajele medicale publice de urgenta, precum și echipajele de prim ajutor calificat, în cazuri deosebite, pot acorda asistența de urgenta și în afară zonelor de responsabilitate, la solicitarea dispeceratelor de urgenta.
(10) Asistența medicală de urgenta la spectacole în aer liber, festivaluri și manifestări sportive se solicita obligatoriu de către organizator, pe baza unor contracte încheiate cu serviciile private sau publice de urgenta prespitaliceasca. Autoritățile publice aproba desfășurarea acestor evenimente numai în cazul în care asistența medicală de urgenta este asigurata în mod adecvat, conform normelor în vigoare.
Art. 99 - (1) Serviciile publice de urgenta prespitaliceasca nu pot fi subcontractate de serviciile private în vederea acoperirii lipsei de mijloace ale serviciilor private. Ele nu pot acordă prioritate clienților serviciilor private sau unor clienți proprii și nu pot rezerva echipaje de urgenta pentru înlocuirea unor echipaje ale unor servicii private.
(2) Societățile comerciale care au în proprietatea lor servicii private de ambulanta nu pot acorda donații sau sponsorizări serviciilor publice de urgenta prespitaliceasca.
(3) Serviciile publice de urgenta pot presta servicii contra cost unor societăți comerciale, altele decât serviciile de ambulanta private, cluburi sportive sau instituții, în vederea asigurării asistenței de urgenta în cazul unor manifestări sportive sau de alta natura, pe durata limitată, cu condiția ca personalul și mijloacele folosite în asigurarea evenimentului sa nu fie retrase din resursele necesare asigurării asistenței de urgenta a populației în intervalul respectiv.
Art. 100 - (1) Pentru realizarea managementului integrat al urgentelor se creează o rețea regionala de spitale, având un spital regional de urgenta de gradul I și, în județele arondate acestuia, spitale de urgenta de gradul II sau III. În fiecare regiune va funcționa minimum un spital de urgenta de gradul II, într-un alt județ din afară centrului regional de gradul I.
(2) Criteriile de clasificare a spitalelor de urgenta locale și județene, din punct de vedere al competentelor și resurselor materiale și umane, se aproba prin ordin al ministrului sănătății publice.
Art. 101 - (1) Spitalele regionale de urgenta se înființează în regiunile de dezvoltare socioeconomica, având la baza resursele umane și materiale aflate în centrele universitare traditionale.
(2) În structura spitalelor regionale de urgenta se afla toate specialitatile chirurgicale și medicale din structura spitalului județean din județul respectiv, precum și infrastructura pentru investigații clinice și paraclinice și orice alta specialitate unica, cu caracter de urgenta, aflată în afară structurii spitalului județean din județul respectiv.
(3) Spitalele regionale și județene de urgenta au în structura lor unități de primire a urgentelor.
(4) Conducerea și organizarea unităților de primire a urgentelor se vor face conform normelor de aplicare a prezentului titlu.
(5) Medicii și asistenții-șefi ai unităților de primire a urgentelor nu pot fi sponsorizati și/sau finantati, direct sau indirect, pentru participare la conferințe, congrese și alte tipuri de manifestări, de către firmele care comercializează produse farmaceutice și/sau materiale sanitare ori firmele care reprezintă interesele acestora și nici de către firmele de aparatura medicală. În situații speciale, bine justificate, se pot obține excepții doar cu aprobarea Ministerului Sănătății Publice.
(6) Spitalele municipale și orășenești pot avea compartimente de primire a urgentelor sau camere de reanimare în zonele de recepție a urgentelor, acestea urmând a fi deservite de personalul de garda din spital și/sau de medici de urgenta special angajați.
(7) Spitalele regionale de urgenta și spitalele județene de urgenta au în responsabilitate, prin unitățile de primire a urgentelor, echipaje integrate publice de intervenție prespitaliceasca terestra (SMURD), în colaborare cu structurile Ministerului Administrației și Internelor și cu autoritățile publice locale, care sunt coordonate de dispeceratele Sistemului național unic pentru apelul de urgenta.
(8) Spitalele regionale de urgenta au în responsabilitate echipaje integrate publice de salvare aeriană, respectând prevederile legale în vigoare.
(9) Implementarea prevederilor alin. (7) și (8) se realizează gradual, conform unui plan aprobat prin ordin comun al ministrului sănătății publice și al ministrului administrației și internelor, având la baza resursele materiale și umane disponibile.
(10) Arondarea județelor la centrele regionale se efectuează pe baza ordinului ministrului sănătății publice, luându-se în considerare regiunile de dezvoltare socio-economică din care fac parte, precum și distanțele aeriene și terestre dintre un spital județean și un anumit centru regional.
(11) În structura spitalelor regionale și a spitalelor de urgenta de gradele II și III funcționează unități de primire a urgentelor, corespunzătoare nivelului centrului în care se afla și numărului cazurilor de urgenta asistate anual.
(12) Spitalele regionale de urgenta au obligația de a monitoriza și de a îndrumă metodologic întreaga activitate de asistența medicală de urgenta din regiunile pe care le deservesc.
(13) Modalitățile de monitorizare și îndrumare, precum și modalitățile de colectare a datelor se stabilesc prin ordin al ministrului sănătății publice.
Art. 102 - (1) Spitalele județene de urgenta, precum și spitalele regionale de urgenta au obligația de a accepta transferul pacientilor aflați în stare critica, dacă spitalul sau centrul unde se afla pacientul respectiv nu are resursele umane și/sau materiale necesare acordării asistenței de urgenta în mod corespunzător și definitiv și dacă transferul este necesar în vederea salvării vieții pacientului.
(2) Centrele și spitalele locale de urgenta, precum și spitalele județene de urgenta organizează transferul pacientilor critici, în mod corespunzător, evitand întârzierile nejustificate, către un centru superior, dacă rezolvarea definitivă a cazului depășește competentele sau resursele spitalului în care se afla aceștia.
(3) Protocoalele de transfer interclinic al pacientului critic se aproba prin ordin al ministrului sănătății publice. Spitalele regionale și cele județene de urgenta, precum și spitalele de urgenta din municipiul București vor furniza dispeceratului de urgenta, periodic sau la solicitare, datele necesare privind locurile și resursele medicale disponibile pentru rezolvarea cazurilor de urgenta.
(4) Criteriile de internare de urgenta a pacientilor care sunt consultați și asistați în unitățile/compartimentele de primire a urgentelor, precum și criteriile de transfer de urgenta către alte spitale vor fi stabilite prin normele de aplicare a prezentului titlu.
Capitolul III - Acordarea asistenței medicale private de urgenta
Art. 103 - (1) Asistența medicală privată de urgenta în faza prespitaliceasca este coordonata la nivelul dispeceratului propriu al furnizorului de servicii de către personal medical cu studii superioare.
(2) Asistența medicală privată de urgenta în faza prespitaliceasca se organizează pe o zona stabilită de furnizorul de servicii, cu condiția ca acesta să aibă mijloacele necesare acoperirii zonei respective în timpii prevăzuți pentru serviciile publice pentru diferite categorii de urgenta.
(3) Asistența medicală privată de urgenta în faza prespitaliceasca este asigurata cu ambulante și echipamente care respecta normele și standardele minime impuse serviciilor publice de urgenta prespitaliceasca.
Art. 104 - (1) Serviciile medicale private de urgenta prespitaliceasca nu pot contracta serviciile publice în vederea acoperirii unor zone sau activități care nu pot fi acoperite prin capacitatea proprie.
(2) Serviciile medicale private spitalicești de urgenta se organizează în structura spitalelor private, respectând standardele minime impuse de Ministerul Sănătății Publice pentru serviciile publice spitalicești de urgenta.
(3) Serviciile medicale private de urgenta spitaliceasca au obligația de a stabiliza orice pacient care soseste în serviciul respectiv în stare critica sau cu acuze ce ridica suspiciunea unei afecțiuni acute grave, indiferent de capacitatea financiară a acestuia de a achită costurile tratamentului și de calitatea sa de asigurat, acesta putând fi transportat la un spital public, în condiții corespunzătoare, numai după stabilizarea funcțiilor vitale și acordarea tratamentului de urgenta.
(4) În cazul în care nu au în structura servicii de garda, spitalele private au obligația sa acorde primul ajutor și sa alerteze serviciile de urgenta publice prin numărul unic pentru apeluri de urgenta 1-1-2.
Capitolul IV - Serviciile de ambulanta județene și al municipiului București
Art. 105 - (1) Serviciile de ambulanta județene și al municipiului București sunt servicii publice cu personalitate juridică.
(2) Serviciile de ambulanta județene și al municipiului București au ca scop principal acordarea asistenței medicale de urgenta și transportul medical asistat, utilizând, după caz, personal medical superior și/sau mediu calificat la diferite niveluri, precum și conducatori auto formati ca ambulantieri.
(3) Personalul de intervenție din cadrul serviciilor de ambulanta județene și al municipiului București va purta echipamente de protecție distincte conform normelor și reglementărilor în vigoare.
Art. 106 - (1) Serviciile de ambulanta județene și al municipiului București au în structura lor doua compartimente distincte: compartimentul de asistența medicală de urgenta și transport medical asistat și compartimentul de consultații de urgenta și transport sanitar neasistat.
(2) Compartimentul de asistența medicală de urgenta are în dotare ambulante tip B și C și alte mijloace de intervenție autorizate în vederea asigurării asistenței medicale de urgenta cu sau fără medic.
(3) În cazul în care echipajele de urgenta sunt fără medic, acestea vor funcționa cu un asistent medical ca șef de echipaj. Echipajele pot include și personal voluntar special pregătit.
(4) Ambulantele tip B și C și celelalte mijloace de intervenție specifice din cadrul compartimentului de asistența medicală de urgenta nu vor fi utilizate în scop de consultații de urgenta la domiciliu sau transport sanitar neasistat al pacientilor stabili, fără probleme medicale acute.
Art. 107 - (1) Compartimentul de asistența medicală de urgenta efectuează și transporturi medicale asistate ale pacientilor critici și ale celor cu accidentari sau îmbolnăviri acute, care necesita supraveghere din partea unui asistent medical ori medic și monitorizarea cu echipamentele medicale specifice.
(2) Compartimentul de asistența medicală de urgenta funcționează în regim de asteptare și este finanțat din venituri proprii obținute din contractele cu casele de asigurări de sănătate sau din alte surse în condițiile legii, de la bugetul de stat pe bază de programe, din donații și sponsorizări.
(3) Compartimentul de asistența medicală de urgenta poate avea în organigrama personal medical cu studii superioare, personal medical cu studii medii, ambulantieri, operatori registratori de urgenta și dispeceri/radiotelefonisti, precum și alte categorii de personal necesare funcționarii compartimentului.
Art. 108 - (1) Compartimentul de consultații de urgenta și transport sanitar funcționează ca structura distinctă în cadrul serviciilor de ambulanta județene și al municipiului București, având în organigrama sa personal medical cu studii superioare, personal medical cu studii medii, conducatori auto ambulantieri și alte categorii de personal necesare funcționarii acestuia.
(2) În dotarea compartimentului de consultații de urgenta și transport sanitar se afla ambulante tip A1 și A2, precum și alte mijloace de transport autorizate conform standardelor și reglementărilor naționale și europene, precum și autoturisme de transport pentru medicii de garda în vederea efectuării consultatiilor la domiciliu.
(3) În cadrul compartimentului de consultații de urgenta și transport pot efectua garzi și medici de familie din afară structurii serviciilor de ambulanta.
(4) Coordonarea activității de consultații de urgenta se face prin dispeceratul medical de urgenta, aceasta putând fi realizată, unde este posibil, în colaborare cu medicii de familie.
(5) Compartimentul de consultații de urgenta și transport sanitar neasistat funcționează în regim de garda și/sau ture de cel mult 12 ore.
Art. 109 - Activitatea de transport sanitar neasistat va fi efectuată de ambulantieri și asistenți sau doar de ambulantieri, după caz.
Art. 110 - (1) Activitatea de consultații de urgenta la domiciliu și cea de transport sanitar neasistat sunt finanțate din venituri proprii obținute din contractele cu casele de asigurări de sănătate sau din alte surse în condițiile legii, din donații și sponsorizări.
(2) Activitatea de consultații de urgenta la domiciliu și de transport sanitar neasistat poate fi externalizata parțial sau total, ea putând fi contractată ori subcontractata de servicii private de ambulanta și de transport sanitar direct cu Casa Naționala de Asigurări de Sănătate sau sub forma unui subcontract cu serviciile publice de ambulanta.
(3) Serviciile de reparații auto, aprovizionare, alimentare cu carburanți, alimentare cu oxigen medicinal, piese auto și curățenie pot fi externalizate prin contract de parteneriat public-privat, contract de asociere prin participațiune sau închirieri, sumele rezultate constituind venituri proprii ale serviciului de ambulanta contractant.
Art. 111 - (1) Conducerea serviciilor de ambulanta județene și al municipiului București este formată din:
a) manager general, care poate fi medic, economist sau jurist cu studii în management;
b) director medical;
c) un comitet director format din managerul general, directorul medical, directorul economic, directorul tehnic, asistentul-șef, medicii sau asistenții coordonatori ai substatiilor serviciului de ambulanta, un reprezentant al autorității de sănătate publică județene, respectiv a municipiului București, și un reprezentant al autorităților publice locale.
(2) Membrii comitetului director vor fi numiți de managerul general, cu excepția reprezentantului autorității de sănătate publică și a reprezentantului autorităților publice locale, care vor fi numiți de conducerile instituțiilor din care fac parte.
(3) Managerul general și membrii comitetului director nu pot beneficia de sponsorizări și/sau finanțări, direct ori indirect, pentru participare la conferințe, congrese și alte tipuri de manifestări, de către firmele care comercializează produse farmaceutice și/sau materiale sanitare ori firmele care reprezintă interesele acestora, firmele de aparatura medicală, precum și firmele care comercializează ambulante și alte vehicule de intervenție sau reprezentanții acestora. În situații speciale, bine justificate, se pot obține excepții doar cu aprobarea ministrului sănătății publice.
(4) Coordonarea activității compartimentului de urgenta se realizează la nivel județean și al municipiului București de un medic specialist sau primar în medicina de urgenta, anestezie-terapie intensiva ori cu atestat în domeniul asistenței medicale de urgenta prespitaliceasca. La nivelul substatiilor, în lipsa unui medic, compartimentul de urgenta poate fi coordonat de un asistent medical.
(5) Coordonarea activității de consultații de urgenta la domiciliu se va efectua de către un medic specialist sau medic primar în medicina de familie, medicina generală, pediatrie ori medicina interna.
(6) Coordonarea activității de transport sanitar neasistat se realizează de către un asistent medical.
(7) Managerul general încheie cu autoritatea de sănătate publică un contract de management pe o perioadă maxima de 3 ani. Postul de manager general se va ocupa prin concurs, contractul putând fi prelungit în urma evaluării activității depuse.
(8) Membrii comitetului director vor încheia un contract de administrare cu managerul general.
(9) Conținutul contractului de management, precum și al contractului de administrare, remunerarea și indemnizațiile aferente managerului general și membrilor comitetului director vor fi stabilite prin ordin al ministrului sănătății publice.
(10) Funcția de manager general este incompatibilă cu:
a) exercitarea unor funcții în cadrul unei autorități executive, legislative ori judecătorești, pe toată durata mandatului, precum și cu deținerea de orice alte funcții salarizate;
b) deținerea mai multor funcții de manager salarizate sau nesalarizate;
c) deținerea unei funcții de conducere salarizate în cadrul Colegiului Medicilor din România, Colegiului Medicilor Dentisti din România, Colegiului Farmacistilor din România, Ordinului Asistentilor Medicali și Moașelor din România sau al filialelor locale ale acestora ori al organizațiilor sindicale de profil.
(11) Constituie conflict de interese deținerea de părți sociale sau de acțiuni de către membrii comitetului director personal ori de către rudele și afinii lor până la gradul al IV-lea la societăți comerciale sau organizații nonguvernamentale care stabilesc relații comerciale cu serviciul de ambulanta respectiv.
(12) Managerul general și membrii comitetului director au obligația de a depune o declarație de interese, precum și de a semna o declarație cu privire la incompatibilitățile prevăzute la alin. (10), în termen de 15 zile de la numirea în funcție, la Ministerul Sănătății Publice. Aceste declarații vor fi actualizate ori de câte ori intervin schimbări care trebuie înscrise în ele. Actualizarea se face în termen de 30 de zile de la data începerii modificării sau încetării funcțiilor ori activităților. Declarațiile se vor afișa pe site-ul serviciului de ambulanta respectiv. Modelul declarației de interese și cel al declarației referitoare la incompatibilități se aproba prin ordin al ministrului sănătății publice.
Capitolul V - Serviciile mobile de urgenta, reanimare și descarcerare (SMURD)
Art. 112 - Serviciile mobile de urgenta, reanimare și descarcerare sunt structuri publice integrate de intervenție, fără personalitate juridică, care funcționează în organigrama inspectoratelor pentru situații de urgenta, respectiv a Unității Speciale de Intervenție în Situații de Urgenta, având ca operator aerian structurile de aviatie ale Ministerului Administrației și Internelor, precum și, concomitent, după caz, în structura autorităților publice locale și/sau a unor spitale județene și regionale de urgenta.
Art. 113 - (1) Serviciile mobile de urgenta, reanimare și descarcerare au în structura lor, după caz, echipaje de intervenție specializate în acordarea primului ajutor calificat, reanimarea, descarcerarea și executarea operațiunilor de salvare, inclusiv salvarea aeriană.
(2) Echipajele integrate de terapie intensiva mobila din cadrul Serviciilor mobile de urgenta, reanimare și descarcerare sunt formate din cel puțin 4 persoane, dintre care un conducător auto pompier și un medic special pregătit provenit dintr-o structura spitaliceasca de primire a urgentelor. Celelalte persoane din echipajele integrate de terapie intensiva mobila pot fi asigurate de inspectoratele pentru situații de urgenta, de autoritățile publice locale și/sau de structurile spitalicești. În cadrul acestor echipaje pot acționa și voluntari special pregatiti.
(3) Echipajele de prim ajutor sunt formate din cel puțin 3 persoane cu pregătire paramedicala din structura inspectoratelor pentru situații de urgenta, Unitatea Specială de Intervenție în Situații de Urgenta și/sau din structura autorităților publice locale. Echipajele pot include și personal voluntar special pregătit.
(4) Echipajele de salvare aeriană funcționează conform reglementărilor specifice prevăzute de lege.
(5) Echipajele integrate de terapie intensiva mobila au în dotare ambulante tip C, conform standardelor și reglementărilor naționale și europene.
(6) Echipajele de prim ajutor calificat au în dotare ambulante tip B, echipate conform standardelor și reglementărilor naționale și europene, inclusiv cu defibrilatoare semiautomate.
(7) Echipajele de prim ajutor calificat pot acționa și cu autospeciale de intervenție din dotarea inspectoratelor pentru situații de urgenta, respectiv ale Unității Speciale de Intervenție în Situații de Urgenta, fără capacitate de transport pacient, cu condiția de a fi dotate cu echipamentele specifice, inclusiv cu defibrilator semiautomat.
Art. 114 - (1) Serviciile mobile de urgenta, reanimare și descarcerare, cu excepția componentei de salvare aeriană, sunt coordonate operativ de inspectoratele pentru situații de urgenta, respectiv de Unitatea Specială de Intervenție în Situații de Urgenta, având ca medic-șef un medic specialist sau primar în medicina de urgenta ori anestezie-terapie intensiva, provenind dintr-o structura spitaliceasca de primire a urgentelor dintr-un spital regional ori județean de urgenta, după caz.
(2) Personalul din cadrul Serviciilor mobile de urgenta, reanimare și descarcerare își desfășoară activitatea zilnica purtând uniformele și gradele profesionale și/sau ierarhice specifice aprobate prin ordin al ministrului administrației și internelor. Pentru intervenție personalul va purta echipamente de protecție distincte conform normelor și reglementărilor în vigoare.
(3) Coordonarea activității zilnice de intervenție a echipajelor Serviciilor mobile de urgenta, reanimare și descarcerare se face prin dispeceratele integrate județene de urgenta sau, după caz, prin dispeceratele medicale ale serviciilor de ambulanta județene și al municipiului București.
(4) Echipajele de prim ajutor calificat pot fi dispecerizate direct, după caz, inclusiv de centrele 1-1-2 și/sau de dispeceratele inspectoratelor pentru situații de urgenta, pe baza unor protocoale încheiate în prealabil cu dispeceratele medicale ale serviciilor de ambulanta județene și al municipiului București.
(5) În situația în care un echipaj de prim ajutor este dispecerizat direct de un centru 1-1-2 sau de un dispecerat al unui inspectorat pentru situații de urgenta, dispeceratul medical va fi informat în momentul dispecerizarii echipajului de prim ajutor, iar echipajul de prim ajutor va menține legătură cu dispeceratul medical în vederea raportarii și coordonării medicale a activității echipajului.
(6) Echipajele de salvare aeriană vor fi alertate conform prevederilor legale în vigoare, ele putând fi alertate și direct prin 1-1-2, urmând ca medicul de garda sa decidă oportunitatea intervenției pe baza informațiilor obținute de la centrul 1-1-2 și de la dispeceratele medicale și ale inspectoratelor pentru situații de urgenta, de la centrul operational/punctele operationale ale Unității Speciale de Aviatie din cadrul Ministerului Administrației și Internelor sau direct de la locul incidentului.
Art. 115 - (1) Activitatea Serviciilor mobile de urgenta, reanimare și descarcerare este finanțată de la bugetul de stat, prin bugetul Ministerului Sănătății Publice și al Ministerului Administrației și Internelor, de la bugetul autorităților publice locale, precum și din alte surse prevăzute de lege, inclusiv din donații și sponsorizări.
(2) Activitatea cu caracter medical a echipajelor de terapie intensiva mobila, de salvare aeriană, precum și materialele consumabile pentru acordarea primului ajutor calificat utilizate de personalul paramedical al inspectoratelor pentru situații de urgenta și al autorităților publice locale este finanțată din bugetul Fondului național unic de asigurări sociale de sănătate prin spitalele care coordonează medical activitatea la nivel județean și la nivelul municipiului București, precum și de la bugetul de stat și prin alte surse financiare prevăzute în lege.
(3) Medicii-șefi ai Serviciilor mobile de urgenta, reanimare și descarcerare nu pot beneficia de sponsorizări și/sau finanțări, direct ori indirect, pentru participare la conferințe, congrese și alte tipuri de manifestări de către firmele care comercializează produse farmaceutice și/sau materiale sanitare ori firmele care reprezintă interesele acestora, firmele de aparatura medicală și nici de către firmele care comercializează ambulante și alte vehicule de intervenție sau reprezentanții acestora. În situații speciale, bine justificate, se pot obține excepții doar cu aprobarea, după caz, a ministrului sănătății publice sau a ministrului administrației și internelor.
Art. 116 - Dotarea cu echipamente și mijloace de intervenție a Serviciilor mobile de urgenta, reanimare și descarcerare va fi asigurata de Ministerul Sănătății Publice, Ministerul Administrației și Internelor și de autoritățile publice locale. Achiziționarea acestora poate fi realizată inclusiv prin sistem leasing sau credit în condițiile legii.
Capitolul VI - Asistența de urgenta în caz de accidente colective, calamitati și dezastre în faza prespitaliceasca
Art. 117 - (1) Asistența de urgenta în cazul accidentelor colective, calamităților și dezastrelor va fi coordonata de inspectoratele județene pentru situații de urgenta, respectiv al municipiului București, sau direct de Inspectoratul General pentru Situații de Urgenta conform planurilor naționale aprobate.
(2) Pentru situații de accidente colective, calamitati sau dezastre, cu urmări deosebit de grave, se vor întocmi planuri de acțiune comune și cu celelalte instituții cu atribuții în domeniu, care vor fi puse în aplicare la solicitarea Inspectoratului General pentru Situații de Urgenta.
(3) În situații de accidente colective, calamitati sau dezastre, cu urmări deosebit de grave, acordarea asistenței la nivel spitalicesc se va face și în unitățile spitalicești aparținând ministerelor și instituțiilor cu rețea sanitară proprie.
Art. 118 - (1) Serviciile publice de urgenta prespitaliceasca intra cu toate forțele planificate sub comanda unica a inspectorului-șef pentru situații de urgenta din județul respectiv care se subordonează direct prefectului județului și inspectorului general al Inspectoratului General pentru Situații de Urgenta.
(2) Inspectorul general pentru situații de urgenta poate solicita serviciilor de ambulanta județene și al municipiului București, precum și celorlalte ministere și instituții cu rețea sanitară proprie punerea la dispoziție a mijloacelor și a personalului necesar interventiilor în cazul unor accidente colective, calamitati sau dezastre, pe durata determinata.
(3) Medicii directori ai serviciilor de ambulanta județene și al municipiului București au obligația organizării sprijinului solicitat de inspectoratele pentru situații de urgenta.
(4) Medicii directori ai serviciilor de ambulanta județene și al municipiului București, precum și medicii-șefi ai unităților Serviciilor mobile de urgenta, reanimare și descarcerare fac parte din comitetele județene și al municipiului București pentru situații de urgenta.
Art. 119 - (1) Din momentul directionarii echipajelor către un accident colectiv sau o zona calamitata, încetează toate activitățile din cadrul serviciilor de ambulanta județene și al municipiului București care nu au caracter de urgenta. Echipajele de transport sanitar neasistat și de consultații de urgenta vor fi directionate către compartimentul de urgenta.
(2) Directorul serviciului de ambulanta județean, precum și cel al municipiului București au obligația de a dispune realizarea condițiilor necesare pentru îndeplinirea tuturor prevederilor planului de acțiune în caz de necesitate. Pentru rezolvarea cazurilor curente dispeceratul județean sau al municipiului București păstrează un număr minim de echipaje de urgenta, iar dacă situația o impune, se alerteaza personalul din turele libere.
(3) Serviciile de ambulanta județene și al municipiului București împreună cu inspectoratele pentru situații de urgenta întocmesc planul de acțiune în situații de urgenta pe baza listelor cu mijloacele din dotare, precum și cu personalul acestora transmise de toate instituțiile cu atribuții în domeniu.
(4) Echipajele din cadrul Serviciilor mobile de urgenta, reanimare și descarcerare sunt directionate cu prioritate către zona calamitata sau către accidentul colectiv ca echipaje de prim răspuns împreună cu echipajele de ambulanta disponibile.
(5) Inspectorul general al Inspectoratului General pentru Situații de Urgenta poate dispune echipajelor Serviciilor mobile de urgenta, reanimare și descarcerare dintr-un județ participarea la intervenție la un accident colectiv sau o zona calamitata din alt județ. La nevoie, el poate dispune, cu acordul președintelui Comitetului pentru Situații de Urgenta al Ministerului Sănătății Publice, participarea la intervenții, în alt județ, a unor echipaje ale serviciilor publice sau private de ambulanta dintr-un județ sau din municipiul București.
(6) Inspectorii-șefi ai inspectoratelor pentru situații de urgenta, la nevoie, pot solicita sprijinul serviciilor private de ambulanta în condițiile stabilite prin lege.
(7) În cazul epidemiilor și/sau pandemiilor, coordonarea activității de intervenție se face de către comitetele județene pentru situații de urgenta sau de Comitetul pentru Situații de Urgenta al Ministerului Sănătății Publice, după caz, potrivit legii.
Art. 120 - (1) Serviciile private de ambulanta au obligația de a răspunde solicitării comitetelor județene/al municipiului București, respectiv Comitetului pentru Situații de Urgenta al Ministerului Sănătății Publice ori Comitetului Național pentru Situații de Urgenta, în caz de accident colectiv, calamitati naturale sau dezastre, contravaloarea cheltuielilor rezultate fiind decontată, la tarifele Casei Naționale de Asigurări de Sănătate, din bugetul de stat ori din bugetul local.
(2) Inspectoratele județene pentru situații de urgenta și cel al municipiului București păstrează unitățile mobile de intervenție la accidente colective și dezastre, aflate în dotarea lor, în stare de funcționare, prin Serviciile mobile de urgenta, reanimare și descarcerare, în colaborare cu serviciile de ambulanta județene și al municipiului București, după caz.
(3) Serviciile medicale publice de urgenta prespitaliceasca care răspund de unitățile mobile pentru accidente colective și dezastre se asigura ca aparatura medicală este în stare de funcționare și ca unitatea este dotată cu medicamente și materiale, aflate în termen de valabilitate, suficiente pentru îngrijirea unui număr de minimum 20 de persoane aflate în stare critica.
(4) Managerii generali și directorii medicali ai serviciilor de ambulanta județene și al municipiului București, medicii-șefi ai Serviciilor mobile de urgenta, reanimare și descarcerare, precum și medicii-șefi ai unităților de primire a urgentelor vor urma cursuri în managementul dezastrelor organizate de Ministerul Sănătății Publice și/sau de Ministerul Administrației și Internelor.
Art. 121 - Finanțarea exercițiilor, a pregătirii și a interventiilor în caz de accidente colective, calamitati sau dezastre se face de la bugetul de stat și bugetul autorităților publice locale.
Capitolul VII - Dispoziții finale
Art. 122 - Normele de aplicare a prevederilor prezentului titlu se aproba prin ordin comun al ministrului sănătății publice și al ministrului administrației și internelor, în termen de 3 zile de la intrarea în vigoare a prezentului titlu, și se publică în Monitorul Oficial al României, Partea I.
Art. 123 - În scopul apărării dreptului cetățenilor la sănătate, securitate și viața, precum și în scopul prevenirii și limitării consecințelor unei calamitati naturale sau ale unui dezastru, personalului din cadrul serviciilor publice de urgenta spitalicești și prespitalicesti i se interzice participarea la greve sau la alte acțiuni revendicative menite sa afecteze activitatea prin scăderea capacității de intervenție sau a calității actului medical, organizate de sindicate sau de alte organizații, în timpul programului de lucru, normal sau prelungit.
Art. 124 - Prevederile art. 87 alin. (8) și ale art. 92 alin. (3) vor fi implementate gradual, conform normelor de aplicare a prezentului titlu, luându-se în considerare resursele și planurile de dezvoltare astfel încât termenul final sa nu depășească anul 2014.
Art. 125 - Nerespectarea prevederilor prezentului titlu atrage răspunderea juridică a persoanelor vinovate, în condițiile legii.
Titlul V - Asistența medicală comunitara
Capitolul I - Dispoziții generale
Art. 126 - (1) Dispozițiile prezentului titlu reglementează serviciile și activitățile din domeniul asistenței medicale comunitare.
(2) Asistența medicală comunitara cuprinde ansamblul de activități și servicii de sănătate organizate la nivelul comunității pentru soluționarea problemelor medico-sociale ale individului, în vederea menținerii acestuia în propriul mediu de viața și care se acordă în sistem integrat cu serviciile sociale.
Art. 127 - (1) Asistența medicală comunitara presupune un ansamblu integrat de programe și servicii de sănătate centrate pe nevoile individuale ale omului sanatos și bolnav, acordate în sistem integrat cu serviciile sociale.
(2) Programele și serviciile de asistența medicală comunitara se realizează în concordanta cu politicile și strategiile Ministerului Sănătății Publice, Ministerului Muncii, Solidarității Sociale și Familiei, Autorității Naționale pentru Persoanele cu Handicap, Agenției Naționale pentru Protecția Familiei, ale altor instituții ale autorității locale cu responsabilități în domeniu, precum și cu cele ale autorităților locale.
Capitolul II - Organizarea și funcționarea asistenței medicale comunitare
Art. 128 - (1) Pentru coordonarea programelor naționale de asistența medicală comunitara se înființează Comisia Interdepartamentala pentru Asistența Medicală Comunitara aflată în subordinea primului-ministru, denumita în continuare Comisia.
(2) Comisia se constituie dintr-un președinte și un număr impar de membri, reprezentanți ai Ministerului Sănătății Publice, Ministerului Muncii, Solidarității Sociale și Familiei, Autorității Naționale pentru Persoanele cu Handicap, Agenției Naționale pentru Protecția Familiei, Ministerului Administrației și Internelor, precum și ai organizațiilor sau asociațiilor autorităților locale.
(3) Atribuțiile, regulamentul de organizare și funcționare, precum și componenta nominală a Comisiei se stabilesc prin hotărâre a Guvernului.
Art. 129 - (1) Comisia se întrunește în ședințe ordinare de doua ori pe an și în ședințe extraordinare ori de câte ori este nevoie.
(2) Comisia primește sinteza rapoartelor anuale privind problemele medico-sociale de la nivelul comunităților.
Art. 130 - Comisia are următoarele atribuții:
a) realizează Strategia naționala în domeniul asistenței medicale comunitare;
b) întocmește lista de prioritati care să răspundă nevoilor identificate la nivelul comunităților;
c) propune ordonatorului de credite necesarul de fonduri pentru desfășurarea activităților din domeniul asistenței medicale comunitare.
Art. 131 - Comisia își realizează atribuțiile prevăzute la art. 130 cu suportul Unității de Management al Programelor de Asistența Medicală Comunitara.
Art. 132 - (1) Pentru realizarea programelor naționale de asistența medicală comunitara se înființează Unitatea de Management al Programelor de Asistența Medicală Comunitara (UMPAMC) în cadrul Școlii Naționale de Sănătate Publică și Management Sanitar, denumita în continuare UMPAMC.
(2) UMPAMC are drept atribuție principala sprijinul tehnic și metodologic pentru Comisia Interdepartamentala pentru Asistența Medicală Comunitara.
Art. 133 - Pentru realizarea atribuțiilor, UMPAMC poate solicita expertiza și suportul tehnic al specialiștilor din instituțiile aflate în subordinea și/sau în coordonarea Ministerului Sănătății Publice, Ministerului Muncii, Solidarității Sociale și Familiei, Autorității Naționale pentru Protecția Drepturilor Copilului, Ministerului Administrației și Internelor, Ministerului Finanțelor Publice și a altor organe ale autorității centrale cu responsabilități în domeniu.
Art. 134 - Programele naționale de asistența medicală comunitara se derulează prin instituțiile aflate în subordinea și/sau în coordonarea Ministerului Sănătății Publice, Ministerului Muncii, Solidarității Sociale și Familiei, Ministerului Administrației și Internelor și a ministerelor și instituțiilor cu rețea sanitară proprie.
Capitolul III - Beneficiarii, obiectivele și acordarea serviciilor și activităților de asistența medicală comunitara
Art. 135 - (1) Beneficiarul serviciilor și activităților de asistența medicală comunitara este comunitatea dintr-o arie geografică definită, precum: județul, orașul, comuna, satul, după caz, iar în cadrul acesteia în mod deosebit categoriile de persoane vulnerabile.
(2) Categoriile de persoane vulnerabile sunt persoanele care se găsesc în următoarele situații:
a) nivel economic sub pragul saraciei;
b) șomaj;
c) nivel educațional scăzut;
d) diferite dizabilitati, boli cronice;
e) boli aflate în faze terminale, care necesita tratamente paleative;
f) graviditate;
g) vârsta a treia;
h) vârsta sub 5 ani;
i) fac parte din familii monoparentale.
Art. 136 - (1) Serviciile și activitățile de asistența medicală comunitara sunt derulate de următoarele categorii profesionale:
a) asistent social;
b) asistent medical comunitar;
c) mediator sanitar;
d) asistent medical comunitar de psihiatrie;
e) asistent medical de îngrijiri la domiciliu.
(2) Categoriile profesionale prevăzute la alin. (1) lit. b)-d) se încadrează cu contract individual de muncă pe perioada determinata la unitățile sanitare desemnate, iar cheltuielile de personal se suporta în cadrul programelor naționale de sănătate.
(3) Categoriile profesionale prevăzute la alin. (1) colaborează cu autoritățile locale și cu serviciile de asistența medicală și socială.
(4) Categoriile profesionale care activează în domeniul asistenței medicale comunitare se includ în Clasificarea Ocupatiilor din România (C.O.R.).
Art. 137 - Obiectivele generale ale serviciilor și activităților de asistența medicală comunitara sunt:
a) implicarea comunității în identificarea problemelor medico-sociale ale acesteia;
b) definirea și caracterizarea problemelor medico-sociale ale comunității;
c) dezvoltarea programelor de intervenție, privind asistența medicală comunitara, adaptate nevoilor comunității;
d) monitorizarea și evaluarea serviciilor și activităților de asistența medicală comunitara;
e) asigurarea eficacitatii acțiunilor și a eficientei utilizării resurselor.
Art. 138 - Obiectivele generale ale asistenței medicale comunitare sunt:
a) educarea comunității pentru sănătate;
b) promovarea sănătății reproducerii și a planificarii familiale;
c) promovarea unor atitudini și comportamente favorabile unui stil de viața sanatos;
d) educație și acțiuni directionate pentru asigurarea unui mediu de viața sanatos;
e) activități de prevenire și profilaxie primara, secundară și tertiara;
f) activități medicale curative, la domiciliu, complementare asistenței medicale primare, secundare și tertiare;
g) activități de consiliere medicală și socială;
h) dezvoltarea serviciilor de îngrijire medicală la domiciliu a gravidei, nou-nascutului și mamei, a bolnavului cronic, a bolnavului mintal și a batranului;
i) activități de recuperare medicală.
Capitolul IV - Finanțare
Art. 139 - Finanțarea programelor de asistența comunitara se realizează cu fonduri din bugetul de stat, bugetul autorităților locale, precum și din alte surse, inclusiv din donații și sponsorizări, în condițiile legii.
Capitolul V - Dispoziții finale
Art. 140 - Ministerul Sănătății Publice va elabora, în colaborare cu Ministerul Muncii, Solidarității Sociale și Familiei și Ministerul Administrației și Internelor, norme de aplicare a prezentului titlu, în termen de 30 de zile de la data intrării în vigoare a acestuia.
Titlul VI - Efectuarea prelevarii și transplantului de organe, tesuturi și celule de origine umană în scop terapeutic
Capitolul I - Dispoziții generale
Art. 141 - Prelevarea și transplantul de organe, tesuturi și celule de origine umană se fac în scop terapeutic, în condițiile prezentului titlu.
Art. 142 - În înțelesul prezentului titlu, termenii și notiunile folosite au următoarele semnificatii:
a) celula – unitatea elementara anatomica și funcțională a materiei vii. În sensul prezentei legi, termenul celula/celule se referă la celula umană individuală sau la o colectie de celule umane, care nu sunt unite prin nici o formă de substanța intercelulara;
b) tesut – gruparea de celule diferențiată, unite prin substanța intercelulara amorfa, care formează împreună o asociere topografica și funcțională;
c) organ – partea diferențiată în structura unui organism, adaptată la o funcție definită, alcătuită din mai multe tesuturi sau tipuri celulare, prezentând vascularizatie și inervatie proprii;
d) prelevare – recoltarea de organe și/sau tesuturi și/sau celule de origine umană sanatoase morfologic și funcțional, cu excepția autotransplantului de celule stem hematopoietice când celulele sunt recoltate de la pacient, în vederea realizării unui transplant;
e) transplant – acea activitate medicală prin care, în scop terapeutic, în organismul unui pacient este implantat sau grefat un organ, tesut ori celula. Reglementările cuprinse în prezenta lege se adresează inclusiv tehnicilor de fertilizare în vitro;
f) donator – subiectul în viața sau decedat, de la care se preleveaza organe, tesuturi și/sau celule de origine umană pentru utilizare terapeutică;
g) primitor – subiectul care beneficiază de transplant de organe și/sau tesuturi și/sau celule.
Art. 143 - Coordonarea, supravegherea, aprobarea și implementarea oricăror dispoziții privind activitatea de transplant revin Agenției Naționale de Transplant.
Capitolul II - Donarea și donatorul de organe, tesuturi și celule de origine umană
Art. 144 - Prelevarea de organe, tesuturi și celule de origine umană de la donatorul în viața se face în următoarele condiții:
a) prelevarea de organe, tesuturi și celule de origine umană, în scop terapeutic, se poate efectua de la persoane majore în viața, având capacitate de exercițiu deplina, după obținerea consimțământului informat, scris, liber, prealabil și expres al acestora, conform modelului prevăzut în anexa nr. 1. Se interzice prelevarea de organe, tesuturi și celule de la persoane fără capacitate de exercițiu;
b) consimțământul se semnează numai după ce donatorul a fost informat de medic, asistentul social sau alte persoane cu pregătire de specialitate asupra eventualelor riscuri și consecințe pe plan fizic, psihic, familial și profesional, rezultate din actul prelevarii;
c) donatorul poate reveni asupra consimțământului dat, până în momentul prelevarii;
d) prelevarea și transplantul de organe, tesuturi și celule de origine umană ca urmare a exercitării unei constrângeri de natura fizica sau morala asupra unei persoane sunt interzise;
e) donarea și transplantul de organe, tesuturi și celule de origine umană nu pot face obiectul unor acte și fapte juridice, în scopul obținerii unui folos material sau de alta natură.
f) donatorul și primitorul vor semna un act legalizat prin care declara ca donarea se face în scop umanitar, are caracter altruist și nu constituie obiectul unor acte și fapte juridice în scopul obținerii unui folos material sau de alta natura, conform modelului prevăzut în anexa nr. 1.
Art. 145 - (1) Se interzice prelevarea de organe, tesuturi și celule de la potențiali donatori minori în viața, cu excepția cazurilor prevăzute în prezenta lege.
(2) Prin derogare de la alin. (1), în cazul în care donatorul este minor, prelevarea de celule stem hematopoietice medulare sau periferice se face în următoarele condiții:
a) prelevarea de celule stem hematopoietice medulare sau periferice de la minori se poate face numai cu consimțământul minorului dacă acesta a împlinit vârsta de 14 ani și cu acordul scris al ocrotitorului legal, respectiv al părinților, tutorelui sau al curatorului. Dacă minorul nu a împlinit vârsta de 14 ani, prelevarea se poate face cu acordul ocrotitorului legal;
b) în cazul donatorului care are cel puțin 14 ani, consimțământul acestuia, scris sau verbal, se exprima în fața președintelui tribunalului în a cărui circumscripție teritorială se afla sediul centrului unde se efectuează transplantul, după efectuarea obligatorie a unei anchete de către autoritatea tutelara competența, conform modelului prevăzut în anexa nr. 2.
(3) Refuzul scris sau verbal al minorului împiedica orice prelevare.
Art. 146 - (1) Prelevarea de organe, tesuturi sau celule de la donatorul viu se va efectua cu avizul comisiei de avizare a donarii de la donatorul viu, constituită în cadrul spitalului în care se efectuează transplantul; aceasta comisie va evalua motivatia donarii și va controla respectarea drepturilor pacientilor, conform modelului prevăzut în anexa nr. 1.
(2) Comisia de avizare a donarii de la donatorul viu va avea următoarea componenta: un medic cu pregătire în bioetica din partea colegiului medicilor județean sau al municipiului București, un psiholog sau un medic psihiatru și un medic primar, angajat al spitalului și având atribuții de conducere în cadrul acestuia, neimplicat în echipa de transplant.
(3) Aceasta comisie va funcționa conform unui regulament emis de Agenția Naționala de Transplant, cu consultarea Comisiei de bioetica a Ministerului Sănătății Publice. Regulamentul va fi aprobat prin ordin al ministrului sănătății publice.
(4) Comisia va evalua atât donatorul, cat și primitorul care vor fi supuși unui examen psihologic și/sau psihiatric, având ca scop testarea capacității de exercițiu, precum și stabilirea motivatiei donarii.
(5) Examenul psihologic/psihiatric va fi efectuat de un specialist, psiholog sau psihiatru, independent atât de echipa care efectuează transplantul, cat și de familiile donatorului și primitorului.
(6) Prelevarea, de la donatori vii, de sânge, piele, sperma, cap femural, placenta, sânge din cordonul ombilical, membrane amniotice, ce vor fi utilizate în scop terapeutic, se face cu respectarea regulilor de bioetica cuprinse în regulamentul comisiei de avizare a donarii de la donatorul viu, fără a fi necesar avizul acestei comisii.
(7) Datele privind donatorul și receptorul, inclusiv informațiile genetice, la care pot avea acces terțe părți, vor fi comunicate sub anonimat, astfel încât nici donatorul, nici receptorul sa nu poată fi identificati.
(8) Dacă donatorul nu dorește să-și divulge identitatea, se va respecta confidențialitatea donarii, cu excepția cazurilor în care declararea identității este obligatorie prin lege.
Art. 147 - Prelevarea de organe, tesuturi și celule de la donatorul decedat se face în următoarele condiții:
1. se defineste ca donator decedat fără activitate cardiaca persoana la care s-a constatat oprirea cardiorespiratorie iresuscitabila și ireversibila, confirmată în spital de 2 medici primari. Confirmarea donatorului decedat fără activitate cardiaca se face conform protocolului de resuscitare, prevăzut în anexa nr. 6, excepție făcând situațiile fără echivoc;
2. se defineste ca donator decedat cu activitate cardiaca persoana la care s-a constatat încetarea ireversibila a tuturor funcțiilor creierului, conform protocolului de declarare a morții cerebrale prevăzut în anexa nr. 3;
3. declararea morții cerebrale se face de către medici care nu fac parte din echipele de coordonare, prelevare, transplant de organe, tesuturi și celule de origine umană;
4. prelevarea de organe, tesuturi și/sau celule de la persoanele decedate se face numai cu consimțământul scris a cel puțin unu dintre membrii majori ai familiei sau al rudelor, în următoarea ordine: soț, părinte, copil, frate, sora. În absenta acestora, consimțământul va fi luat de la persoana autorizata, în mod legal, conform legislației în domeniu, sa îl reprezinte pe defunct; în ambele situații se procedează conform modelului prevăzut în anexa nr. 4;
5. prelevarea se poate face fără consimțământul membrilor familiei dacă, în timpul vieții, persoana decedata și-a exprimat deja opțiunea în favoarea donarii, printr-un act notarial de consimțământ pentru prelevare sau înscrierea în Registrul național al donatorilor de organe, tesuturi și celule, conform modelului prevăzut în anexa nr. 5;
6. prelevarea nu se poate face sub nici o formă dacă, în timpul vieții, persoana decedata și-a exprimat deja opțiunea împotriva donarii, prin act de refuz al donarii avizat de medicul de familie sau prin înscrierea în Registrul național al celor care refuza sa doneze organe, tesuturi și celule. Actul de refuz al donarii, avizat de medicul de familie, va fi prezentat de către apartinatori coordonatorului de transplant.
Art. 148 - (1) Prelevarea de organe, tesuturi și celule de la donatori decedati se efectuează numai după un control clinic și de laborator care să excludă orice boala infectioasa, o posibila contaminare sau alte afecțiuni care reprezintă un risc pentru primitor, conform protocoalelor stabilite pentru fiecare organ, tesut sau celula în parte.
(2) Repartiția organelor, tesuturilor și celulelor de origine umană prelevate la nivel național se efectuează de către Agenția Naționala de Transplant, în funcție de regulile stabilite de aceasta privind alocarea organelor, tesuturilor și celulelor de origine umană în cadrul sistemului de transplant din România.
(3) În condițiile în care pe teritoriul național nu exista nici un primitor compatibil cu organele, tesuturile și celulele de origine umană disponibile, acestea pot fi alocate în rețeaua internationala de transplant, pe baza unei autorizații speciale emise de Agenția Naționala de Transplant, conform modelului prevăzut în anexa nr. 7.
(4) fiesuturile și celulele de origine umană prelevate pot fi utilizate imediat pentru transplant sau pot fi procesate și depozitate în băncile de tesuturi și celule, acreditate sau agreate de Agenția Naționala de Transplant.
(5) Transplantul de tesuturi sau celule de origine umană se efectuează numai din băncile acreditate sau agreate de Agenția Naționala de Transplant.
(6) Fiecare prelevare de organ, tesut sau celula de origine umană este anunțată imediat și înregistrată în Registrul național de transplant, conform procedurilor stabilite de Agenția Naționala de Transplant.
(7) Medicii care au efectuat prelevarea de organe și tesuturi de la o persoană decedata vor asigura restaurarea cadavrului și a fizionomiei sale prin îngrijiri și mijloace specifice, inclusiv chirurgicale dacă este necesar, în scopul obținerii unei înfățișări demne a corpului defunctului.
(8) Prelevarea de organe, tesuturi și celule de origine umană, în cazuri medico-legale, se face numai cu consimțământul medicului legist și nu trebuie să compromita rezultatul autopsiei medico-legale, conform modelului prevăzut în anexa nr. 8.
(9) Introducerea sau scoaterea din țara de organe, tesuturi, celule de origine umană se face numai pe baza autorizației speciale emise de Agenția Naționala de Transplant, după modelul prevăzut în anexa nr. 7, respectiv anexa nr. 9, conform legislației vamale.
(10) Se interzice divulgarea oricărei informații privind identitatea donatorului cadavru, precum și a primitorului, exceptând cazurile în care familia donatorului, respectiv primitorul sunt de acord, precum și cazurile în care declararea identității este obligatorie prin lege. Datele privind donatorul și receptorul, inclusiv informațiile genetice, la care pot avea acces terțe părți, vor fi comunicate sub anonimat, astfel încât nici donatorul, nici receptorul sa nu poată fi identificati.
(11) Agenția Naționala de Transplant poate acorda servicii funerare și/sau transportul cadavrului, în cazul donatorilor de la care s-au prelevat organe și/sau tesuturi și/sau celule.
(12) După fiecare prelevare de organe, tesuturi și/sau celule de la donatorii cadavru se vor completa, cu datele din momentul prelevarii, Fișa de declarare a donatorului și Fișa de prelevare de organe și tesuturi, prevăzute în anexa nr. 10.
(13) Agenția Naționala de Transplant stabilește un sistem de vigilenta pentru raportarea, investigarea, înregistrarea și transmiterea informațiilor despre incidentele grave și reactiile adverse severe care pot influența calitatea și siguranța organelor, tesuturilor și celulelor, ce pot fi datorate procurării, testarii, procesarii, stocării și distribuției acestora, astfel încât orice reactie adversa severă observata în timpul sau după procedura de transplant ar putea fi legată de calitatea și siguranța organelor, tesuturilor și celulelor.
Capitolul III - Transplantul de organe, tesuturi și celule de origine umană
Art. 149 - Transplantul de organe, tesuturi și celule de origine umană se efectuează numai în scop terapeutic.
Art. 150 - Transplantul de organe, tesuturi și celule de origine umană se efectuează cu consimțământul scris al primitorului, după ce acesta a fost informat asupra riscurilor și beneficiilor procedeului, conform modelului prevăzut în anexa nr. 11.
Art. 151 - (1) În cazul în care primitorul este în imposibilitatea de a-și exprima consimțământul, acesta poate fi dat în scris de către unul din membrii familiei sau de către reprezentantul legal al acestuia, conform modelului prevăzut în anexa nr. 11.
(2) În cazul primitorului aflat în imposibilitatea de a-și exprima consimțământul, transplantul se poate efectua fără consimțământul prevăzut anterior dacă, datorită unor împrejurări obiective, nu se poate lua legătură în timp util cu familia ori cu reprezentantul legal al acestuia, iar întârzierea ar conduce inevitabil la decesul pacientului.
(3) Situația descrisă la alin. (2) va fi consemnată de medicul șef de secție și de medicul curant al pacientului, în formularul prevăzut în anexa nr. 12.
Art. 152 - În cazul minorilor sau persoanelor lipsite de capacitate de exercițiu, consimțământul va fi dat de părinți sau de celelalte persoane care au calitatea de ocrotitor legal al acestora, după caz, conform modelului prevăzut în anexa nr. 13.
Capitolul IV - Finanțarea activității de transplant
Art. 153 - Costul investigatiilor, spitalizarii, interventiilor chirurgicale, medicamentelor, materialelor sanitare, al ingrijirilor postoperatorii, precum și cheltuielile legate de coordonarea de transplant se pot deconta după cum urmează:
a) din bugetul Fondului național unic de asigurări sociale de sănătate, pentru pacientii incluși în Programul național de transplant;
b) de la bugetul de stat, pentru pacientii incluși în Programul național de transplant;
c) prin contribuția personală a pacientului sau, pentru el, a unui sistem de asigurări voluntare de sănătate;
d) donații și sponsorizări de la persoane fizice sau juridice, organizații neguvernamentale ori alte organisme interesate.
Capitolul V - Sancțiuni
Art. 154 - Organizarea și efectuarea prelevarii de organe, tesuturi și/sau celule de origine umană, în scopul transplantului, în alte condiții decât cele prevăzute de prezentul titlu, constituie infracțiune și se pedepsește conform legii penale.
Art. 155 - Prelevarea sau transplanul de organe și/sau tesuturi și/sau celule de origine umană fără consimțământ dat în condițiile prezentului titlu constituie infracțiune și se pedepsește cu închisoare de la 5 la 7 ani.
Art. 156 - Fapta persoanei care a dispus sau a efectuat prelevarea atunci când prin aceasta se compromite o autopsie medico-legală, solicitată în condițiile legii, constituie infracțiune și se pedepsește cu închisoare de la 1 la 3 ani.
Art. 157 - (1) Constituie infracțiune și se pedepsește cu închisoare de la 3 la 5 ani fapta persoanei de a dona organe și/sau tesuturi și/sau celule de origine umană, în scopul obținerii de foloase materiale sau de alta natura, pentru sine sau pentru altul.
(2) Determinarea cu rea-credința sau constrângerea unei persoane sa doneze organe și/sau tesuturi și/sau celule de origine umană constituie infracțiune și se pedepsește cu închisoare de la 3 la 10 ani.
(3) Publicitatea în folosul unei persoane, în scopul obținerii de organe și/sau tesuturi și/sau celule de origine umană, precum și publicarea sau mediatizarea unor anunțuri privind donarea de organe și/sau tesuturi și/sau celule umane în scopul obținerii unor avantaje materiale sau de alta natura pentru sine, familie ori terțe persoane fizice sau juridice constituie infracțiune și se pedepsește cu închisoare de la 2 la 7 ani.
Art. 158 - (1) Organizarea și/sau efectuarea prelevarii de organe și/sau tesuturi și/sau celule de origine umană pentru transplant, în scopul obținerii unui profit material pentru donator sau organizator, constituie infracțiunea de trafic de organe și/sau tesuturi și/sau celule de origine umană și se pedepsește cu închisoare de la 3 la 10 ani.
(2) Cu aceeași pedeapsa se sancționează și cumpărarea de organe, tesuturi și/sau celule de origine umană, în scopul revânzării, în vederea obținerii unui profit.
(3) Tentativa se pedepsește.
Art. 159 - Introducerea sau scoaterea din țara de organe, tesuturi, celule de origine umană fără autorizația specială emisă de Agenția Naționala de Transplant constituie infracțiune și se pedepsește cu închisoare de la 3 la 10 ani.
Capitolul VI - Dispoziții tranzitorii și finale
Art. 160 - (1) Prelevarea și transplantul de organe, tesuturi și celule de origine umană se efectuează de către medici de specialitate, în unități sanitare publice sau private autorizate de Ministerul Sănătății Publice și acreditate, la propunerea Agenției Naționale de Transplant.
(2) Condițiile de acreditare a unităților sanitare prevăzute la alin. (1) sunt stabilite de Agenția Naționala de Transplant, iar acreditarea se face prin ordin al ministrului sănătății publice. Criteriile de acreditare vor fi stabilite prin normele metodologice de aplicare a prezentului titlu, în conformitate cu legislația europeană în domeniu.
(3) Agenția Naționala de Transplant poate suspenda sau revoca acreditarea în cazul în care inspecțiile efectuate împreună cu autoritatea naționala competența în domeniul securității sanitare a produselor de origine umană pentru utilizare terapeutică constata ca unitatea sanitară respectiva nu respecta prevederile legale în vigoare. Inspecțiile vor fi efectuate periodic, iar intervalul dintre doua inspecții nu trebuie să depășească 2 ani.
(4) Unitățile sanitare acreditate vor stabili un sistem de identificare a fiecărui act de donare, prin intermediul unui cod unic, precum și fiecărui produs asociat cu el. Pentru tesuturi și celule este necesară etichetarea codificata care să permită stabilirea unei legături de la donator la primitor și invers. Informațiile vor fi păstrate cel puțin 30 de ani.
(5) Unitățile sanitare acreditate pentru activitatea de procesare și/sau utilizare de tesuturi și/sau celule vor păstra o înregistrare a activității lor, incluzând tipurile și cantitățile de tesuturi și/sau celule procurate, testate, conservate, depozitate, distribuite sau casate, precum și originea și destinația acestor tesuturi și/sau celule pentru utilizare umană. Ele vor trimite anual un raport de activitate Agenției Naționale de Transplant.
Art. 161 - Unitățile sanitare acreditate pentru activitatea de transplant tisular și/sau celular vor trebui sa desemneze o persoană responsabilă pentru asigurarea calității tesuturilor și/sau celulelor procesate și/sau utilizate în conformitate cu legislația europeană și cea română în domeniu. Standardul de instruire profesională a acestei persoane va fi stabilit prin norme.
Art. 162 - Normele metodologice de aplicare a prezentului titlu vor fi elaborate în termen de 90 de zile de la publicarea legii și vor fi aprobate prin ordin al ministrului sănătății publice.
Art. 163 - Anexele nr. 1-13 fac parte integrantă din prezenta lege.
Art. 164 - La data intrării în vigoare a prezentului titlu, Legea nr. 2/1998 privind prelevarea și transplantul de tesuturi și organe umane, publicată în Monitorul Oficial al României, Partea I, nr. 8 din 13 ianuarie 1998, cu modificările ulterioare, și art. 17 alin. (3), art. 21, 23 și 25 din Legea nr. 104/2003 privind manipularea cadavrelor umane și prelevarea organelor și tesuturilor de la cadavre în vederea transplantului, publicată în Monitorul Oficial al României, Partea I, nr. 222 din 3 aprilie 2003, cu modificările și completările ulterioare, se abroga.
Prevederile prezentului titlu transpun Directiva 23/2004/CEa Parlamentului European și a Consiliului din 31 martie 2004 asupra stabilirii standardelor de calitate și siguranța asupra donarii, procurării, testarii, procesarii, conservării, depozitarii și distribuirii tesuturilor și celulelor umane.
Titlul VII - Spitalele
Capitolul I - Dispoziții generale
Art. 165 - (1) Spitalul este unitatea sanitară cu paturi, de utilitate publică, cu personalitate juridică, ce furnizează servicii medicale.
(2) Spitalul poate fi public, public cu secții private sau privat. Spitalele de urgenta se înființează și funcționează numai ca spitale publice.
(3) Secțiile private ale spitalelor publice sau spitalele private pot furniza servicii medicale cu plata.
(4) Serviciile medicale acordate de spital pot fi preventive, curative, de recuperare și/sau paleative.
(5) Spitalele participa la asigurarea stării de sănătate a populației.
(6) Competentele pe tipuri de spitale se stabilesc în conformitate cu criteriile Comisiei Naționale de Acreditare a Spitalelor și se aproba prin ordin al ministrului sănătății publice, iar pentru spitalele din subordinea ministerelor și instituțiilor cu rețea sanitară proprie și cu avizul ministrului de resort sau al conducătorului instituției.
Art. 166 - (1) Activitățile organizatorice și functionale cu caracter medico-sanitar din spitale sunt reglementate și supuse controlului Ministerului Sănătății Publice, iar în spitalele din subordinea ministerelor și instituțiilor cu rețea sanitară proprie, controlul este efectuat de structurile specializate ale acestora.
(2) Spitalul poate furniza servicii medicale numai dacă funcționează în condițiile autorizației de funcționare, în caz contrar, activitatea spitalelor se suspenda, potrivit normelor aprobate prin ordin al ministrului sănătății publice.
Art. 167 - (1) În spital se pot desfășura și activități de învățământ medico-farmaceutic, postliceal, universitar și postuniversitar, precum și activități de cercetare științifică medicală. Aceste activități se desfășoară sub îndrumarea personalului didactic care este integrat în spital. Activitățile de învățământ și cercetare vor fi astfel organizate încât sa consolideze calitatea actului medical, cu respectarea drepturilor pacientilor, a eticii și deontologiei medicale.
(2) Colaborarea dintre spitale și instituțiile de învățământ superior medical, respectiv unitățile de învățământ medical, se desfășoară pe bază de contract, încheiat conform metodologiei aprobate prin ordin comun al ministrului sănătății publice și al ministrului educației și cercetării.
(3) Cercetarea științifică medicală se efectuează pe bază de contract de cercetare, încheiat între spital și finantatorul cercetării.
(4) Spitalele au obligația sa desfășoare activitatea de educație medicală și cercetare (EMC) pentru medici, asistenți medicali și alt personal. Costurile acestor activități sunt suportate de personalul beneficiar. Spitalul clinic poate suporta astfel de costuri, în condițiile alocarilor bugetare.
Art. 168 - (1) Spitalul asigura condiții de investigații medicale, tratament, cazare, igiena, alimentație și de prevenire a infectiilor nozocomiale, conform normelor aprobate prin ordin al ministrului sănătății publice.
(2) Spitalul răspunde, în condițiile legii, pentru calitatea actului medical, pentru respectarea condițiilor de cazare, igiena, alimentație și de prevenire a infectiilor nozocomiale, precum și pentru acoperirea prejudiciilor cauzate pacientilor.
Art. 169 - (1) Ministerul Sănătății Publice reglementează și aplica măsuri de creștere a eficientei și calității serviciilor medicale și de asigurare a accesului echitabil al populației la serviciile medicale.
(2) Pentru asigurarea dreptului la ocrotirea sănătății, Ministerul Sănătății Publice propune, o dată la 3 ani, Planul național de paturi, care se aproba prin hotărâre a Guvernului.
Art. 170 - (1) Orice spital are obligația de a acorda primul ajutor și asistența medicală de urgenta oricărei persoane care se prezintă la spital, dacă starea sănătății persoanei este critica. După stabilizarea funcțiilor vitale, spitalul va asigura, după caz, transportul obligatoriu medicalizat la o alta unitate medico-sanitară de profil.
(2) Spitalul va fi în permanenta pregătit pentru asigurarea asistenței medicale în caz de război, dezastre, atacuri teroriste, conflicte sociale și alte situații de criza și este obligat sa participe cu toate resursele la înlăturarea efectelor acestora.
(3) Cheltuielile efectuate de unitățile spitalicești, în cazurile menționate la alin. (2), se rambursează de la bugetul de stat, prin bugetele ministerelor sau instituțiilor în rețeaua cărora funcționează, prin hotărâre a Guvernului, în termen de maximum 30 de zile de la data încetării cauzei care le-a generat.
Capitolul II - Organizarea și funcționarea spitalelor
Art. 171 - (1) Spitalele se organizează și funcționează, pe criteriul teritorial, în spitale regionale, spitale județene și spitale locale (municipale, orășenești sau comunale).
(2) Spitalele se organizează și funcționează, în funcție de specificul patologiei, în spitale generale, spitale de urgenta, spitale de specialitate și spitale pentru bolnavi cu afecțiuni cronice.
(3) Spitalele se organizează și funcționează, în funcție de regimul proprietății, în:
a) spitale publice, organizate ca instituții publice;
b) spitale private, organizate ca persoane juridice de drept privat;
c) spitale publice în care funcționează și secții private.
(4) Din punct de vedere al învățământului și al cercetării științifice medicale, spitalele pot fi:
a) spitale clinice cu secții universitare;
b) institute.
Art. 172 - (1) În înțelesul prezentului titlu, termenii și notiunile folosite au următoarele semnificatii:
a) spitalul regional – spitalul clinic județean care deține competentele și resursele umane și materiale suplimentare necesare, în vederea asigurării ingrijirilor medicale complete pentru cazurile medicale complexe, mai ales în cazul urgentelor și al pacientilor aflați în stare critica, pentru cazurile ce nu pot fi rezolvate la nivel local, în spitalele municipale și orășenești, la nivelul județului respectiv, precum și pentru toate cazurile din județele arondate, ce nu pot fi rezolvate complet la nivelul spitalelor județene, din cauza lipsei de resurse materiale și/sau umane sau din cauza complexității cazului, în conformitate cu protocoalele în vigoare;
b) spitalul județean – spitalul general organizat în reședința de județ, cu o structura complexa de specialități medico-chirurgicale, cu unitate de primire urgente, care asigura urgentele medico-chirurgicale și acorda asistența medicală de specialitate, inclusiv pentru cazurile grave din județ care nu pot fi rezolvate la nivelul spitalelor locale;
c) spitalul local – spitalul general care acorda asistența medicală de specialitate în teritoriul unde funcționează, respectiv municipiu, oraș, comuna;
d) spitalul de urgenta – spitalul care dispune de o structura complexa de specialități, dotare cu aparatura medicală corespunzătoare, personal specializat, având amplasament și accesibilitate pentru teritorii extinse. În structura spitalului de urgenta funcționează obligatoriu o structura de urgenta (U.P.U., C.P.U.) care, în funcție de necesitați, poate avea și un serviciu mobil de urgenta reanimare și transport medicalizat;
e) spitalul general – spitalul care are organizate în structura, de regula, doua dintre specialitatile de baza, respectiv medicina interna, pediatrie, obstetrica-ginecologie, chirurgie generală;
f) spitalul de specialitate – spitalul care asigura asistența medicală într-o specialitate în conexiune cu alte specialități complementare;
g) spitalul pentru bolnavi cu afecțiuni cronice – spitalul în care durata de spitalizare este prelungită datorită specificului patologiei. Bolnavii cu afecțiuni cronice și probleme sociale vor fi preluati de unitățile de asistența medico-sociale, precum și de așezămintele de asistența socială prevăzute de lege, după evaluarea medicală;
h) spitalul clinic – spitalul care are în componenta secții clinice universitare care asigura asistența medicală, desfășoară activitate de învățământ, cercetare științifică-medicală și de educație continua, având relații contractuale cu o instituție de învățământ medical superior acreditata. Institutele, centrele medicale și spitalele de specialitate, care au în componenta o secție clinica universitară sunt spitale clinice. Pentru activitatea medicală, diagnostica și terapeutică, personalul didactic este în subordinea administrației spitalului, în conformitate cu prevederile contractului de muncă;
i) secțiile clinice universitare – secțiile de spital în care se desfășoară activități de asistența medicală, învățământ medical, cercetare științifică-medicală și de educație medicală continua (EMC). În aceste secții este încadrat cel puțin un cadru didactic universitar, prin integrare clinica. Pentru activitatea medicală, diagnostica și terapeutică, personalul didactic este în subordinea administrației spitalului, în conformitate cu prevederile contractului de muncă;
j) institutele și centrele medicale clinice – unități de asistența medicală de specialitate în care se desfășoară și activitate de învățământ și cercetare științifică-medicală, de îndrumare și coordonare metodologică pe domeniile lor de activitate, precum și de educație medicală continua; pentru asistența medicală de specialitate se pot organiza centre medicale în care nu se desfășoară activitate de învățământ medical și cercetare științifică;
k) unitățile de asistența medico-sociale – instituții publice specializate, în subordinea autorităților administrației publice locale, care acorda servicii de îngrijire, servicii medicale, precum și servicii sociale persoanelor cu nevoi medico-sociale;
l) sanatoriul – unitatea sanitară cu paturi care asigura asistența medicală utilizând factori curativi naturali asociați cu celelalte procedee, tehnici și mijloace terapeutice;
m) preventoriul – unitatea sanitară cu paturi care asigura prevenirea și combaterea tuberculozei la copii și tineri, precum și la bolnavii de tuberculoza stabilizati clinic și necontagiosi;
n) centrele de sănătate – unități sanitare cu paturi care asigura asistența medicală de specialitate pentru populația din mai multe localități apropiate, în cel puțin două specialități.
(2) În sensul prezentului titlu, în categoria spitalelor se includ și următoarele unități sanitare cu paturi: institute și centre medicale, sanatorii, preventorii, centre de sănătate și unități de asistența medico-socială.
Art. 173 - (1) Structura organizatorică a unui spital poate cuprinde, după caz: secții, laboratoare, servicii de diagnostic și tratament, compartimente, servicii sau birouri tehnice, economice și administrative, serviciu de asistența prespitaliceasca și transport urgente, structuri de primiri urgente și alte structuri aprobate prin ordin al ministrului sănătății publice.
(2) Spitalele pot avea în componenta lor structuri care acorda servicii ambulatorii de specialitate, servicii de spitalizare de zi, îngrijiri la domiciliu, servicii paraclinice ambulatorii. Furnizarea acestor servicii se negociaza și se contractează în mod distinct cu casele de asigurări de sănătate sau cu terți în cadrul asistenței medicale spitalicești sau din fondurile alocate pentru serviciile respective.
Art. 174 - (1) Spitalele publice se înființează și, respectiv, se desființează prin hotărâre a Guvernului, initiata de Ministerul Sănătății Publice, cu avizul consiliului local, respectiv județean, după caz.
(2) Spitalele din rețeaua sanitară proprie a ministerelor și instituțiilor, altele decât cele ale Ministerului Sănătății Publice, se înființează și, respectiv, se desființează prin hotărâre a Guvernului, initiata de ministerul sau instituția publică respectiva, cu avizul Ministerului Sănătății Publice.
(3) Structura organizatorică, reorganizarea, restructurarea, schimbarea sediului și a denumirilor pentru spitalele publice se aproba prin ordin al ministrului sănătății publice, la propunerea conducerii spitalelor, prin autoritățile de sănătate publică, cu avizul consiliului județean sau al consiliului local, după caz. Structura organizatorică a unităților sanitare din subordinea ministerelor și instituțiilor cu rețea sanitară proprie se stabilește prin ordin al ministrului, respectiv prin decizie a conducătorului instituției, cu avizul Ministerului Sănătății Publice.
(4) Spitalele private se înființează sau se desființează cu avizul Ministerului Sănătății Publice, în condițiile legii. Structura organizatorică, reorganizarea, restructurarea și schimbarea sediului și a denumirilor pentru spitalele private se fac cu avizul Ministerului Sănătății Publice, în condițiile legii.
(5) Secția privată se poate organiza în structura oricărui spital public. Condițiile de înființare, organizare și funcționare se stabilesc prin ordin al ministrului sănătății publice.
(6) Se asimilează spitalelor private și unitățile sanitare private înființate în cadrul unor organizații nonguvernamentale sau al unor societăți comerciale, care acorda servicii medicale spitalicești.
Art. 175 - (1) Autorizația sanitară de funcționare se emite în condițiile stabilite prin normele aprobate prin ordin al ministrului sănătății publice și da dreptul spitalului sa funcționeze. După obținerea autorizației sanitare de funcționare, spitalul intra, la cerere, în procedura de acreditare. Procedura de acreditare nu se poate extinde pe o perioadă mai mare de 5 ani. Neobtinerea acreditării în termen de 5 ani de la emiterea autorizației de funcționare conduce la desființarea spitalului în cauza.
(2) Acreditarea garantează faptul ca spitalele funcționează la standardele stabilite potrivit prezentului titlu, privind acordarea serviciilor medicale și conexe actului medical, certificând calitatea serviciilor de sănătate în conformitate cu clasificarea spitalelor, pe categorii de acreditare.
(3) Acreditarea se acordă de Comisia Naționala de Acreditare a Spitalelor, instituție cu personalitate juridică, ce funcționează în coordonarea primului-ministru, finanțată din venituri proprii și subvenții acordate de la bugetul de stat.
(4) Componenta, atribuțiile, modul de organizare și funcționare ale Comisiei Naționale de Acreditare a Spitalelor se aproba prin hotărâre a Guvernului, la propunerea Ministerului Sănătății Publice.
(5) Din Comisia Naționala de Acreditare a Spitalelor vor face parte reprezentanți ai Presedintiei, Guvernului, Academiei Române, Colegiului Medicilor din România, Ordinului Asistentilor Medicali și Moașelor din România. Membrii Comisiei Naționale de Acreditare a Spitalelor, precum și rudele sau afinii acestora până la gradul al IV-lea inclusiv sunt incompatibili cu calitatea de membru în organele de conducere ale spitalelor și nu pot deține cabinete sau clinici private.
(6) Pentru obținerea acreditării se percepe o taxa de acreditare, al carei nivel se aproba prin ordin al Comisiei Naționale de Acreditare a Spitalelor, la propunerea ministrului sănătății publice.
(7) Veniturile încasate din activitatea de acreditare sunt venituri proprii ale Comisiei Naționale de Acreditare a Spitalelor, care urmează a fi utilizate pentru organizarea și funcționarea Comisiei Naționale de Acreditare a Spitalelor, în condițiile legii.
Art. 176 - (1) Procedurile, standardele și metodologia de acreditare se elaborează de către Comisia Naționala de Acreditare a Spitalelor și se aproba prin ordin al ministrului sănătății publice.
(2) Lista cu unitățile spitalicești acreditate și categoria acreditării se publică în Monitorul Oficial al României, Partea I.
Art. 177 - (1) Acreditarea este valabilă 5 ani. Înainte de expirarea termenului, spitalul solicita evaluarea în vederea reacreditarii.
(2) Reevaluarea unui spital se poate face și la solicitarea Ministerului Sănătății Publice, a casei Naționale de Asigurări de Sănătate sau, după caz, a ministerelor și instituțiilor cu rețea sanitară proprie. Taxele legate de reevaluare sunt suportate de solicitant.
(3) Dacă în urma evaluării se constată că nu mai sunt îndeplinite standardele de acreditare, Comisia Naționala de Acreditare a Spitalelor acorda un termen pentru conformare sau retrage acreditarea pentru categoria solicitată.
Capitolul III - Conducerea spitalelor
Art. 178 - (1) Spitalul public este condus de un manager, persoana fizica sau juridică.
(2) Managerul persoana fizica sau reprezentantul desemnat de managerul persoana juridică trebuie să fie absolvent al unei instituții de învățământ superior și al unor cursuri de perfecționare în management sau management sanitar, agreate de Ministerul Sănătății Publice și stabilite prin ordin al ministrului sănătății publice.
(3) Managerul, persoana fizica sau juridică, încheie contract de management cu Ministerul Sănătății Publice sau cu ministerele, respectiv instituțiile cu rețea sanitară proprie, după caz, pe o perioadă de 3 ani. Contractul de management poate fi prelungit sau poate inceta înainte de termen, în urma evaluării anuale efectuate pe baza criteriilor de performanță stabilite prin ordin al ministrului sănătății publice.
(4) Modelul contractului de management, în cuprinsul căruia sunt prevăzuți și indicatorii de performanță a activității, se aproba prin ordin al ministrului sănătății publice, cu consultarea ministerelor și instituțiilor cu rețea sanitară proprie. Nivelul indicatorilor de performanță a activității se stabilește anual de Ministerul Sănătății Publice, respectiv de ministrul de resort, în funcție de subordonarea spitalului. Contractul de management va avea la baza un buget global negociat, a cărui execuție va fi evaluată anual.
Art. 179 - (1) Ministerul Sănătății Publice, respectiv Ministerul Transporturilor, Construcțiilor și Turismului organizează concurs sau licitație publică, după caz, pentru selecționarea managerului, respectiv a unei persoane juridice care să asigure managementul unității sanitare, care va fi numit prin ordin al ministrului sănătății publice sau, după caz, al ministrului transporturilor, construcțiilor și turismului.
(2) Managerul persoana fizica va fi selectat prin concurs de o comisie numita de ministrul sănătății publice sau, după caz, de ministrul transporturilor, construcțiilor și turismului, potrivit normelor aprobate prin ordin al ministrului sănătății publice sau, după caz, al ministrului transporturilor, construcțiilor și turismului, avizate de Ministerul Sănătății Publice.
(3) Pentru spitalele din sistemul de apărare, ordine publică, siguranța naționala și autoritate judecătorească, funcția de comandant/director general sau, după caz, de manager se ocupa de o persoană numita de conducătorul ministerului sau al instituției care are în structura spitalul, conform reglementărilor proprii adaptate la specificul prevederilor prezentului titlu.
(4) Selecția managerului persoana juridică se efectuează prin licitație publică, conform dispozițiilor legii achizițiilor publice.
Art. 180 - (1) Funcția de manager persoana fizica este incompatibilă cu:
a) exercitarea oricăror alte funcții salarizate, nesalarizate sau/și indemnizate inclusiv în cadrul unei autorități executive, legislative ori judecătorești;
b) exercitarea oricărei activități sau oricărei alte funcții de manager, inclusiv cele neremunerate;
c) exercitarea unei activități sau a unei funcții de membru în structurile de conducere ale unei alte unități spitalicești;
d) exercitarea oricărei funcții în cadrul organizațiilor sindicale sau patronale de profil.
(2) Constituie conflict de interese deținerea de către manager persoana fizica, manager persoana juridică ori reprezentant al persoanei juridice de părți sociale, acțiuni sau interese la societăți comerciale ori organizații nonguvernamentale care stabilesc relații comerciale cu spitalul la care persoana în cauza exercita sau intenționează sa exercite funcția de manager. Dispoziția de mai sus se aplică și în cazurile în care astfel de părți sociale, acțiuni sau interese sunt deținute de către rudele ori afinii până la gradul al IV-lea inclusiv ale persoanei în cauza.
(3) Incompatibilitățile și conflictul de interese sunt aplicabile atât persoanei fizice, cat și reprezentantului desemnat al persoanei juridice care exercită sau intenționează sa exercite funcția de manager de spital.
(4) Dacă managerul selectat prin concurs ori reprezentantul desemnat al persoanei juridice selectate în urma licitației se afla în stare de incompatibilitate sau în conflict de interese, acesta este obligat sa înlăture motivele de incompatibilitate ori de conflict de interese în termen de 30 de zile de la apariția acestora. În caz contrar, contractul de management este reziliat de plin drept. Ministerul Sănătății Publice sau, după caz, ministerul ori instituția publică semnatara a contractului de management va putea cere persoanelor în cauza despăgubiri, conform clauzelor contractului de management.
(5) Persoanele care îndeplinesc funcția de manager la spitalele și celelalte unități sanitare care au sub 400 de paturi, cu excepția spitalelor din subordinea Ministerului Transporturilor, Construcțiilor și Turismului, pot desfășura activitate medicală în instituția respectiva.
Art. 181 - Atribuțiile managerului sunt stabilite prin contractul de management.
Art. 182 - În domeniul politicii de personal și al structurii organizatorice managerul are, în principal, următoarele atribuții:
a) stabilește și aproba numărul de personal, pe categorii și locuri de muncă, în funcție de normativul de personal în vigoare;
b) aproba organizarea concursurilor pentru posturile vacante, numește și eliberează din funcție personalul spitalului;
c) aproba programul de lucru, pe locuri de muncă și categorii de personal;
d) propune structura organizatorică, reorganizarea, schimbarea sediului și a denumirii unității, în vederea aprobării de către Ministerul Sănătății Publice sau, după caz, de ministerele care au spitale în subordine ori în administrare sau rețea sanitară proprie;
e) numește, conform art. 183, membrii comitetului director.
Art. 183 - (1) În cadrul spitalelor publice se organizează și funcționează un comitet director, format din managerul spitalului, directorul medical, directorul de cercetare-dezvoltare pentru spitalele clinice, directorul financiar-contabil și, după caz, directorul de îngrijiri, precum și alți directori, potrivit normelor interne de organizare a spitalelor. Ocuparea funcțiilor specifice comitetului director se face prin concurs organizat de managerul spitalului.
(2) Pentru ministerele și instituțiile cu rețea sanitară proprie, structura comitetului director se stabilește de către acestea, în conformitate cu regulamentele interne proprii.
(3) Atribuțiile comitetului director sunt stabilite prin ordin al ministrului sănătății publice.
(4) În spitalele clinice, directorul medical poate fi un cadru didactic universitar medical.
Art. 184 - (1) Secțiile, laboratoarele și serviciile medicale ale spitalului public sunt conduse de un șef de secție, șef de laborator sau, după caz, șef de serviciu. Aceste funcții se ocupa prin concurs sau examen, după caz, în condițiile legii, organizat conform normelor aprobate prin ordin al ministrului sănătății publice.
(2) În spitalele publice funcțiile de șef de secție, șef de laborator, farmacist-șef, asistent medical șef sunt funcții de conducere și vor putea fi ocupate numai de medici, farmacisti, biologi, chimisti și biochimisti sau, după caz, asistenți medicali, cu o vechime de cel puțin 5 ani în specialitatea respectiva.
(3) Șefii de secție au ca atribuții îndrumarea și realizarea activității de acordare a ingrijirilor medicale în cadrul secției respective și răspund de calitatea actului medical, precum și atribuțiile asumate prin contractul de administrare.
(4) La numirea în funcție, șefii de secție, de laborator sau de serviciu vor încheia cu spitalul public, reprezentat de managerul acestuia, un contract de administrare cu o durată de 3 ani, în cuprinsul căruia sunt prevăzuți indicatori specifici de performanță. Contractul de administrare poate fi prelungit și poate inceta înainte de termen, în principal, în cazul neîndeplinirii indicatorilor specifici de performanță. Pe perioada existenței contractului de administrare, eventualul contract de muncă încheiat cu o alta instituție publică din domeniul sanitar se suspenda. Conținutul contractului și metodologia de încheiere a acestuia se vor stabili prin ordin al ministrului sănătății publice. Dacă șeful de secție selectat prin concurs se afla în stare de incompatibilitate sau conflict de interese, acesta este obligat să le înlăture în termen de maximum 30 de zile sub sancțiunea rezilierii unilaterale a contractului de administrare.
(5) Calitatea de șef de secție este compatibila cu funcția de cadru didactic universitar.
(6) În secțiile clinice universitare funcția de șef de secție se ocupa de cadrul didactic cu gradul cel mai mare de predare, la recomandarea senatului sau a consiliului profesoral al instituției de învățământ medical superior în cauza.
(7) În cazul în care contractul de administrare, prevăzut la alin. (4), nu se semnează în termen de 7 zile de la emiterea recomandarii, se va constitui o comisie de mediere numita prin ordin al ministrului sănătății publice sau, după caz, al ministrului transporturilor, construcțiilor și turismului. În cazul în care conflictul nu se soluționează într-un nou termen de 7 zile, postul va fi scos la concurs, în condițiile legii.
(8) Pentru secțiile clinice, altele decât cele prevăzute la alin. (6), precum și pentru secțiile neclinice condițiile de participare la concurs vor fi stabilite prin ordin al ministrului sănătății publice, iar în cazul spitalelor aparținând ministerelor sau instituțiilor cu rețea sanitară proprie, condițiile de participare la concurs vor fi stabilite prin ordin al ministrului, respectiv prin decizie a conducătorului instituției, cu avizul Ministerului Sănătății Publice. În cazul în care la concurs nu se prezintă nici un candidat în termenul legal, managerul spitalului public va delega un alt medic în funcția de șef de secție, pe o perioadă de până la 6 luni, după care se vor repeta procedurile prevăzute la alin. (1).
(9) Șefii de secție vor face publice, prin declarație pe propria răspundere, afișată pe site-ul spitalului și al autorității de sănătate publică teritorială sau pe site-ul Ministerului Sănătății Publice ori, după caz, al Ministerului Transporturilor, Construcțiilor și Turismului pentru unitățile sanitare subordonate acestuia, legăturile de rudenie până la gradul al IV-lea inclusiv cu personalul angajat în secția pe care o conduce.
(10) Medicii care împlinesc vârsta de pensionare după dobândirea funcției de manager de spital, director medical sau șef de secție vor fi pensionați conform legii. Medicii în vârsta de cel puțin 65 de ani nu pot participa la concurs și nu pot fi numiți în nici una dintre funcțiile de manager de spital, director medical sau șef de secție.
(11) În spitalele clinice, profesorii universitari pot ocupa funcții de șef de secție până la vârsta de 70 de ani, cu avizul Colegiului Medicilor din România și cu aprobarea ministrului sănătății publice.
(12) Dispozițiile art. 180 alin. (1) lit. b)-d) referitoare la incompatibilități, conflicte de interese și sancțiunea rezilierii contractului de administrare se aplică și sefilor de secție, de laborator sau de serviciu din spitalele publice.
Art. 185 - (1) În cadrul spitalelor publice funcționează un consiliu etic, un consiliu medical și un consiliu științific, pentru spitalele clinice și institutele și centrele medicale clinice. Directorul medical este președintele consiliului medical. Directorul științific este președintele consiliului științific.
(2) Componenta și atribuțiile consiliului etic și ale consiliului științific se stabilesc prin ordin al ministrului sănătății publice.
(3) Consiliul medical este alcătuit din șefii de secții, de laboratoare, farmacistul-șef și asistentul șef.
(4) Principalele atribuții ale consiliului medical sunt următoarele:
a) îmbunătățirea standardelor clinice și a modelelor de practica în scopul acordării de servicii medicale de calitate în scopul creșterii gradului de satisfactie a pacientilor;
b) monitorizarea și evaluarea activității medicale desfășurate în spital în scopul creșterii performantelor profesionale și utilizării eficiente a resurselor alocate;
c) elaborarea proiectului de plan de achiziții al spitalului în limita bugetului estimat;
d) întărirea disciplinei economico-financiare.
Art. 186 - (1) În cadrul spitalului public funcționează un consiliu consultativ, care are rolul de a dezbate principalele probleme de strategie și de organizare și funcționare a spitalului și de a face recomandări managerilor spitalului în urma dezbaterilor.
(2) Membrii consiliului consultativ sunt:
a) 2 reprezentanți ai Ministerului Sănătății Publice sau ai autorității de sănătate publică, cu personalitate juridică pentru spitalele din subordinea Ministerului Sănătății Publice;
b) 2 reprezentanți ai ministerelor și instituțiilor cu rețea sanitară proprie pentru spitalele aflate în subordinea acestora;
c) 2 reprezentanți numiți de consiliul județean ori local, respectiv de Consiliul General al Municipiului București, dintre care unul specialist în finanțe publice locale, pentru spitalele aflate în administrarea consiliilor județene sau locale, după caz;
d) managerul spitalului public;
e) 2 reprezentanți ai universitatii sau facultății de medicina, pentru spitalele clinice, institutele și centrele medicale clinice;
f) 2 reprezentanți ai mediului de afaceri, nominalizați de patronatele reprezentative la nivel național pentru spitalele din rețeaua Ministerului Sănătății Publice.
(3) Reprezentanții sindicatelor legal constituite în unitate, afiliate federațiilor sindicale semnatare ale contractului colectiv de muncă la nivel de ramura sanitară, au statut de invitați permanenți la ședințele consiliului consultativ.
(4) Membrii consiliului consultativ al spitalului public se numesc prin ordin al ministrului sănătății publice după nominalizarea acestora de către instituțiile enumerate la alin. (2) lit. a)-c) și e). O persoana nu poate fi membru decât într-un singur consiliu consultativ al unui spital public.
(5) Consiliul consultativ se întrunește, în ședința ordinară, cel puțin o dată la 3 luni, precum și ori de câte ori va fi nevoie, în ședințe extraordinare. Deciziile consiliului se iau în prezenta a cel puțin două treimi din numărul membrilor săi, cu majoritatea absolută a membrilor prezenți.
(6) Pentru ministerele și instituțiile cu rețea sanitară proprie, componenta consiliului consultativ se stabilește conform reglementărilor proprii, prin ordin sau decizie, după caz.
(7) Dispozițiile art. 180 alin. (3) referitoare la conflicte de interese se aplică și membrilor consiliului consultativ.
Art. 187 - (1) Persoanele din conducerea spitalului public, respectiv managerul, membrii comitetului director, șefii de secție, de laborator sau de serviciu și membrii consiliului consultativ, au obligația de a depune o declarație de interese, precum și o declarație cu privire la incompatibilitățile prevăzute la art. 180, în termen de 15 zile de la numirea în funcție, la Ministerul Sănătății Publice sau, după caz, la ministerele și instituțiile cu rețea sanitară proprie.
(2) Declarația prevăzută la alin. (1) se actualizează ori de câte ori intervin modificări în situația persoanelor în cauza; actualizarea se face în termen de 30 de zile de la data apariției modificării, precum și a încetării funcțiilor sau activităților.
(3) Declarațiile se afișează pe site-ul spitalului.
(4) Modelul declarației de interese și cel al declarației referitoare la incompatibilități se aproba prin ordin al ministrului sănătății publice.
(5) În condițiile prevăzute la alin. (1) și (2), persoanele din conducerea spitalului au obligația de a depune și o declarație de avere, al carei model se aproba prin ordin al ministrului sănătății publice.
Capitolul IV - Finanțarea spitalelor
Art. 188 - (1) Spitalele publice sunt instituții publice finanțate integral din venituri proprii și funcționează pe principiul autonomiei financiare. Veniturile proprii ale spitalelor publice provin din sumele încasate pentru serviciile medicale, alte prestații efectuate pe bază de contract, precum și din alte surse, conform legii.
(2) Prin autonomie financiară se înțelege:
a) organizarea activității spitalului pe baza bugetului de venituri și cheltuieli propriu, aprobat de conducerea unității și cu acordul ordonatorului de credite ierarhic superior;
b) elaborarea bugetului propriu de venituri și cheltuieli, pe baza evaluării veniturilor proprii din anul bugetar și a repartizării cheltuielilor pe baza propunerilor fundamentate ale secțiilor și compartimentelor din structura spitalului.
(3) Spitalele publice au obligația de a asigură realizarea veniturilor și de a fundamenta cheltuielile în raport cu acțiunile și obiectivele din anul bugetar pe titluri, articole și alineate, conform clasificației bugetare.
(4) Prevederile alin. (2) sunt aplicabile și în cadrul ministerelor cu rețea sanitară proprie.
Art. 189 - (1) Contractul de furnizare de servicii medicale al spitalului public cu casa de asigurări sociale de sănătate reprezintă sursa principala a veniturilor în cadrul bugetului de venituri și cheltuieli și se negociaza de către manager cu conducerea casei de asigurări sociale de sănătate, în funcție de indicatorii stabiliți în contractul-cadru de furnizare de servicii medicale.
(2) În cazul refuzului uneia dintre părți de a semna contractul de furnizare de servicii medicale, se constituie o comisie de mediere formată din reprezentanți ai Ministerului Sănătății Publice, respectiv ai ministerului de resort, precum și ai Casei Naționale de Asigurări de Sănătate, care, în termen de maximum 10 zile, soluționează divergențele.
(3) Spitalele pot încheia contracte de furnizare de servicii medicale și cu casele de asigurări de sănătate private.
Art. 190 - (1) Spitalele publice primesc, în completare, sume de la bugetul de stat sau de la bugetele locale, care vor fi utilizate numai pentru destinatiile pentru care au fost alocate, după cum urmează:
a) de la bugetul de stat prin bugetul Ministerului Sănătății Publice sau al ministerelor ori instituțiilor centrale cu rețea sanitară proprie, precum și prin bugetul Ministerului Educației și Cercetării, pentru spitalele clinice cu secții universitare;
b) de la bugetul propriu al județului, pentru spitalele județene;
c) de la bugetele locale, pentru spitalele de interes județean sau local.
(2) de la bugetul de stat se asigura:
a) desfășurarea activităților cuprinse în programele naționale de sănătate;
b) dotarea cu echipamente medicale, în condițiile legii;
c) investiții legate de construirea de noi spitale, inclusiv pentru finalizarea celor aflate în execuție;
d) expertizarea, transformarea și consolidarea construcțiilor grav afectate de seisme și de alte cazuri de forta majoră;
e) modernizarea, transformarea și extinderea construcțiilor existente, precum și efectuarea de reparații capitale;
f) activități specifice unităților și instituțiilor cu rețea sanitară proprie;
g) activități didactice și de cercetare;
h) alte cheltuieli curente și de capital.
(3) Bugetele locale participa la finanțarea unor cheltuieli de întreținere, gospodărire, reparații, consolidare, extindere și modernizare a unităților sanitare publice, de interes județean sau local, în limita creditelor bugetare aprobate cu aceasta destinație în bugetele locale.
(4) Spitalele publice pot realiza venituri suplimentare din:
a) donații și sponsorizări;
b) legate;
c) asocieri investitionale în domenii medicale ori de cercetare medicală și farmaceutica;
d) închirierea unor spații medicale, echipamente sau aparatura medicală către alți furnizori de servicii medicale, în condițiile legii;
e) contracte privind furnizarea de servicii medicale încheiate cu casele de asigurări private sau agenți economici;
f) editarea și difuzarea unor publicații cu caracter medical;
g) servicii medicale, hoteliere sau de alta natura, furnizate la cererea unor terți;
h) servicii de asistența medicală la domiciliu, furnizate la cererea pacientilor;
i) contracte de cercetare și alte surse;
j) alte surse, conform legii.
Art. 191 - (1) Proiectul bugetului de venituri și cheltuieli al spitalului public se elaborează de către comitetul director pe baza propunerilor fundamentate ale conducătorilor secțiilor și compartimentelor din structura spitalului, în conformitate cu normele metodologice aprobate prin ordin al ministrului sănătății publice și cu contractele colective de muncă, și se publică pe site-ul Ministerului Sănătății Publice pentru unitățile subordonate, al autorității de sănătate publică sau pe site-urile ministerelor și instituțiilor sanitare cu rețele sanitare proprii, după caz, în termen de 15 zile calendaristice de la aprobarea lui.
(2) Pentru ministerele și instituțiile cu rețea sanitară proprie, normele metodologice prevăzute la alin. (1) se aproba, prin ordin sau decizie, de conducătorul acestora, cu avizul Ministerului Sănătății Publice.
(3) Bugetul de venituri și cheltuieli al spitalului public se aproba de ordonatorul de credite ierarhic superior, la propunerea managerului spitalului.
(4) Bugetul de venituri și cheltuieli al spitalului public se repartizează pe secțiile și compartimentele din structura spitalului, nivelul acestora fiind indicator al contractului de administrare.
(5) Execuția bugetului de venituri și cheltuieli se urmărește pe secții și compartimente, fiind un indicator al contractului încheiat între manager și șefii secțiilor și compartimentelor din structura spitalului. Abaterile față de indicatorii din contractul cu managerul se analizează și se soluționează de conducerea spitalului cu conducerile structurilor în cauza.
(6) Execuția bugetului de venituri și cheltuieli se raportează lunar, respectiv trimestrial, unităților deconcentrate cu personalitate juridică ale Ministerului Sănătății Publice și, respectiv, ministerului sau instituției cu rețea sanitară proprie, în funcție de subordonare, și se publică pe site-ul Ministerului Sănătății Publice pentru unitățile subordonate, al autorității de sănătate publică sau pe site-urile ministerelor și instituțiilor sanitare cu rețele sanitare proprii.
(7) Execuția bugetului de venituri și cheltuieli se raportează lunar și trimestrial și consiliului local și/sau județean, după caz, dacă beneficiază de finanțare din bugetele locale.
(8) Unitățile deconcentrate cu personalitate juridică ale Ministerului Sănătății Publice, respectiv direcțiile medicale ori similare ale ministerelor și instituțiilor cu rețea sanitară proprie analizează execuția bugetelor de venituri și cheltuieli lunare și trimestriale și le înaintează Ministerului Sănătății Publice, respectiv ministerului sau instituției cu rețea sanitară proprie, după caz. Dacă se constata abateri față de indicatorii din contractul de administrare, le sesizează și fac propuneri, pe care le supun spre aprobare conducerii Ministerului Sănătății Publice, respectiv ministerului sau instituției cu rețea sanitară proprie.
Art. 192 - În cazul existenței unor datorii la data încheierii contractului de management, acestea vor fi evidentiate separat, stabilindu-se posibilitățile și intervalul în care vor fi lichidate, în condițiile legii.
Art. 193 - (1) Auditul public intern se exercită de către structura deconcentrata a Ministerului Sănătății Publice pentru spitalele cu mai puțin de 400 de paturi, iar pentru spitalele cu peste 400 de paturi, de către un compartiment funcțional de audit la nivelul spitalului.
(2) Auditul public intern pentru spitalele aparținând ministerelor și instituțiilor cu rețea sanitară proprie se exercită în conformitate cu dispozițiile legale și cu reglementările specifice ale acestora.
(3) Controlul asupra activității financiare a spitalului public se face, în condițiile legii, de Curtea de Conturi, Ministerul Sănătății Publice, de ministerele și instituțiile cu rețea sanitară proprie sau de alte organe abilitate prin lege.
Art. 194 - (1) Fondul de dezvoltare al spitalului se constituie din următoarele surse:
a) cota-parte din amortizarea calculată lunar și cuprinsă în bugetul de venituri și cheltuieli al spitalului, cu păstrarea echilibrului financiar;
b) sume rezultate din valorificarea bunurilor disponibile, precum și din cele casate cu respectarea dispozițiilor legale în vigoare;
c) sponsorizări cu destinația „dezvoltare”;
d) o cota de 20% din excedentul bugetului de venituri și cheltuieli înregistrat la finele exercițiului financiar;
e) sume rezultate din închirieri, în condițiile legii.
(2) Fondul de dezvoltare se utilizează pentru dotarea spitalului.
(3) Soldul fondului de dezvoltare rămas la finele anului se reportează în anul următor, fiind utilizat potrivit destinației prevăzute la alin. (2).
Art. 195 - Decontarea contravalorii serviciilor medicale contractate se face conform contractului de furnizare de servicii medicale, pe bază de documente justificative, în funcție de realizarea acestora, cu respectarea prevederilor contractului-cadru privind condițiile acordării asistenței medicale în cadrul sistemului asigurărilor sociale de sănătate.
Art. 196 - În cazul unor activități medicale sau farmaceutice pentru care unitatea spitaliceasca nu are specialiști competenți în astfel de activități sau manopere medicale, se poate încheia un contract privind furnizarea unor astfel de servicii medicale sau farmaceutice cu un cabinet medical specializat, respectiv furnizor de servicii farmaceutice ori cu o alta unitate medicală publică sau privată acreditata. Unitățile spitalicești pot încheia contracte privind furnizarea de servicii auxiliare necesare funcționarii spitalului.
Art. 197 - (1) Salarizarea personalului de conducere din spitalele publice, precum și a celorlalte categorii de personal se stabilește potrivit legii.
(2) Salarizarea personalului din spitalele private se stabilește prin negociere între părți.
Capitolul V - Dispoziții tranzitorii și finale
Art. 198 - (1) Spitalul are obligația sa înregistreze, sa stocheze, sa prelucreze și sa transmită informațiile legate de activitatea sa, conform normelor aprobate prin ordin al ministrului sănătății publice.
(2) Raportarile se fac către Ministerul Sănătății Publice și/sau unitățile deconcentrate cu personalitate juridică ale Ministerului Sănătății Publice sau către ministerele și instituțiile cu rețea sanitară proprie, după caz, și constituie baza de date, la nivel național, pentru decizii majore de politica sanitară și pentru raportarile necesare organismelor Uniunii Europene și Organizației Mondiale a Sănătății.
(3) Documentația primara, ca sursa a acestor date, se păstrează, securizata și asigurata sub forma de document scris și electronic, constituind arhiva spitalului, conform reglementărilor legale în vigoare.
(4) Informațiile prevăzute la alin. (1), care constituie secrete de stat și de serviciu, vor fi accesate și gestionate conform standardelor naționale de protecție a informațiilor clasificate.
Art. 199 - Ministerul Sănătății Publice, ministerele și instituțiile cu rețea sanitară proprie vor lua măsuri pentru reorganizarea spitalelor publice existente, în conformitate cu prevederile prezentului titlu, în termen de maximum 180 de zile de la data intrării în vigoare a acestuia.
Art. 200 - (1) Ministerul Sănătății Publice analizează și evalueaza periodic și ori de câte ori este nevoie sau la sesizarea organelor abilitate ale statului performanțele unităților sanitare publice cu paturi, care sunt în relații contractuale cu casele de asigurări de sănătate, indiferent de subordonarea lor sau de titularul dreptului de administrare asupra lor, numind o comisie de evaluare.
(2) Pentru analiza și evaluarea spitalelor din rețelele sanitare ale ministerelor sau instituțiilor, altele decât cele ale Ministerului Sănătății Publice, comisia prevăzută la alin. (1) va fi constituită prin ordin comun al ministrului sănătății publice și ministrului sau conducătorului instituției care are în subordine spitalul.
(3) La propunerea comisiei prevăzute la alin. (1) și (2), managerul și consiliile consultative pot fi revocate prin ordin al ministrului sănătății publice sau, după caz, prin ordin ori decizie a ministrilor și conducătorilor instituțiilor cu rețele sanitare proprii, cu avizul ministrului sănătății publice.
(4) Pentru unitățile sanitare publice aparținând ministerelor și instituțiilor cu rețea sanitară proprie conducătorii acestora vor emite ordinele de revocare cu avizul ministrului sănătății publice.
(5) Președinții consiliilor consultative și comitetelor directoare interimare se numesc pe o perioadă de maximum 6 luni, prin ordin al ministrului sănătății publice sau, după caz, al conducătorilor instituțiilor și ministerelor cu rețea sanitară proprie.
Art. 201 - (1) Imobilele din domeniul public al statului sau al unor unități administrativ-teritoriale, aflate în administrarea unor spitale publice, care se reorganizează și devin disponibile, precum și aparatura medicală pot fi, în condițiile legii, închiriate sau concesionate, după caz, unor persoane fizice ori juridice, în scopul organizării și funcționarii unor spitale private sau pentru alte forme de asistența medicală ori socială, în condițiile legii.
(2) Fac excepție de la prevederile alin. (1) spațiile destinate desfășurării activității de învățământ superior medical și farmaceutic uman.
(3) Sumele obținute în condițiile legii din închirierea bunurilor constituie venituri proprii ale spitalului și se utilizează pentru cheltuieli curente și de capital, în conformitate cu bugetul de venituri și cheltuieli aprobat.
Art. 202 - Prevederile prezentului titlu se aplică și spitalelor care aparțin ministerelor și instituțiilor cu rețea sanitară proprie.
Art. 203 - Anual, ministrul sănătății publice va prezenta Guvernului situația privind:
a) numărul de spitale, pe diferite categorii;
b) numărul de paturi de spital raportat la numărul de locuitori;
c) gradul de dotare a spitalelor;
d) principalii indicatori de morbiditate și mortalitate;
e) situația acreditării spitalelor publice;
f) zonele și județele tarii în care necesarul de servicii medicale spitalicești nu este acoperit.
Art. 204 - Dacă în termen de un an de la înființarea Comisei Naționale de Acreditare a Spitalelor spitalele finanțate în condițiile art. 188 alin. (1) nu au început procesul de acreditare sau de reacreditare, vor pierde dreptul de a mai fi finanțate din aceste fonduri.
Art. 205 - Nerespectarea prevederilor prezentului titlu atrage răspunderea disciplinară, contravențională, civilă sau penală, după caz, în condițiile legii, a persoanelor vinovate.
Art. 206 - Numirea managerilor selectați prin concurs se face în termen de maximum 90 de zile de la data intrării în vigoare a prezentului titlu.
Art. 207 - La data intrării în vigoare a prezentului titlu, Legea spitalelor nr. 270/2003, publicată în Monitorul Oficial al României, Partea I, nr. 438 din 20 iunie 2003, cu modificările și completările ulterioare, precum și orice alte dispoziții contrare se abroga.
Titlul VIII - Asigurările sociale de sănătate
Capitolul I - Dispoziții generale
Art. 208 - (1) Asigurările sociale de sănătate reprezintă principalul sistem de finanțare a ocrotirii sănătății populației care asigura accesul la un pachet de servicii de baza pentru asigurați.
(2) Obiectivele sistemului de asigurări sociale de sănătate sunt:
a) protejarea asiguraților față de costurile serviciilor medicale în caz de boala sau accident;
b) asigurarea protecției asiguraților în mod universal, echitabil și nediscriminatoriu în condițiile utilizării eficiente a Fondului național unic de asigurări sociale de sănătate.
(3) Asigurările sociale de sănătate sunt obligatorii și funcționează ca un sistem unitar, iar obiectivele menționate la alin. (2) se realizează pe baza următoarelor principii:
a) alegerea libera de către asigurați a casei de asigurări;
b) solidaritate și subsidiaritate în constituirea și utilizarea fondurilor;
c) alegerea libera de către asigurați a furnizorilor de servicii medicale, de medicamente și de dispozitive medicale, în condițiile prezentei legi și ale contractului-cadru;
d) descentralizarea și autonomia în conducere și administrare;
e) participarea obligatorie la plata contribuției de asigurări sociale de sănătate pentru formarea Fondului național unic de asigurări sociale de sănătate;
f) participarea persoanelor asigurate, a statului și a angajatorilor la managementul Fondului național unic de asigurări sociale de sănătate;
g) acordarea unui pachet de servicii medicale de baza, în mod echitabil și nediscriminatoriu, oricărui asigurat;
h) transparenta activității sistemului de asigurări sociale de sănătate;
i) libera concurenta între furnizorii care încheie contracte cu casele de asigurări de sănătate.
(4) Pot funcționa și alte forme de asigurare a sănătății în diferite situații speciale. Aceste asigurări nu sunt obligatorii și pot fi oferite voluntar de organismele de asigurare autorizate conform legii.
(5) Asigurarea voluntara complementara sau suplimentară de sănătate poate acoperi riscurile individuale în situații speciale și/sau pe lângă serviciile acoperite de asigurările sociale de sănătate.
(6) Asigurarea voluntara de sănătate nu exclude obligația de a plati contribuția pentru asigurarea socială de sănătate.
(7) Ministerul Sănătății Publice, ca autoritate naționala în domeniul sănătății, exercita controlul asupra sistemului de asigurări sociale de sănătate, din punct de vedere al aplicării politicilor de sănătate aprobate de Guvernul României.
Art. 209 - (1) Fondul național unic de asigurări sociale de sănătate, denumit în continuare fondul, este un fond special care se constituie și se utilizează potrivit prezentei legi.
(2) Constituirea fondului se face din contribuția pentru asigurări sociale de sănătate, denumita în continuare contribuție, suportată de asigurați, de persoanele fizice și juridice care angajează personal salariat, din subvenții de la bugetul de stat, precum și din alte surse – donații, sponsorizări, dobânzi, exploatarea patrimoniului Casei Naționale de Asigurări de Sănătate și al caselor de asigurări de sănătate potrivit legii.
(3) Gestionarea fondului se face, în condițiile legii, prin Casa Naționala de Asigurări de Sănătate, denumita în Continuare CNAS, și, respectiv, prin casele de asigurări sociale de sănătate județene și a municipiului București, denumite în continuare case de asigurări. Gestionarea fondului se realizează și prin Casa Asigurărilor de Sănătate a Apărării, Ordinii Publice, Siguranței Naționale și Autorității Judecătorești și Casa Asigurărilor de Sănătate a Ministerului Transporturilor, Construcțiilor și Turismului până la reorganizarea acestora.
(4) CNAS propune, cu avizul Ministerului Sănătății Publice, proiecte de acte normative pentru asigurarea funcționarii sistemului de asigurări sociale de sănătate și acorda aviz conform proiectelor de acte normative care au incidența asupra Fondului național unic de asigurări sociale de sănătate.
Art. 210 - (1) În înțelesul prezentului titlu, termenii și notiunile folosite au următoarele semnificatii:
a) serviciile medicale – acele servicii nominalizate în pachetele de servicii, furnizate de către persoanele fizice și juridice, potrivit prezentului titlu;
b) furnizorii – persoane fizice sau juridice autorizate de Ministerul Sănătății Publice pentru a furniza servicii medicale, medicamente și dispozitive medicale;
c) pachetul de servicii de baza – se acordă asiguraților și cuprinde serviciile medicale, serviciile de îngrijire a sănătății, medicamentele, materialele sanitare, dispozitivele medicale și alte servicii la care au dreptul asigurații și se suporta din fond, în condițiile contractului-cadru;
d) pachetul de servicii ce se acordă persoanelor care se asigura facultativ – cuprinde serviciile medicale, serviciile de îngrijire a sănătății, medicamentele, materialele sanitare, dispozitivele medicale și alte servicii la care are dreptul această categorie de asigurați și se suporta din fond, în condițiile contractului-cadru;
e) pachetul minimal de servicii – se acordă persoanelor care nu fac dovada calității de asigurat și cuprinde servicii medicale numai în cazul urgentelor medico-chirurgicale și al bolilor cu potențial edemo-epidemic, inclusiv cele prevăzute în Programul național de imunizari, monitorizarea evoluției sarcinii și a lauzei, servicii de planificare familială, stabilite prin contractul-cadru;
f) autorizarea – reprezintă un control al calificării și al respectării legislației existente în domeniu, efectuat pentru toate tipurile de furnizori, necesar pentru a obține permisiunea de a furniza servicii medicale în România;
g) evaluarea – o procedură externa de verificare a performantelor unui furnizor de servicii medicale prin care se recunoaște ca furnizorul supus acestui proces corespunde standardelor prealabil stabilite în scopul de a garanta calitatea tuturor serviciilor medicale furnizate;
h) contractarea – procesul prin care se reglementează relațiile dintre casele de asigurări de sănătate și furnizori, în vederea asigurării drepturilor pentru persoanele asigurate în cadrul sistemului de asigurări sociale de sănătate;
i) preț de referința – prețul utilizat în sistemul de asigurări sociale de sănătate pentru plata unor servicii medicale, a medicamentelor și a dispozitivelor medicale, potrivit politicii de prețuri a Ministerului Sănătății Publice;
j) dispozitivele medicale – sunt utilizate pentru corectarea vazului, auzului, pentru protezarea membrelor, respectiv proteze, orteze, dispozitive de mers, necesare în scopul recuperării unor deficiente organice sau fiziologice;
k) prețul de decontare – prețul suportat din Fondul național unic de asigurări sociale de sănătate pentru unele medicamente la care nu se stabilește preț de referința. Lista acestora și prețul de decontare se aproba prin ordin al ministrului sănătății publice;
l) coplata – diferența suportată de asigurat între tariful decontat de casa de asigurări de sănătate din Fondul național unic de asigurări sociale de sănătate și tariful maximal stabilit de Ministerul Sănătății Publice, ca autoritate naționala în politica de prețuri a serviciilor medicale, medicamentelor și dispozitivelor medicale.
(2) Definițiile care pot exista în alte legi și care sunt diferite de cele prevăzute la alin. (1) nu se aplică în cazul prezentei legi.
Capitolul II - Asigurații
Secţiunea 1 - Persoanele asigurate
Art. 211 - (1) Sunt asigurați, potrivit prezentei legi, toți cetățenii români cu domiciliul în țara, precum și cetățenii străini și apatrizii care au solicitat și obținut prelungirea dreptului de ședere temporară sau au domiciliul în România și fac dovada plății contribuției la fond, în condițiile prezentei legi. În aceasta calitate, persoana în cauza încheie un contract de asigurare cu casele de asigurări de sănătate, direct sau prin angajator, al cărui model se stabilește prin ordin al președintelui CNAS cu avizul consiliului de administrație.
(2) Calitatea de asigurat și drepturile de asigurare încetează odată cu pierderea dreptului de domiciliu sau de ședere în România.
(3) Documentele justificative privind dobândirea calității de asigurat se stabilesc prin ordin al președintelui CNAS.
Art. 212 - (1) Calitatea de asigurat se dovedește cu un document justificativ – adeverinta sau carnet de asigurat – eliberat prin grija casei de asigurări la care este înscris asiguratul. După implementarea dispozițiilor titlului IX din prezenta lege, aceste documente justificative vor fi înlocuite cu cardul electronic de asigurat, care se suporta din fond.
(2) Metodologia și modalitățile de gestionare și de distribuire ale cardului de asigurat se stabilesc de către CNAS.
(3) Emiterea cardului electronic de asigurat se face numai prin sistemul informatic unic integrat al sistemului de asigurări sociale de sănătate.
Art. 213 - (1) Următoarele categorii de persoane beneficiază de asigurare, fără plata contribuției:
a) toți copiii până la vârsta de 18 ani, ținerii de la 18 ani până la vârsta de 26 de ani, dacă sunt elevi, inclusiv absolvenții de liceu, până la începerea anului universitar, dar nu mai mult de 3 luni, ucenici sau studenți și dacă nu realizează venituri din munca;
b) ținerii cu vârsta de până la 26 de ani, inclusiv cei care părăsesc sistemul de protecție a copilului și nu realizează venituri din munca sau nu sunt beneficiari de ajutor social acordat în temeiul Legii nr. 416/2001 privind venitul minim garantat, cu modificările și completările ulterioare; soțul, sotia și părinții fără venituri proprii, aflați în întreținerea unei persoane asigurate;
c) persoanele ale căror drepturi sunt stabilite prin Decretul-lege nr. 118/1990 privind acordarea unor drepturi persoanelor persecutate din motive politice de dictatura instaurată cu începere de la 6 martie 1945, precum și celor deportate în străinătate ori constituite în prizonieri, republicat, cu modificările și completările ulterioare, prin Ordonanța Guvernului nr. 105/1999 privind acordarea unor drepturi persoanelor persecutate de către regimurile instaurate în România cu începere de la 6 septembrie 1940 până la 6 martie 1945 din motive etnice, aprobată cu modificări și completări prin Legea nr. 189/2000, cu modificările și completările ulterioare, prin Legea nr. 44/1994 privind veteranii de război, precum și unele drepturi ale invalizilor și văduvelor de război, republicată, cu modificările și completările ulterioare, prin Legea nr. 309/2002 privind recunoașterea și acordarea unor drepturi persoanelor care au efectuat stagiul militar în cadrul Direcției Generale a Serviciului Muncii în perioada 1950-1961, cu modificările și completările ulterioare, precum și persoanele prevăzute la art. 3 alin. (1) lit. b) din Legea recunostintei față de eroii martiri și luptatorii care au contribuit la victoria Revoluției române din decembrie 1989 nr. 341/2004, cu modificările și completările ulterioare, dacă nu realizează alte venituri decât cele provenite din drepturile bănești acordate de aceste legi, precum și cele provenite din pensii;
d) persoanele cu handicap care nu realizează venituri din munca, pensie sau alte surse, cu excepția celor obținute în baza Ordonanței de urgenta a Guvernului nr. 102/1999 privind protecția specială și încadrarea în munca a persoanelor cu handicap, aprobată cu modificări și completări prin Legea nr. 519/2002, cu modificările și completările ulterioare;
e) bolnavii cu afecțiuni incluse în programele naționale de sănătate stabilite de Ministerul Sănătății Publice, până la vindecarea respectivei afecțiuni, dacă nu realizează venituri din munca, pensie sau din alte resurse;
f) femeile însărcinate și lauzele, dacă nu au nici un venit sau au venituri sub salariul de baza minim brut pe țara.
(2) Sunt asigurate persoanele aflate în una dintre următoarele situații, pe durata acesteia, cu plata contribuției din alte surse, în condițiile prezentei legi:
a) satisfac serviciul militar în termen;
b) se afla în concediu pentru incapacitate temporară de muncă, acordat în urma unui accident de muncă sau a unei boli profesionale;
c) se afla în concediu pentru creșterea copilului până la împlinirea vârstei de 2 ani și în cazul copilului cu handicap, până la împlinirea de către copil a vârstei de 3 ani;
d) executa o pedeapsă privativă de libertate sau se afla în arest preventiv;
e) persoanele care beneficiază de indemnizație de șomaj;
f) sunt returnate sau expulzate ori sunt victime ale traficului de persoane și se afla în timpul procedurilor necesare stabilirii identității;
g) persoanele care fac parte dintr-o familie care are dreptul la ajutor social, potrivit Legii nr. 416/2001, cu modificările și completările ulterioare;
h) pensionării, pentru veniturile din pensii până la limita supusă impozitului pe venit;
i) persoanele care se afla în executarea măsurilor prevăzute la art. 105, 113, 114 din Codul penal; persoanele care se afla în perioada de amânare sau întrerupere a executării pedepsei privative de libertate, dacă nu au venituri.
(3) Persoanele care au calitatea de asigurat fără plata contribuției vor primi un document justificativ special, carnet sau adeverinta de asigurat fără plata contribuției eliberat de casa de asigurări de sănătate, care atesta aceasta calitate în urma prezentării la casa de asigurări a documentelor care dovedesc ca se încadrează în prevederile alin. (1) sau alin. (2). Acest document va fi vizat periodic, după caz, în urma prezentării, de către persoana interesată, la casa de asigurări, a documentelor care dovedesc menținerea condițiilor de încadrare în categoria asiguraților fără plata contribuției, în condițiile stabilite prin ordin al președintelui CNAS.
(4) Categoriile de persoane care nu sunt prevăzute la alin. (1) și (2) au obligația să se asigure în condițiile art. 211 și sa plătească contribuția la asigurările sociale de sănătate în condițiile prezentei legi.
Art. 214 - (1) Persoanele asigurate din statele cu care România a încheiat documente internaționale cu prevederi în domeniul sănătății beneficiază de servicii medicale și alte prestații acordate pe teritoriul României, în condițiile prevăzute de respectivele documente internaționale.
(2) Asigurarea socială de sănătate este facultativă pentru următoarele categorii de persoane care nu se încadrează în prevederile alin. (1):
a) membrii misiunilor diplomatice acreditate în România;
b) cetățenii străini și apatrizii care se afla temporar în țara, fără a solicita viza de lungă ședere;
c) cetățenii români cu domiciliul în străinătate care se afla temporar în țara.
Art. 215 - (1) Obligația virarii contribuției pentru asigurările sociale de sănătate revine persoanei juridice sau fizice care angajează persoane pe bază de contract individual de muncă ori în baza unui statut special prevăzut de lege, precum și persoanelor fizice, după caz.
(2) Persoanele juridice sau fizice la care își desfășoară activitatea asigurații sunt obligate să depună lunar la casele de asigurări alese în mod liber de asigurați declarații nominale privind obligațiile ce le revin față de fond și dovada plății contribuțiilor.
(3) Prevederile alin. (1) și (2) se aplică și persoanelor care exercită profesii libere sau celor care sunt autorizate, potrivit legii, sa desfășoare activități independente.
Art. 216 - În cazul neachitarii la termen, potrivit legii, a contribuțiilor datorate fondului de către persoanele fizice, altele decât cele pentru care colectarea veniturilor se face de Agenția Naționala de Administrare Fiscală, denumita în continuare ANAF, CNAS, prin casele de asigurări sau persoane fizice ori juridice specializate, procedează la aplicarea măsurilor de executare silită pentru încasarea sumelor cuvenite bugetului fondului și a majorărilor de întârziere în condițiile Ordonanței Guvernului nr. 92/2003 privind Codul de procedură fiscală, republicată, cu modificările și completările ulterioare.
Secţiunea a 2-a - Drepturile și obligațiile asiguraților
Art. 217 - (1) Asigurații au dreptul la un pachet de servicii de baza în condițiile prezentei legi.
(2) Drepturile prevăzute la alin. (1) se stabilesc pe baza contractului-cadru care se elaborează de CNAS pe baza consultării Colegiului Medicilor din România, denumit în continuare CMR, Colegiului Medicilor Dentisti din România, denumit în continuare CMDR, Colegiului Farmacistilor din România, denumit în continuare CFR, Ordinului Asistentilor Medicali și Moașelor din România, denumit în continuare OAMMR, Ordinului Biochimistilor, Biologilor și Chimistilor, denumit în continuare OBBC, precum și a organizațiilor patronale și sindicale reprezentative din domeniul medical, până la data de 31 octombrie a anului în curs pentru anul următor. Proiectul se avizează de Ministerul Sănătății Publice și se aproba prin hotărâre a Guvernului. În cazul nefinalizarii elaborării contractului-cadru în termenul prevăzut, se prelungește prin hotărâre a Guvernului aplicabilitatea contractului-cadru din anul în curs.
(3) Contractul-cadru reglementează, în principal, condițiile acordării asistenței medicale cu privire la:
a) pachetul de servicii de baza la care au dreptul persoanele asigurate;
b) lista serviciilor medicale, a serviciilor de îngrijiri, inclusiv la domiciliu, a medicamentelor, dispozitivelor medicale și a altor servicii pentru asigurați, aferente pachetului de servicii de baza prevăzut la lit. a);
c) criteriile și standardele calității pachetului de servicii;
d) alocarea resurselor și controlul costurilor sistemului de asigurări sociale de sănătate în vederea realizării echilibrului financiar al fondului;
e) tarifele utilizate în contractarea pachetului de servicii de baza, modul de decontare și actele necesare în acest scop;
f) internarea și externarea bolnavilor;
g) măsuri de îngrijire la domiciliu și de recuperare;
h) condițiile acordării serviciilor la nivel regional și lista serviciilor care se pot contracta la nivel județean, precum și a celor care se pot contracta la nivel regional;
i) prescrierea și eliberarea medicamentelor, a materialelor sanitare, a procedurilor terapeutice, a protezelor și a ortezelor, a dispozitivelor medicale;
j) modul de informare a asiguraților;
k) coplata pentru unele servicii medicale.
(4) Ministerul Sănătății Publice împreună cu CNAS sunt abilitate sa organizeze licitații și alte proceduri de achiziții publice în vederea derulării programelor naționale de sănătate, în condițiile legii.
(5) CNAS va elabora norme metodologice de aplicare a contractului-cadru, cu consultarea CMR, CFR, CMDR, OAMMR, OBBC, precum și a organizațiilor patronale și sindicale reprezentative din domeniul medical, până la 15 decembrie a anului în curs pentru anul următor, care se aproba prin ordin al ministrului sănătății publice și al președintelui CNAS.
(6) În cazul nefinalizarii normelor metodologice, Ministerul Sănătății Publice le va elabora și le va aproba prin ordin în termen de 5 zile de la data expirării termenului prevăzut la alin. (5).
Art. 218 - (1) Asigurații beneficiază de pachetul de servicii de baza în caz de boala sau de accident, din prima zi de imbolnavire sau de la data accidentului și până la vindecare, în condițiile stabilite de prezenta lege.
(2) Asigurații au următoarele drepturi:
a) sa aleagă furnizorul de servicii medicale, precum și casa de asigurări de sănătate la care se asigura, în condițiile prezentei legi și ale contractului-cadru;
b) să fie înscriși pe lista unui medic de familie pe care îl solicita, dacă îndeplinesc toate condițiile prezentei legi, suportand cheltuielile de transport dacă opțiunea este pentru un medic din alta localitate;
c) să își schimbe medicul de familie ales numai după expirarea a cel puțin 6 luni de la data înscrierii pe listele acestuia;
d) sa beneficieze de servicii medicale, medicamente, materiale sanitare și dispozitive medicale în mod nediscriminatoriu, în condițiile legii;
e) să efectueze controale profilactice, în condițiile stabilite prin contractul-cadru;
f) sa beneficieze de servicii de asistența medicală preventivă și de promovare a sănătății, inclusiv pentru depistarea precoce a bolilor;
g) sa beneficieze de servicii medicale în ambulatorii și în spitale aflate în relație contractuală cu casele de asigurări de sănătate;
h) sa beneficieze de servicii medicale de urgenta;
i) sa beneficieze de unele servicii de asistența stomatologica;
j) sa beneficieze de tratament fizioterapeutic și de recuperare;
k) sa beneficieze de dispozitive medicale;
l) sa beneficieze de servicii de îngrijiri medicale la domiciliu;
m) sa li se garanteze confidențialitatea privind datele, în special în ceea ce privește diagnosticul și tratamentul;
n) să aibă dreptul la informație în cazul tratamentelor medicale;
o) sa beneficieze de concedii și indemnizații de asigurări sociale de sănătate în condițiile legii.
(3) Asigurații prevăzuți în Legea nr. 80/1995 privind statutul cadrelor militare, cu modificările și completările ulterioare, și în Legea nr. 360/2002 privind Statutul politistului, cu modificările și completările ulterioare, beneficiază de asistența medicală gratuita, respectiv servicii medicale, medicamente și dispozitive medicale, suportate din fond, în condițiile contractului-cadru și din bugetele ministerelor și instituțiilor respective, în condițiile plății contribuției de asigurări sociale de sănătate.
(4) Personalitatile internaționale cu statut de demnitar primesc asistența medicală de specialitate în unități sanitare nominalizate prin ordin al ministrului sănătății publice.
Art. 219 - Obligațiile asiguraților pentru a putea beneficia de drepturile prevăzute la art. 218 sunt următoarele:
a) să se înscrie pe lista unui medic de familie;
b) sa anunțe medicul de familie ori de câte ori apar modificări în starea lor de sănătate;
c) să se prezinte la controalele profilactice și periodice stabilite prin contractul-cadru;
d) sa anunțe în termen de 15 zile medicul de familie și casa de asigurări asupra modificărilor datelor de identitate sau a modificărilor referitoare la încadrarea lor într-o anumită categorie de asigurați;
e) să respecte cu strictețe tratamentul și indicațiile medicului;
f) să aibă o conduita civilizata față de personalul medico-sanitar;
g) sa achite contribuția datorată fondului și suma reprezentând coplata, în condițiile stabilite prin contractul-cadru;
h) să prezinte furnizorilor de servicii medicale documentele justificative care atesta calitatea de asigurat.
Art. 220 - Persoanele care nu fac dovada calității de asigurat beneficiază de servicii medicale numai în cazul urgentelor medico-chirurgicale și al bolilor cu potențial endemo-epidemic și cele prevăzute în Programul național de imunizari, monitorizarea evoluției sarcinii și a lauzei, servicii de planificare familială în condițiile art. 223, în cadrul unui pachet minimal de servicii medicale, stabilit prin contractul-cadru.
Art. 221 - Tarifele serviciilor hoteliere pentru persoana care însoțește copilul internat în vârsta de până la 3 ani, precum și pentru însoțitorul persoanei cu handicap grav internate se suporta de către casele de asigurări, dacă medicul considera necesară prezenta lor pentru o perioadă determinata.
Art. 222 - Fiecare asigurat are dreptul de a fi informat cel puțin o dată pe an, prin casele de asigurări, asupra serviciilor de care beneficiază, a nivelului de contribuție personală și a modalitatii de plată, precum și asupra drepturilor și obligațiilor sale.
Capitolul III - Servicii medicale suportate din Fondul național unic de asigurări sociale de sănătate
Secţiunea 1 - Servicii medicale profilactice
Art. 223 - (1) În scopul prevenirii imbolnavirilor, al depistarii precoce a bolii și al păstrării sănătății, asigurații, direct sau prin intermediul medicilor cu care casele de asigurări se afla în relații contractuale, vor fi informati permanent de către casele de asigurări asupra mijloacelor de păstrare a sănătății, de reducere și de evitare a cauzelor de imbolnavire și asupra pericolelor la care se expun în cazul consumului de droguri, alcool și tutun.
(2) Serviciile medicale profilactice suportate din fond sunt următoarele:
a) monitorizarea evoluției sarcinii și a lauzei, indiferent de statutul de asigurat al femeii;
b) urmărirea dezvoltării fizice și psihomotorii a sugarului și a copilului;
c) controalele periodice pentru depistarea bolilor care pot avea consecințe majore în morbiditate și mortalitate;
d) servicii medicale din cadrul Programului național de imunizari;
e) servicii de planificare familială, indiferent de statutul de asigurat al femeii.
(3) Detalierea serviciilor prevăzute la alin. (2) și modalitățile de acordare se stabilesc în contractul-cadru.
Art. 224 - Serviciile medicale stomatologice preventive se suporta din fond, astfel:
a) trimestrial, pentru copiii până la vârsta de 18 ani, individual sau prin formarea de grupe de profilaxie, fie la grădinița, fie la instituțiile de învățământ preuniversitar;
b) de doua ori pe an, pentru ținerii în vârsta de la 18 ani până la 26 de ani, dacă sunt elevi, ucenici sau studenți și dacă nu realizează venituri din munca.
Art. 225 - Asigurații în vârsta de peste 18 ani au dreptul la control medical pentru prevenirea bolilor cu consecințe majore în morbiditate și mortalitate, în condițiile stabilite prin contractul-cadru.
Secţiunea a 2-a - Servicii medicale curative
Art. 226 - (1) Asigurații au dreptul la servicii medicale pentru vindecarea bolii, pentru prevenirea complicatiilor ei, pentru recuperarea sau cel puțin pentru ameliorarea suferintei, după caz.
(2) Tratamentul medical se aplică de către medici sau asistenți medicali și de alt personal sanitar, la indicația și sub supravegherea medicului.
Art. 227 - (1) Serviciile medicale curative ale căror costuri sunt suportate din fond sunt:
a) serviciile medicale de urgenta;
b) serviciile medicale acordate persoanei bolnave până la diagnosticarea afectiunii: anamneza, examen clinic, examene de investigații paraclinice;
c) tratamentul medical, chirurgical și unele proceduri de recuperare;
d) prescrierea tratamentului necesar vindecarii, inclusiv indicațiile privind regimul de viața și munca, precum și cel igieno-dietetic.
(2) Asigurații beneficiază de activități de suport, în condițiile legii.
(3) Detalierea serviciilor prevăzute la alin. (1) și (2) și modalitățile de acordare se stabilesc prin contractul-cadru.
Art. 228 - (1) Asigurații au dreptul la asistența medicală primara și de specialitate ambulatorie la indicația medicului de familie, în condițiile contractului-cadru.
(2) Asigurații primesc asistența medicală de specialitate în spitale autorizate și evaluate.
(3) Serviciile spitalicești se acordă prin spitalizare și cuprind: consultații, investigații, stabilirea diagnosticului, tratament medical și/sau tratament chirurgical, îngrijire, recuperare, medicamente și materiale sanitare, dispozitive medicale, cazare și masa.
(4) Asistența medicală de recuperare se acordă pentru o perioadă de timp și după un ritm stabilite de medicul curant în unități sanitare autorizate și evaluate.
(5) Servicii și îngrijiri medicale la domiciliu se acordă de furnizori evaluați și autorizați în acest sens.
Art. 229 - Serviciile medicale stomatologice se acordă de către medicul de medicina dentara în cabinete medicale autorizate și evaluate conform legii.
Art. 230 - Asigurații beneficiază de tratamente stomatologice care se suporta din fond în condițiile stabilite prin contractul-cadru.
Secţiunea a 3-a - Medicamente, materiale sanitare, dispozitive medicale și alte mijloace terapeutice
Art. 231 - Asigurații beneficiază de medicamente cu sau fără contribuție personală, pe bază de prescripție medicală pentru medicamentele cuprinse în lista de medicamente prevăzută la art. 232. Modalitățile de prescriere și eliberare a medicamentelor se prevăd în contractul-cadru.
Art. 232 - (1) Lista cu medicamente de care beneficiază asigurații cu sau fără contribuție personală se elaborează de către Ministerul Sănătății Publice și CNAS, cu consultarea CFR, și se aproba prin hotărâre a Guvernului.
(2) În lista se pot include numai medicamente prevăzute în Nomenclatorul de produse.
Art. 233 - (1) Contravaloarea medicamentelor prescrise pentru tratamentul afectiunilor categoriilor de persoane prevăzute la art. 213 alin. (1) lit. a) și pentru femeile gravide și lauze se suporta din fond, la nivelul prețului de referința sau al prețului de decontare.
(2) Valoarea medicamentelor prevăzute la art. 232 alin. (1), prescrise pentru tratamentul afectiunilor persoanelor prevăzute în actele normative de la art. 213 alin. (1) lit. c) și d), se suporta din fond, la nivelul prețului de referința, în condițiile contractului-cadru.
(3) Asigurații au dreptul la materiale sanitare și dispozitive medicale pentru corectarea vazului, auzului, pentru protezarea membrelor și la alte materiale de specialitate, în scopul protezarii unor deficiente organice sau fiziologice, pentru o perioadă determinata sau nedeterminată, pe baza prescripțiilor medicale, cu sau fără contribuție personală, în condițiile prevăzute în contractul-cadru.
(4) Asigurații beneficiază de proceduri fizioterapeutice, pe baza recomandărilor medicale, cu sau fără contribuție personală, în condițiile prevăzute în contractul-cadru.
(5) Asigurații beneficiază de medicamente, materiale sanitare, dispozitive medicale și de alte mijloace terapeutice prevăzute în normele metodologice de aplicare a contractului-cadru.
Secţiunea a 4-a - Servicii medicale de îngrijiri la domiciliu și alte servicii speciale
Art. 234 - (1) Asigurații au dreptul sa primească unele servicii de îngrijiri medicale la domiciliu, acordate de un furnizor autorizat și evaluat în condițiile legii.
(2) Condițiile acordării serviciilor de îngrijiri medicale la domiciliu se stabilesc prin contractul-cadru.
Art. 235 - Serviciile de transport sanitar, necesare pentru realizarea unui serviciu medical pentru asigurat, se suporta din fond. Asigurații au dreptul la transport sanitar în următoarele situații:
a) urgente medico-chirurgicale;
b) cazurile prevăzute în contractul-cadru.
Secţiunea a 5-a - Servicii medicale acordate asiguraților pe teritoriul altor state
Art. 236 - (1) Persoanele asigurate în sistemul de asigurări sociale de sănătate din România, aflate pe teritoriul statelor cu care România a încheiat documente internaționale cu prevederi în domeniul sănătății, beneficiază de servicii medicale pe teritoriul acestor state, în condițiile prevăzute de respectivele documente internaționale.
(2) Rambursarea cheltuielilor ocazionate de acordarea serviciilor medicale în baza documentelor internaționale cu prevederi în domeniul sănătății la care România este parte este efectuată de casele de asigurări de sănătate prin intermediul CNAS.
(3) Pentru efectuarea operațiunilor prevăzute la alin. (2) CNAS poate deschide conturi la o instituție bancară în care casele de asigurări vor vira sumele reprezentând cheltuielile ocazionate de acordarea serviciilor medicale și a altor prestații persoanelor menționate la alin. (1), în condițiile documentelor internaționale cu prevederi în domeniul sănătății la care România este parte. Metodologia de efectuare a acestor plati se stabilește prin ordin al președintelui CNAS cu avizul Ministerului Finanțelor Publice.
Secţiunea a 6-a - Servicii medicale care nu sunt suportate din Fondul național unic de asigurări sociale de sănătate
Art. 237 - (1) Serviciile care nu sunt decontate din fond, contravaloarea acestora fiind suportată de asigurat, de unitățile care le solicita sau alte surse, după caz, sunt:
a) serviciile medicale acordate în caz de boli profesionale, accidente de muncă și sportive, asistența medicală la locul de muncă, asistența medicală a sportivilor;
b) unele servicii medicale de înaltă performanta;
c) unele servicii de asistența stomatologica;
d) serviciile hoteliere cu grad înalt de confort;
e) corectiile estetice efectuate persoanelor cu vârsta de peste 18 ani;
f) unele medicamente, materiale sanitare și tipuri de transport;
g) eliberarea actelor medicale solicitate de autoritățile care prin activitatea lor au dreptul sa cunoască starea de sănătate a asiguraților;
h) fertilizarea în vitro;
i) transplantul de organe și tesuturi, cu excepția cazurilor prevăzute în Programul Național, aprobat de Agenția Naționala de Transplant și CNAS;
j) asistența medicală la cerere;
k) contravaloarea unor materiale necesare corectării vazului și auzului: baterii pentru aparatele auditive, ochelari de vedere;
l) contribuția personală din prețul medicamentelor, a unor servicii medicale și a dispozitivelor medicale;
m) serviciile medicale solicitate de asigurat;
n) unele proceduri de recuperare și de fizioterapie;
o) serviciile nemedicale efectuate în unități medico-sociale;
p) serviciile acordate în cadrul secțiilor/clinicilor de boli profesionale și al cabinetelor de medicina a muncii;
q) serviciile hoteliere solicitate de pacientii ale căror afecțiuni se tratează în spitalizare de zi.
(2) Serviciile prevăzute la alin. (1) lit. b), c), f), i) și n) și contribuția personală prevăzută la alin. (1) lit. l) se stabilesc prin contractul-cadru.
Secţiunea a 7-a - Asigurarea calității
Art. 238 - Asigurarea calității serviciilor din pachetul de baza pentru asigurați revine CNAS prin respectarea următoarelor măsuri:
a) acceptarea încheierii de contracte numai cu furnizori autorizați și evaluați conform legii;
b) existenta unui sistem informațional corespunzător asigurării unei evidente primare privind diagnosticul și terapia aplicată;
c) respectarea de către furnizori a criteriilor de calitate a asistenței medicale și stomatologice, elaborate de către Ministerul Sănătății Publice și CNAS;
d) utilizarea pentru tratamentul afectiunilor numai a medicamentelor din Nomenclatorul de produse medicamentoase de uz uman;
e) utilizarea materialelor sanitare și a dispozitivelor medicale autorizate, conform legii.
Art. 239 - (1) Criteriile privind calitatea asistenței medicale acordate asiguraților se elaborează de Ministerul Sănătății Publice și CNAS și se referă la diagnostic și tratamentul medico-chirurgical și stomatologic.
(2) Criteriile sunt obligatorii pentru toți furnizorii de servicii medicale care au încheiat contracte cu casele de asigurări.
Art. 240 - În vederea respectării calității serviciilor medicale furnizate asiguraților CNAS și casele de asigurări organizează controlul activității medicale pe baza criteriilor prevăzute la art. 238 și 239.
Secţiunea a 8-a - Acțiuni comune pentru sănătate
Art. 241 - Ministerul Sănătății Publice proiectează, implementeaza și coordonează programe naționale de sănătate, în scopul realizării obiectivelor politicii de sănătate publică, cu participarea instituțiilor cu răspundere în domeniul realizării politicii sanitare a statului.
Art. 242 - (1) Ministerul Sănătății Publice organizează împreună cu CNAS licitații la nivel național și alte proceduri de achiziții publice pentru achiziționarea medicamentelor și materialelor specifice pentru consumul în spitale și în ambulatoriu, în vederea realizării programelor naționale curative de sănătate, cu respectarea dispozițiilor legale în vigoare privind achizițiile publice, inclusiv a celor referitoare la aplicarea procedurii de licitație electronică.
(2) Medicamentele ce se acordă în ambulatoriu în cadrul programelor naționale curative de sănătate se asigura prin farmaciile aparținând unităților sanitare prin care acestea se derulează sau alte farmacii, după caz.
(3) CNAS poate achizitiona servicii medicale, medicamente, materiale sanitare și dispozitive medicale, aferente programelor naționale curative de sănătate și tratamentelor ambulatorii.
Art. 243 - CNAS poate elabora, pentru furnizorii aflați în relații contractuale cu casele de asigurări de sănătate, protocoale de practica, ca baza de decontare pentru servicii medicale, medicamente și dispozitive medicale, cu consultarea CMR, CFR, CMDR și OAMMR.
Secţiunea a 9-a - Evaluarea furnizorilor de servicii medicale, de dispozitive medicale, de medicamente și materiale sanitare
Art. 244 - (1) Pot intră în relație contractuală cu casele de asigurări numai furnizorii de servicii medicale, de dispozitive medicale și de medicamente, care îndeplinesc criteriile de evaluare stabilite de CNAS și Ministerul Sănătății Publice.
(2) Procesul de evaluare cuprinde cabinetele medicale, ambulatoriile de specialitate, spitalele, farmaciile, furnizorii de îngrijiri la domiciliu, furnizorii de dispozitive medicale, furnizorii de servicii medicale de urgenta prespitaliceasca și transport sanitar, precum și alte persoane fizice sau juridice autorizate în acest sens de Ministerul Sănătății Publice.
(3) Evaluarea furnizorilor de servicii medicale, de dispozitive medicale și de medicamente, prevăzuți la alin. (2), se face la nivel național sau județean.
(4) Comisiile de evaluare la nivel național sunt formate din reprezentanți ai Ministerului Sănătății Publice, CNAS, iar la nivel județean comisiile de evaluare sunt formate din reprezentanți ai direcțiilor de sănătate publică județene și a municipiului București și reprezentanți ai caselor de asigurări și, după caz, ai ministerelor și instituțiilor cu rețele sanitare proprii.
(5) Regulamentul de funcționare a comisiilor de evaluare a furnizorilor de servicii medicale, de dispozitive medicale și de medicamente, prevăzuți la alin. (2), se elaborează de comisiile naționale și se aproba prin ordin al ministrului sănătății publice și al președintelui CNAS. Standardele de evaluare elaborate de comisiile naționale de evaluare se aproba prin ordin al ministrului sănătății publice și al președintelui CNAS.
(6) Metodologia și nivelul de evaluare a furnizorilor de servicii medicale, de dispozitive medicale și de medicamente, prevăzuți la alin. (2), se elaborează și se stabilesc de către comisiile organizate la nivel național și se aproba prin ordin al ministrului sănătății publice și al președintelui CNAS.
(7) Finanțarea activității desfășurate în vederea evaluării se suporta proporțional de către instituțiile și asociațiile care desemnează persoane în comisiile prevăzute la alin. (4).
Capitolul IV - Relațiile caselor de asigurări sociale de sănătate cu furnizorii de servicii medicale, de dispozitive medicale și de medicamente
Art. 245 - Furnizorii de servicii medicale, de dispozitive medicale și de medicamente, care sunt în relații contractuale cu casele de asigurări, sunt:
a) unitățile sanitare publice sau private, organizate conform prevederilor legale în vigoare, autorizate și evaluate în condițiile legii;
b) farmaciile, distribuitorii și producătorii de medicamente și materiale sanitare;
c) alte persoane fizice și juridice care furnizează servicii medicale, medicamente și dispozitive medicale.
Art. 246 - (1) Relațiile dintre furnizorii de servicii medicale, medicamente și dispozitive medicale și casele de asigurări sunt de natura civilă, se stabilesc și se desfășoară pe bază de contract care se încheie anual. În situația în care este necesară modificarea sau completarea clauzelor, acestea sunt negociate și stipulate în acte adiționale.
(2) Furnizorii de servicii medicale, medicamente și dispozitive medicale sunt obligați să prezinte, la încheierea contractului cu casa de asigurări, asigurări de răspundere civilă în domeniul medical în concordanta cu tipul de furnizor, atât pentru furnizor, cat și pentru personalul medico-sanitar angajat. Nivelul limitelor de asigurare pe categorii de furnizori care intră în relații contractuale cu casele de asigurări se stabilește de CNAS cu avizul CMR, CFR, CMDR, OAMMR și OBBC, după caz. Societățile de asigurări care oferă asigurări de răspundere civilă în domeniul medical trebuie să fie autorizate de Comisia de Supraveghere a Asigurărilor.
(3) CNAS poate stabili relații contractuale directe cu furnizorii de servicii medicale de dializa. Durata acestor contracte este de un an și poate fi prelungită prin acte adiționale pentru anii următori, în limita creditelor aprobate prin buget pentru anul respectiv, cu respectarea dispozițiilor legale în vigoare.
(4) Furnizorii de servicii medicale, medicamente și dispozitive medicale au obligația de a pune la dispoziția organelor de control ale caselor de asigurări documentele justificative și actele de evidenta financiar-contabila privind sumele decontate din fond.
Art. 247 - Furnizorii de servicii medicale încheie cu casele de asigurări contracte anuale pe baza modelelor de contracte prevăzute în normele metodologice de aplicare a contractului-cadru, în cuprinsul cărora pot fi prevăzute și alte clauze suplimentare, negociate, în limita prevederilor legale în vigoare.
Art. 248 - Refuzul caselor de asigurări de a încheia contracte cu furnizorii pentru serviciile medicale din pachetele de servicii, denunțarea unilaterala a contractului, precum și răspunsurile la cererile și la sesizările furnizorilor se vor face în scris și motivat, cu indicarea temeiului legal, în termen de 30 de zile.
Art. 249 - (1) Casele de asigurări încheie cu furnizorii de servicii medicale, medicamente și dispozitive medicale contracte anuale pentru furnizarea de servicii și pentru plata acestora, urmărind realizarea echilibrului financiar.
(2) La încheierea contractelor părțile vor avea în vedere interesul asiguraților și vor tine seama de economicitatea, eficienta și calitatea serviciilor oferite pe baza criteriilor elaborate de CNAS și Ministerul Sănătății Publice.
(3) Lista de servicii medicale acordate la nivel regional, precum și modalitatea de încheiere a contractelor de furnizare de servicii cu mai multe case de asigurări dintr-o anumită regiune se stabilesc prin contractul-cadru.
Art. 250 - (1) Contractele de furnizare de servicii medicale, medicamente și dispozitive medicale cuprind și obligațiile părților legate de derularea în condiții optime a clauzelor contractuale, precum și clauze care să reglementeze condițiile de plată a serviciilor furnizate până la definitivarea unui nou contract între părți, pentru perioada următoare celei acoperite prin contract.
(2) Decontarea serviciilor medicale și a dispozitivelor medicale aferente lunii decembrie a anului în curs se face în luna ianuarie a anului următor.
Art. 251 - Casele de asigurări controlează modul în care furnizorii de servicii medicale respecta clauzele contractuale privind serviciile furnizate, furnizorii având obligația să permită accesul la evidentele referitoare la derularea contractului.
Art. 252 - (1) Plata furnizorilor de servicii medicale poate fi:
a) în asistența medicală primara și de specialitate ambulatorie, prin tarif pe persoana asigurata, tarif pe serviciu medical;
b) în asistența medicală din spitale și alte unități sanitare publice sau private, în afară celor ambulatorii, prin tarif pe caz rezolvat, tarif pe zi de spitalizare, tarif pe serviciu medical;
c) prin tarife pentru anumite servicii, stabilite prin contractul-cadru;
d) prin preț de referința prevăzut în lista medicamentelor cu sau fără contribuție personală;
e) prin preț de decontare, pentru medicamentele la care nu se stabilește preț de referința, din lista aprobată prin ordin al ministrului sănătății publice;
f) prin preț de referința pentru unele servicii medicale sau prin preț de referința prevăzut în lista de materiale sanitare și de dispozitive medicale sau, după caz, prin suma de închiriere pentru cele acordate pentru o perioadă determinata.
(2) Modalitatea de decontare a serviciilor medicale, medicamentelor, materialelor sanitare și dispozitivelor medicale se stabilește prin contractul-cadru.
Art. 253 - Decontarea serviciilor medicale, a medicamentelor și dispozitivelor medicale se face în baza contractelor încheiate între casele de asigurări și furnizorii de servicii medicale, indiferent de casa de asigurări unde este luat în evidenta asiguratul, pe baza documentelor justificative stabilite prin contractul-cadru.
Art. 254 - Asistența medicală și ingrijirile medicale la domiciliul asiguratului se contractează de casele de asigurări cu furnizori autorizați și evaluați în condițiile legii.
Art. 255 - Asistența medicală de urgenta prespitaliceasca și serviciile de transport medical se acordă prin unități medicale specializate autorizate și evaluate.
Capitolul V - Finanțarea serviciilor medicale, a medicamentelor și dispozitivelor medicale
Secţiunea 1 - Constituirea Fondului național unic de asigurări sociale de sănătate
Art. 256 - (1) Fondul național unic de asigurări sociale de sănătate se formează din:
a) contribuții ale persoanelor fizice și juridice;
b) subvenții de la bugetul de stat;
c) dobânzi, donații, sponsorizări, venituri obținute din exploatarea patrimoniului CNAS și caselor de asigurări, precum și alte venituri, în condițiile legii.
(2) Colectarea contribuțiilor persoanelor juridice și fizice care au calitatea de angajator se face de către Ministerul Finanțelor Publice, prin ANAF, în contul unic deschis pe seama CNAS în condițiile legii, iar colectarea contribuțiilor persoanelor fizice, altele decât cele pentru care colectarea veniturilor se face de către ANAF, se efectuează de către casele de asigurări.
(3) Sumele colectate în contul Fondului național unic de asigurări sociale de sănătate în condițiile prevăzute la alin. (2) sunt în permanenta la dispoziția CNAS și se repartizează de ordonatorul principal de credite proporțional cu sumele stabilite prin legile bugetare anuale, pe fiecare domeniu de asistența medicală.
(4) În mod excepțional, în situații motivate, pentru acoperirea deficitului bugetului Fondului național unic de asigurări sociale de sănătate, după epuizarea fondului de rezerva veniturile bugetului fondului se completează cu sume care se aloca de la bugetul de stat.
(5) Cota de contribuție pentru concedii și indemnizații de asigurări sociale de sănătate, destinată exclusiv finanțării cheltuielilor cu plata acestor drepturi, este de 0,75%, aplicată la fondul de salarii sau, după caz, la drepturile reprezentând indemnizație de șomaj ori asupra veniturilor supuse impozitului pe venit, și se achită la bugetul Fondului național unic de asigurări sociale de sănătate, în condițiile legii.
Art. 257 - (1) Persoana asigurata are obligația plății unei contribuții bănești lunare pentru asigurările de sănătate, cu excepția persoanelor prevăzute la art. 213 alin. (1).
(2) Contribuția lunară a persoanei asigurate se stabilește sub forma unei cote de 6,5%, care se aplică asupra:
a) veniturilor din salarii sau asimilate salariilor care se supun impozitului pe venit;
b) veniturilor impozabile realizate de persoane care desfășoară activități independente care se supun impozitului pe venit; dacă acest venit este singurul asupra căruia se calculează contribuția, aceasta nu poate fi mai mica decât cea calculată la un salariu de baza minim brut pe țara, lunar;
c) veniturilor din agricultura supuse impozitului pe venit și veniturilor din silvicultura, pentru persoanele fizice care nu au calitatea de angajator și nu se încadrează la lit. b);
d) indemnizațiilor de șomaj;
e) veniturilor din cedarea folosinței bunurilor, veniturilor din dividende și dobânzi, veniturilor din drepturi de proprietate intelectuală realizate în mod individual și/sau într-o formă de asociere și altor venituri care se supun impozitului pe venit numai în cazul în care nu realizează venituri de natura celor prevăzute la lit. a)-d), dar nu mai puțin de un salariu de baza minim brut pe țara, lunar;
f) veniturilor realizate din pensii.
(3) În cazul persoanelor care realizează în același timp venituri de natura celor prevăzute la alin. (2) lit. a)-d), contribuția se calculează asupra tuturor acestor venituri.
(4) În cazul persoanelor care realizează venituri de natura celor prevăzute la alin. (2) lit. c) sub nivelul salariului de baza minim brut pe țara și care nu fac parte din familiile beneficiare de ajutor social, contribuția lunară de 6,5% datorată se calculează asupra sumei reprezentând o treime din salariul de baza minim brut pe țara.
(5) Contribuțiile prevăzute la alin. (2) și (4) se plătesc după cum urmează:
a) lunar, pentru cele prevăzute la alin. (2) lit. a), d) și f);
b) trimestrial, pentru cele prevăzute la alin. (2) lit. b) și la alin. (4);
c) anual, pentru cele prevăzute la alin. (2) lit. c) și e).
(6) Contribuția de asigurări sociale de sănătate nu se datorează asupra sumelor acordate în momentul disponibilizarii, venitului lunar de completare sau plăților compensatorii, potrivit actelor normative care reglementează aceste domenii, precum și asupra indemnizațiilor reglementate de Ordonanța de urgenta a Guvernului nr. 158/2005 privind concediile și indemnizațiile de asigurări sociale de sănătate, cu modificările ulterioare.
(7) Obligația virarii contribuției de asigurări sociale de sănătate revine persoanei juridice sau fizice care plătește asiguraților veniturile prevăzute la alin. (2) lit. a), d) și f), respectiv asiguraților pentru veniturile prevăzute la alin. (2) lit. b), c) și e).
(8) Termenul de prescripție a plății contribuției de asigurări sociale de sănătate se stabilește în același mod cu cel prevăzut pentru obligațiile fiscale.
Art. 258 - (1) Persoanele juridice sau fizice la care își desfășoară activitatea asigurații au obligația sa calculeze și sa vireze la fond o contribuție de 7% asupra fondului de salarii, datorată pentru asigurarea sănătății personalului din unitatea respectiva.
(2) Prin fond de salarii realizat, în sensul prezentei legi, se înțelege totalitatea sumelor utilizate de o persoană fizica și juridică pentru plata drepturilor salariale sau asimilate salariilor.
(3) Nerespectarea prevederilor art. 257 alin. (1) duce la diminuarea pachetului de servicii de baza, potrivit prevederilor art. 220. Diminuarea pachetului de servicii de baza are loc după 3 luni de la ultima plata a contribuției.
(4) Pentru perioada în care angajatorii suporta indemnizația pentru incapacitate temporară de muncă, aceștia au obligația de a plati contribuția de 7% raportată la fondul de salarii, pentru salariații aflați în aceasta situație.
Art. 259 - (1) Pentru beneficiarii indemnizației de șomaj contribuția se calculează și se virează odată cu plata drepturilor bănești asupra cărora se calculează de către cei care efectuează plata acestor drepturi.
(2) Pentru pensionari contribuția datorată de aceștia se aplică numai la veniturile din pensiile care depășesc limita supusă impozitului pe venit, se calculează pentru diferența între cuantumul pensiei și aceasta limita și se virează odată cu plata drepturilor bănești asupra cărora se calculează de către cei care efectuează plata acestor drepturi.
(3) Începând cu 1 ianuarie 2007 contribuția pentru veniturile din pensii se datorează și se calculează potrivit alin. (2), precum și asupra sumei neimpozabile din pensii prevăzute de Legea nr. 571/2003 privind Codul fiscal, cu modificările și completările ulterioare. Contribuția calculată asupra sumei neimpozabile din pensii se suporta de bugetul de stat.
(4) Persoanele care nu sunt salariate, dar au obligația să își asigure sănătatea potrivit prevederilor prezentei legi, sunt obligate sa comunice direct casei de asigurări alese veniturile, pe baza contractului de asigurare, în vederea stabilirii și achitării contribuției de 6,5%.
(5) Pentru lucrătorii migranti care își păstrează domiciliul sau reședința în România, contribuția lunară la fond se calculează prin aplicarea cotei de 6,5% la veniturile obținute din contractele încheiate cu un angajator străin.
(6) Pentru persoanele care se asigura facultativ în condițiile art. 214 alin. (2), contribuția lunară la fond se calculează prin aplicarea cotei de 13,5% la valoarea a doua salarii de baza minime brute pe țara, pentru un pachet de servicii stabilit prin contractul-cadru.
(7) Persoanele care au obligația de a se asigura și nu pot dovedi plata contribuției sunt obligate, pentru a obține calitatea de asigurat, sa achite contribuția legală lunară pe ultimii 5 ani, începând cu data primei solicitări de acordare a serviciilor medicale, calculată la salariul de baza minim brut pe țara în vigoare la data plății, sau de la data ultimei plati a contribuției, respectiv de la data când plata contribuției era obligatorie dacă perioada scursa este mai mica de 5 ani, calculandu-se majorări de întârziere.
(8) În situația în care persoanele prevăzute la alin. (7) au realizat venituri impozabile, contribuția, precum și majorările de întârziere aferente se vor calcula asupra acestor venituri pe perioada în care acestea au fost realizate, cu respectarea termenelor de prescripție privind obligațiile fiscale.
(9) Persoanele care au obligația să se asigure, altele decât cele prevăzute la alin. (7) și art. 257 și care nu se încadrează în categoriile de persoane care beneficiază de asigurarea de sănătate fără plata contribuției, plătesc contribuția lunară de asigurări sociale de sănătate calculată prin aplicarea cotei de 6,5% la salariul de baza minim brut pe țara.
(10) Străinii cărora li s-a acordat una dintre formele de protecție prevăzute la art. 1 lit. a), b) și c) din Ordonanța Guvernului nr. 102/2000 privind statutul și regimul refugiatilor în România, republicată, sunt obligați, pentru a obține calitatea de asigurat, sa plătească contribuția legală începând cu data obținerii respectivei forme de protecție.
(11) Străinii cărora li s-a acordat, anterior intrării în vigoare a legislației privind integrarea socială a străinilor care au dobândit o formă de protecție în România, una dintre formele de protecție prevăzute la art. 1 lit. a), b) și c) din Ordonanța Guvernului nr. 102/2000, republicată, sunt obligați, pentru a obține calitatea de asigurat, sa plătească contribuția legală începând cu data intrării în vigoare a legislației privind integrarea socială a străinilor care au dobândit o formă de protecție în România.
Art. 260 - (1) Contribuția datorată pentru persoanele prevăzute la art. 213 se suporta după cum urmează:
a) de către bugetul de stat, pentru persoanele prevăzute la art. 213 alin. (2) lit. a), c), d), f) și i), iar pentru persoanele prevăzute la art. 213 alin. (2) lit. h) începând cu 1 ianuarie 2007;
b) de către bugetul asigurărilor sociale de stat, pentru persoanele prevăzute la art. 213 alin. (2) lit. b);
c) de către bugetul asigurărilor de șomaj, pentru persoanele prevăzute la art. 213 alin. (2) lit. e);
d) de către bugetele locale, pentru persoanele prevăzute la art. 213 alin. (2) lit. g).
(2) Contribuțiile pentru persoanele prevăzute la art. 213 alin. (2) lit. a), c), d), f) și i) se stabilesc prin aplicarea cotei de 6,5% asupra sumei reprezentând valoarea a doua salarii de baza minime brute pe țara.
(3) Contribuțiile pentru persoanele prevăzute la art. 213 alin. (2) lit. b) și e) se stabilesc prin aplicarea cotei de 6,5% asupra indemnizației pentru incapacitate de muncă datorată unui accident de muncă sau unei boli profesionale, respectiv asupra indemnizației de șomaj.
(4) Contribuțiile pentru persoanele prevăzute la art. 213 alin. (2) lit. g) se stabilesc prin aplicarea cotei de 6,5% asupra ajutorului social acordat, în condițiile legii, pentru asigurarea venitului minim garantat.
Art. 261 - (1) Angajatorii și asigurații care au obligația plății contribuției în condițiile prezentei legi și care nu o respecta datorează pentru perioada de întârziere majorări de întârziere în condițiile Codului de procedura fiscală.
(2) CNAS aproba norme privind desfășurarea activității de executare silită a creanțelor datorate fondului de către persoanele fizice, altele decât cele pentru care colectarea veniturilor se face de ANAF.
(3) Angajatorii, indiferent de forma de proprietate, vor depune la banca sau la trezorerie, după caz, odată cu documentația pentru plata salariilor și a altor venituri pentru salariați, documentele pentru plata contribuțiilor datorate fondului, plățile efectuandu-se simultan sub control bancar, respectiv trezorerie.
(4) În cazul neachitarii în termen a contribuțiilor datorate fondului, aplicarea măsurilor de executare silită pentru încasarea sumelor datorate și a majorărilor de întârziere se realizează potrivit procedurilor instituite de Legea nr. 571/2003, cu modificările și completările ulterioare, și Ordonanța Guvernului nr. 92/2003, republicată, cu modificările și completările ulterioare, și normelor aprobate prin ordin al președintelui CNAS, cu avizul consiliului de administrație.
(5) Persoanele prevăzute la art. 257 și 258 au obligația de a pune la dispoziția organelor de control ale ANAF sau ale caselor de asigurări, după caz, documentele justificative și actele de evidenta necesare în vederea stabilirii obligațiilor la fond.
Secţiunea a 2-a - Utilizarea și administrarea Fondului național unic de asigurări sociale de sănătate
Art. 262 - (1) Veniturile fondului se utilizează pentru:
a) plata serviciilor medicale, medicamentelor, materialelor sanitare și dispozitivelor medicale, inclusiv a celor acordate în baza documentelor internaționale cu prevederi în domeniul sănătății la care România este parte, în condițiile stabilite prin contractul-cadru; în valoarea serviciilor medicale se poate include și amortizarea bunurilor achiziționate de unitățile sanitare publice supuse amortizarii potrivit legii, conform normelor elaborate de Ministerul Sănătății Publice și Ministerul Finanțelor Publice;
b) cheltuieli de administrare, funcționare și de capital în limita a maximum 3% din sumele colectate;
c) fondul de rezerva în cota de 1% din sumele constituite anual la nivelul CNAS.
(2) Veniturile fondului se utilizează și pentru plata indemnizațiilor de asigurări sociale de sănătate în condițiile legii.
Art. 263 - (1) Veniturile fondului nu pot fi utilizate pentru:
a) investiții pentru construirea și consolidarea de unități sanitare;
b) achiziționarea aparaturii medicale de la nivelul și condițiile stabilite prin hotărâre a Guvernului;
c) măsuri profilactice și tratamente instituite obligatoriu prin norme legale, altele decât cele prevăzute de prezenta lege.
(2) Cheltuielile prevăzute la alin. (1) se suporta de la bugetul de stat.
Art. 264 - (1) Bugetul fondului se aproba de Parlament, la propunerea Guvernului, ca anexa la legea bugetului de stat.
(2) Bugetele de venituri și cheltuieli ale caselor de asigurări se aproba de ordonatorul principal de credite, în condițiile legii.
Art. 265 - (1) Sumele rămase neutilizate la nivelul caselor de asigurări la sfârșitul fiecărui an se virează în contul CNAS.
(2) Sumele rămase la nivelul CNAS la sfârșitul anului se reportează în anul următor și se utilizează potrivit art. 262 alin. (1) lit. a) și b).
(3) Fondul de rezerva rămas neutilizat la finele anului se reportează în anul următor cu aceeași destinație.
(4) Utilizarea fondului de rezerva se stabilește prin legile bugetare anuale.
(5) Disponibilitățile temporare ale fondului, precum și disponibilitățile fondului de rezerva se păstrează la trezoreria statului și sunt purtătoare de dobânda.
(6) Din disponibilitățile fondului de rezerva și din excedentele înregistrate de fond din anii precedenti pot fi constituite depozite la termen la trezoreria statului, în condițiile stabilite prin convenție încheiată între CNAS și Ministerul Finanțelor Publice.
Capitolul VI - Organizarea caselor de asigurări de sănătate
Secţiunea 1 - Constituirea caselor de asigurări de sănătate și organizarea administrativă
Art. 266 - (1) CNAS este instituție publică, autonomă, de interes național, cu personalitate juridică, care administrează și gestionează sistemul de asigurări sociale de sănătate în vederea aplicării politicilor și programelor Guvernului în domeniul sanitar și are sediul în municipiul București, Calea Calarasilor nr. 248, sectorul 3.
(2) CNAS are ca principal obiect de activitate asigurarea funcționarii unitare și coordonate a sistemului de asigurări sociale de sănătate din România și are în subordine casele de asigurări de sănătate județene și Casa de Asigurări de Sănătate a Municipiului București.
(3) CNAS funcționează pe baza statutului propriu, avizat de consiliul de administrație și aprobat prin hotărâre a Guvernului. Casele de asigurări funcționează pe baza statutului propriu, care respecta prevederile statutului-cadru, aprobat de Consiliul de administrație al CNAS.
(4) Statutele prevăzute la alin. (3) trebuie să conțină prevederi referitoare la:
a) denumirea și sediul casei de asigurări respective;
b) relațiile CNAS cu alte case de asigurări și cu oficiile teritoriale, precum și cu asigurații;
c) structura, drepturile și obligațiile organelor de conducere;
d) modul de adoptare a hotărârilor în consiliul de administrație și relația dintre acesta și conducerea executivă a casei de asigurări;
e) alte prevederi.
Art. 267 - (1) Casele de asigurări sunt instituții publice, cu personalitate juridică, cu bugete proprii, în subordinea CNAS.
(2) Casele de asigurări colectează contribuțiile persoanelor fizice, altele decât cele pentru care colectarea veniturilor se face de către ANAF, și gestionează bugetul fondului aprobat, cu respectarea prevederilor prezentei legi, asigurând funcționarea sistemului de asigurări sociale de sănătate la nivel local, și pot derula și dezvolta și activități pentru valorizarea fondurilor gestionate.
Art. 268 - Pe lângă CNAS funcționează experți pentru implementarea programelor naționale de sănătate curative, finanțate din fond, precum și alte activități stabilite prin ordin al președintelui CNAS.
Art. 269 - Casele de asigurări pot înființa oficii de asigurări de sănătate fără personalitate juridică, la nivelul orașelor, al municipiilor, respectiv al sectoarelor municipiului București, în baza criteriilor stabilite prin ordin al președintelui CNAS.
Secţiunea a 2-a - Atribuțiile caselor de asigurări de sănătate
Art. 270 - (1) Atribuțiile CNAS sunt următoarele:
a) gestionează fondul prin președintele CNAS, împreună cu casele de asigurări;
b) elaborează, implementeaza și gestionează procedurile și formularele unitare, avizate de Ministerul Sănătății Publice, pentru administrarea sistemului de asigurări sociale de sănătate;
c) elaborează și actualizează Registrul unic de evidenta a asiguraților;
d) elaborează și publică raportul anual și planul de activitate pentru anul următor;
e) îndrumă metodologic și controlează modul de aplicare a dispozițiilor legale de către casele de asigurări;
f) răspunde pentru activitățile proprii sistemului de asigurări sociale de sănătate în fața Guvernului și față de asigurați;
g) elaborează proiectul contractului-cadru, care se prezintă de către Ministerul Sănătății Publice spre aprobare Guvernului;
h) elaborează condițiile privind acordarea asistenței medicale din cadrul sistemului de asigurări sociale de sănătate, cu consultarea CMR și CMDR;
i) participa anual la elaborarea listei de medicamente eliberate cu sau fără contribuție personală, pe baza prescripțiilor medicale, pentru persoanele asigurate;
j) administrează și întreține bunurile imobile și baza materială din patrimoniu, în condițiile legii;
k) asigura organizarea sistemului informatic și informațional unic integrat pentru înregistrarea asiguraților și pentru gestionarea și administrarea fondului. Indicatorii folosiți în raportarea datelor în sistemul de asigurări de sănătate sunt unitari și se stabilesc de către Ministerul Sănătății Publice, la propunerea CNAS, CMR și CMDR;
l) negociaza și contractează cu instituții abilitate de lege colectarea și prelucrarea datelor privind unele servicii medicale furnizate asiguraților, în vederea contractării și decontării acestora de către casele de asigurări;
m) acorda gratuit informații, consultanța și asistența în domeniul asigurărilor sociale de sănătate persoanelor asigurate, angajatorilor și furnizorilor de servicii medicale;
n) participa la licitații naționale organizate de Ministerul Sănătății Publice pentru achiziția de medicamente și materiale specifice pentru realizarea programelor de sănătate;
o) încheie și derulează contracte de achiziții publice pentru medicamente și materiale sanitare pentru derularea programelor de sănătate, precum și contracte de furnizare de servicii medicale de dializa;
p) asigura logistica și baza materială necesare activității de pregătire și formare profesională a personalului, din cheltuielile de administrare a fondului;
r) inițiază, negociaza și încheie cu instituții similare documente de cooperare internationala în domeniul sau de activitate;
s) îndeplinește funcția de organism de legătură, care asigura comunicarea cu organismele similare din statele care au încheiat cu România documente internaționale cu prevederi în domeniul sănătății;
t) prezintă un raport anual Guvernului privind starea sistemului de asigurări sociale de sănătate;
u) prezintă rapoarte Parlamentului, la solicitarea acestuia;
v) alte atribuții prevăzute de acte normative în domeniul sănătății.
(2) Realizarea atribuțiilor care revin CNAS, potrivit prezentei legi, este supusă controlului organelor competente potrivit dispozițiilor legale în vigoare.
Art. 271 - Atribuțiile caselor de asigurări sunt următoarele:
a) sa colecteze contribuțiile la fond pentru persoanele fizice, altele decât cele pentru care colectarea veniturilor se face de către ANAF;
b) sa administreze bugetele proprii;
c) sa înregistreze, sa actualizeze datele referitoare la asigurați și să le comunice CNAS;
d) sa elaboreze și sa publice raportul anual și planul de activitate pentru anul următor;
e) sa utilizeze toate demersurile legale pentru a optimiza colectarea contribuțiilor și recuperarea creanțelor restante la contribuții pentru fond;
f) sa furnizeze gratuit informații, consultanța, asistența în problemele asigurărilor sociale de sănătate și ale serviciilor medicale persoanelor asigurate, angajatorilor și furnizorilor de servicii medicale;
g) sa administreze bunurile casei de asigurări, conform prevederilor legale;
h) sa negocieze, sa contracteze și sa deconteze serviciile medicale contractate cu furnizorii de servicii medicale în condițiile contractului-cadru;
i) să monitorizeze numărul serviciilor medicale furnizate și nivelul tarifelor acestora;
j) pot sa organizeze licitații în vederea contractării unor servicii din pachetul de servicii, pe baza prevederilor contractului-cadru;
k) să asigure, în calitate de instituții competente, activitățile de aplicare a documentelor internaționale cu prevederi în domeniul sănătății încheiate de România cu alte state, inclusiv cele privind rambursarea cheltuielilor ocazionate de acordarea serviciilor medicale și a altor prestații, în condițiile respectivelor documente internaționale;
l) alte atribuții prevăzute de acte normative în domeniul sănătății.
Secţiunea a 3-a - Organele de conducere
Art. 272 - (1) CNAS are următoarele organe de conducere:
a) adunarea reprezentanților;
b) consiliul de administrație;
c) președintele;
d) comitetul director;
e) 2 vicepreședinți;
f) directorul general.
(2) Persoanele care fac parte din organele de conducere ale CNAS și ale caselor de asigurări trebuie să îndeplinească următoarele condiții:
a) să fie cetățeni români și să aibă domiciliul pe teritoriul României;
b) să aibă calitatea de asigurat;
c) sa nu aibă cazier judiciar sau fiscal;
d) să aibă studii superioare.
(3) Membrii consiliului de administrație au obligația de a depune declarație de avere și o declarație de interese cu privire la incompatibilitățile prevăzute de prezenta lege, în termen de 15 zile de la numirea în Consiliul de administrație al CNAS. Declarația de interese va fi actualizată ori de câte ori intervin modificări. Actualizarea se face în termen de 30 de zile de la data modificării respective. Declarațiile se vor afișa pe site-ul CNAS. Modelul declarației de interese se aproba prin ordin al președintelui CNAS.
Art. 273 - (1) Adunarea reprezentanților se constituie pe o perioadă de 4 ani și cuprinde:
a) reprezentanți ai asiguraților delegați de consiliile județene și de Consiliul General al Municipiului București, în număr de unu pentru fiecare județ și doi pentru municipiul București. Desemnarea acestor reprezentanți se face în termen de 15 zile de la data intrării în vigoare a prezentei legi;
b) 31 de membri numiți astfel: 2 de către Președintele României, 3 de către primul-ministru, la propunerea ministrului sănătății publice, 3 de către Senat, la propunerea comisiei de specialitate, 3 de către Camera Deputaților, la propunerea comisiei de specialitate, un reprezentant al Ministerului Muncii, Solidarității Sociale și Familiei, un reprezentant al Casei Naționale de Pensii și Alte Drepturi de Asigurări Sociale, 5 de către asociațiile patronale reprezentative la nivel național, 5 de către organizațiile sindicale reprezentative la nivel național, 7 reprezentanți ai ministerelor și instituțiilor centrale cu rețele sanitare proprii, respectiv câte un reprezentant al Ministerului Administrației și Internelor, Ministerului Apărării Naționale, Ministerului Justiției, Ministerului Transporturilor, Construcțiilor și Turismului, Serviciului Roman de Informații, Serviciului de Informații Externe și Serviciului de Telecomunicații Speciale, și un reprezentant al Consiliului Național al Persoanelor Varstnice.
(2) Sunt reprezentative la nivel național asociațiile patronale și organizațiile sindicale care îndeplinesc condițiile prevăzute de Legea nr. 130/1996 privind contractul colectiv de muncă, republicată, cu modificările și completările ulterioare.
(3) Pe locurile devenite vacante ca urmare a demisiei, revocării din cauze prevăzute de lege sau a decesului se numesc noi membri, aleși în aceleași condiții, până la expirarea mandatului în curs.
Art. 274 - (1) Adunarea reprezentanților se întrunește în ședința o dată pe an, la convocarea consiliului de administrație, sau în ședințe extraordinare, la convocarea președintelui CNAS, a consiliului de administrație sau a unui număr de cel puțin 30 de membri ai adunării reprezentanților.
(2) Adunarea reprezentanților poate adopta hotărâri dacă sunt prezente două treimi din numărul membrilor. Pentru adoptarea hotărârilor este necesar votul favorabil al majorității membrilor prezenți.
Art. 275 - Adunarea reprezentanților are următoarele atribuții:
a) propune modificarea Statutului CNAS;
b) analizează repartizarea bugetului aprobat de către cei în drept și recomanda ordonatorului principal de credite luarea măsurilor necesare pentru modificarea acestuia, în condițiile legii;
c) analizează modul de utilizare a fondului, costurile din cadrul sistemului de asigurări sociale de sănătate, serviciile medicale acordate și tarifele practicate la contractarea pachetului de servicii de baza și recomanda măsurile legale pentru folosirea cu eficienta a fondurilor și de respectare a drepturilor asiguraților.
Art. 276 - (1) Consiliul de administrație al CNAS se constituie din 17 membri, cu un mandat pe 4 ani, după cum urmează:
a) 5 reprezentanți ai statului, dintre care unul este numit de Președintele României și 4 de primul-ministru, la propunerea ministrului sănătății publice, a ministrului muncii, solidarității sociale și familiei, a ministrului finanțelor publice și a ministrului justiției;
b) 5 membri numiți prin consens de către confederatiile patronale reprezentative la nivel național;
c) 5 membri numiți prin consens de către confederatiile sindicale reprezentative la nivel național;
d) 2 membri numiți de primul-ministru, cu consultarea Consiliului Național al Persoanelor Varstnice.
(2) Prevederile art. 273 alin. (3) se aplică și în cazul consiliului de administrație.
Art. 277 - (1) Președintele consiliului de administrație este președintele CNAS și are rang de secretar de stat. Președintele CNAS are dreptul la organizarea cabinetului demnitarului în structura CNAS și în limita numărului de posturi prevăzut de lege pentru funcția de secretar de stat. Președintele CNAS este numit de primul-ministru dintre membrii consiliului de administrație, la propunerea ministrului sănătății.
(2) Consiliul de administrație are 2 vicepreședinți aleși de consiliul de administrație prin vot secret, unul din partea confederatiilor patronale reprezentative la nivel național și celălalt din partea confederatiilor sindicale reprezentative la nivel național, stabilite potrivit legii. Vicepreședinții consiliului de administrație sunt și vicepreședinții CNAS.
(3) Președintele, vicepreședinții și directorul general al CNAS se suspenda de drept din funcțiile deținute anterior, pe perioada executării mandatului, cu excepția celor prevăzute la art. 282 alin. (1).
Art. 278 - (1) Consiliul de administrație funcționează în mod legal în prezenta a cel puțin 13 membri.
(2) Hotărârile consiliului de administrație se adoptă cu votul a cel puțin două treimi din numărul membrilor prezenți.
(3) În condițiile în care la prima convocare a unei ședințe a consiliului de administrație nu se îndeplinește cvorumul prevăzut la alin. (1), președintele CNAS, în calitate de președinte al consiliului de administrație, are dreptul sa convoace o noua ședința în termen de maximum 7 zile, în cadrul căreia hotărârile sunt luate cu votul a cel puțin două treimi din numărul membrilor prezenți.
(4) Principalul rol al consiliului de administrație este de a elabora și a realiza strategia naționala în domeniul asigurărilor sociale de sănătate.
(5) La ședințele consiliului de administrație președintele CNAS poate invita persoane care au legătură cu subiectele supuse dezbaterii.
Art. 279 - (1) Consiliul de administrație al CNAS are următoarele atribuții:
a) aproba planul anual de activitate pentru îndeplinirea prevederilor programului de asigurări sociale de sănătate;
b) aproba regulamentul de organizare și funcționare a comisiilor de evaluare și standardele de evaluare a furnizorilor de servicii medicale;
c) aproba criteriile de recrutare și modalitățile de formare a personalului din sistemul de asigurări sociale de sănătate;
d) aproba programul de investiții;
e) aproba încheierea de convenții de cooperare și finanțare de programe cu organisme internaționale;
f) aproba atribuțiile vicepreședinților, la propunerea președintelui;
g) avizează statutul propriu al CNAS, care se aproba prin hotărâre a Guvernului, și aproba statutul-cadru al caselor de asigurări la propunerea Comitetului director;
h) aproba propriul regulament de organizare și funcționare;
i) aproba strategia sistemului de asigurări sociale de sănătate cu privire la colectarea și utilizarea fondului;
j) aproba proiectul bugetului fondului și îl supune aprobării ordonatorului principal de credite, în condițiile legii;
k) avizează, în condițiile legii, repartizarea pe case de asigurări a bugetului fondului;
l) avizează utilizarea fondului de rezerva;
m) analizează semestrial stadiul derulării contractelor și împrumuturilor;
n) avizează rapoartele de gestiune anuale, prezentate de președintele CNAS, contul de încheiere a exercițiului bugetar, precum și raportul anual de activitate;
o) aproba, în baza raportului Curții de Conturi, bilanțul contabil și descărcarea gestiunii anului precedent pentru CNAS și pentru casele de asigurări;
p) avizează proiectul contractului-cadru și al normelor metodologice de aplicare a acestuia;
r) avizează lista medicamentelor de care beneficiază asigurații cu sau fără contribuție personală;
s) aproba criteriile privind calitatea asistenței medicale acordate asiguraților;
t) analizează structura și modul de funcționare ale caselor de asigurări;
u) avizează organigrama CNAS și organigramele caselor de asigurări teritoriale, la propunerea Comitetului director; organigramele care se aproba prin ordin al președintelui CNAS;
v) alte atribuții acordate prin acte normative în vigoare.
(2) Consiliul de administrație se întrunește lunar, la convocarea președintelui CNAS. Consiliul de administrație se poate întruni și în ședințe extraordinare, la cererea președintelui sau a cel puțin unei treimi din numărul membrilor săi.
(3) În exercitarea atribuțiilor ce îi revin Consiliul de administrație al CNAS adopta hotărâri, în condițiile prevăzute la art. 278.
(4) Modul de rezolvare a divergentelor dintre președintele CNAS și consiliul de administrație, în îndeplinirea atribuțiilor stabilite în prezenta lege, se reglementează prin statutul CNAS.
Art. 280 - (1) Președintele CNAS este ordonator principal de credite pentru administrarea și gestionarea fondului și reprezintă CNAS în relațiile cu terții și pe asigurați în raporturile cu alte persoane fizice sau juridice, componente ale sistemului asigurărilor sociale de sănătate.
(2) Președintelui CNAS îi sunt aplicabile prevederile legii responsabilității ministeriale.
Art. 281 - (1) Atribuțiile principale ale președintelui CNAS sunt următoarele:
a) exercita atribuțiile prevăzute de lege, în calitate de ordonator principal de credite, pentru administrarea și gestionarea fondului;
b) organizează și coordonează activitatea de audit și control în sistemul de asigurări sociale de sănătate, potrivit atribuțiilor specifice ale CNAS și ale caselor de asigurări; activitatea de audit se poate desfășura la nivel regional, în condițiile stabilite prin ordin al președintelui CNAS, cu avizul Consiliului de administrație al CNAS;
c) participa ca invitat la ședințele Guvernului în care sunt dezbătute aspecte referitoare la sănătatea populației;
d) numește, sancționează și eliberează din funcție personalul CNAS;
e) prezidează ședințele adunării reprezentanților;
f) alte atribuții stabilite prin Statutul CNAS.
(2) În exercitarea atribuțiilor ce îi revin, precum și pentru punerea în aplicare a hotărârilor consiliului de administrație, președintele CNAS emite ordine care devin executorii după ce sunt aduse la cunoștința persoanelor interesate. Ordinele cu caracter normativ, emise în aplicarea prezentei legi, se publică în Monitorul Oficial al României, Partea I.
Art. 282 - (1) Pe timpul executării mandatului președintele și vicepreședinții sunt numiți pe o perioadă de 4 ani. Aceștia nu pot exercita pe durata mandatului nici o alta funcție sau demnitate publică, cu excepția funcțiilor didactice din învățământul superior.
(2) Membrii Consiliului de administrație al CNAS, pe perioada exercitării mandatului, nu sunt salariați ai CNAS, cu excepția președintelui și a vicepreședinților, și nu pot ocupa funcții în structurile executive ale caselor de asigurări. Aceștia nu pot exercita activități la societăți comerciale sau la alte unități care se afla în relații contractuale cu casele de asigurări.
(3) Salarizarea președintelui și a vicepreședinților CNAS se stabilește după cum urmează:
a) pentru președinte, la nivelul indemnizației prevăzute de lege pentru funcția de secretar de stat;
b) pentru vicepreședinți, la nivelul indemnizației prevăzute de lege pentru funcția de subsecretar de stat.
(4) Salariul și celelalte drepturi de personal ale directorului general al CNAS se stabilesc la nivelul corespunzător prevăzut de lege pentru funcția de secretar general din minister.
(5) Membrii Consiliului de administrație al CNAS, cu excepția președintelui și vicepreședinților, beneficiază de o indemnizație lunară de până la 20% din indemnizația președintelui CNAS, în condițiile prezentei efective la ședințele consiliului de administrație.
Art. 283 - (1) Conducerea executivă a CNAS este asigurata de către directorul general.
(2) Ocuparea postului de director general se face prin concurs, pe o perioadă de 4 ani, și se numește prin ordin al președintelui CNAS.
(3) Organizarea concursului și criteriile de selecție sunt stabilite de președintele CNAS, cu avizul consiliului de administrație.
Art. 284 - Conducerea operativă a CNAS este asigurata de un Comitet director alcătuit din: președinte, vicepreședinți, director general și directorii generali adjuncți. Atribuțiile Comitetului director de conducere al CNAS se aproba prin ordin al președintelui CNAS, cu avizul consiliului de administrație.
Art. 285 - (1) Personalul CNAS și al caselor de asigurări este constituit din funcționari publici și personal contractual, în condițiile legii, și nu pot desfășura activități la furnizorii de servicii medicale.
(2) Salariul și celelalte drepturi ale personalului prevăzut la alin. (1) sunt cele stabilite de actele normative în vigoare aplicabile instituțiilor publice.
(3) Personalului CNAS și al caselor de asigurări îi pot fi acordate stimulente din fondul constituit cu aceasta destinație, în cota de 5% din sumele încasate la bugetul fondului prin executare silită desfășurată de către casele de asigurări și 2,5% din sumele încasate la bugetul fondului prin executare silită de către ANAF. Modalitatea de constituire și utilizare a acestui fond se aproba prin ordin al președintelui CNAS.
Art. 286 - Organele de conducere ale caselor de asigurări sunt consiliul de administrație și președintele-director general.
Art. 287 - (1) Consiliul de administrație al caselor de asigurări de sănătate județene și a municipiului București este alcătuit din 11 membri, desemnați după cum urmează:
a) unul de consiliul județean, respectiv de Consiliul General al Municipiului București;
b) unul de prefect, la propunerea autorității de sănătate publică județene, respectiv a municipiului București;
c) 3 de confederatiile patronale reprezentative la nivel național, desemnați prin consens;
d) 3 de confederatiile sindicale reprezentative la nivel național, desemnați prin consens;
e) 2 de consiliile județene ale persoanelor varstnice, respectiv al municipiului București;
f) președintele, care este directorul general al casei de asigurări.
(2) Mandatul membrilor consiliilor de administrație ale caselor de asigurări este de 4 ani. Membrii consiliilor de administrație ale caselor de asigurări beneficiază de o indemnizație lunară de până la 20% din salariul funcției de director general al casei de asigurări respective, în condițiile prezentei efective la ședințele consiliului de administrație.
(3) Pe perioada mandatului membrii consiliului de administrație pot fi revocați din funcții de către cei care i-au numit, iar pe funcțiile rămase vacante sunt numiți noi membri, până la expirarea mandatului în curs.
(4) Consiliile de administrație ale caselor de asigurări au următoarele atribuții generale:
a) aproba proiectul statutului propriu;
b) avizează proiectul bugetului de venituri și cheltuieli anuale aferente Fondului național unic de asigurări sociale de sănătate;
c) aproba rapoartele de gestiune semestriale și anuale, prezentate de președintele-director general;
d) avizează politica de contractare propusă de președintele-director general, cu respectarea contractului-cadru;
e) avizează programele de acțiuni de imbunatatire a disciplinei financiare, inclusiv măsurile de executare silită potrivit prevederilor legale în vigoare;
f) alte atribuții date prin lege sau prin statut.
(5) Consiliul de administrație ia hotărâri prin vot, în prezenta a cel puțin două treimi din numărul membrilor.
(6) Ședințele consiliului de administrație sunt publice, cu excepția cazurilor în care membrii consiliului decid prin vot ca acestea să se desfășoare cu ușile închise. Problemele legate de buget se vor discuta întotdeauna în ședințe publice.
Art. 288 - (1) Directorii generali ai caselor de asigurări sunt numiți pe bază de concurs, prin ordin al președintelui CNAS. Directorul general devine membru de drept al consiliului de administrație al casei de asigurări și președintele acestuia. Între CNAS și directorul general al casei de asigurări – manager al sistemului la nivel local se încheie un contract de management.
(2) Directorul general al casei de asigurări este ordonator de credite, în condițiile legii.
(3) Directorul general se numește pentru un mandat de 4 ani, după validarea concursului, și se suspenda de drept din funcțiile deținute anterior, cu excepția funcțiilor didactice din învățământul superior. Directorul general are obligația de a depune declarație de interese și declarație de avere. Modelul declarației de interese se aproba prin ordin al președintelui CNAS.
(4) Salarizarea și celelalte drepturi ale directorului general se stabilesc prin contractul de management.
(5) Atribuțiile principale ale directorului general sunt următoarele:
a) aplica normele de gestiune, regulamentele de organizare și de funcționare și procedurile administrative unitare;
b) organizează și coordonează activitatea de control al execuției contractelor de furnizare de servicii medicale;
c) organizează și coordonează activitatea de urmărire și control al colectării contribuțiilor la fond;
d) propune programe de acțiuni de imbunatatire a disciplinei financiare, inclusiv executarea silită, potrivit legii;
e) stabilește modalitatea de contractare, cu respectarea contractului-cadru;
f) organizează împreună cu alte structuri abilitate controale privind respectarea drepturilor asiguraților și propune măsuri în caz de nerespectare a acestora;
g) supraveghează și controlează organizarea și funcționarea sistemului de asigurări de sănătate la nivel teritorial și prezintă anual rapoarte, pe care le da publicității;
h) numește, sancționează și eliberează din funcție personalul casei de asigurări.
Secţiunea a 4-a - Serviciul medical
Art. 289 - (1) În cadrul CNAS funcționează serviciul medical, care este condus de un medic-șef.
(2) La nivelul caselor de asigurări funcționează un serviciu medical, dimensionat în raport cu numărul asiguraților, care este condus de un medic-șef.
(3) Funcția de medic-șef al CNAS și al caselor de asigurări se ocupa prin concurs organizat de CNAS, în condițiile legii.
(4) Funcția de medic-șef al CNAS este echivalenta cu cea de director general adjunct și este salarizata potrivit legii.
Art. 290 - (1) Serviciul medical al CNAS urmărește interesele asiguraților cu privire la calitatea serviciilor acordate de către furnizorii de servicii medicale, medicamente și dispozitive medicale aflați în relații contractuale cu casele de asigurări.
(2) Atribuțiile serviciului medical sunt stabilite prin statut.
Secţiunea a 5-a - Obligațiile caselor de asigurări
Art. 291 - Obligațiile CNAS sunt următoarele:
a) să asigure logistica funcționarii unitare și coordonate a sistemului asigurărilor sociale de sănătate;
b) sa urmărească colectarea și folosirea cu eficienta a fondului;
c) sa folosească mijloace adecvate de mediatizare pentru reprezentarea, informarea și susținerea intereselor asiguraților pe care îi reprezintă;
d) sa acopere potrivit principiilor prezentei legi nevoile de servicii de sănătate ale persoanelor, în limita fondurilor disponibile.
Art. 292 - Obligațiile caselor de asigurări sunt următoarele:
a) sa verifice acordarea serviciilor medicale, conform contractelor încheiate cu furnizorii de servicii medicale;
b) sa deconteze furnizorilor contravaloarea serviciilor medicale contractate și prestate asiguraților, la termenele prevăzute în contractul-cadru, în caz contrar urmând sa suporte penalitățile prevăzute în contract;
c) sa acorde furnizorilor de servicii medicale sume care să țină seama și de condițiile de desfășurare a activității în zone izolate, în condiții grele și foarte grele, pentru care sunt stabilite drepturi suplimentare, potrivit legislației;
d) sa informeze furnizorii de servicii medicale asupra condițiilor de contractare și a negocierii clauzelor contractuale;
e) sa informeze furnizorii de servicii medicale asupra condițiilor de furnizare a serviciilor medicale și despre orice schimbare în modul de funcționare și de acordare a acestora;
f) să asigure confidențialitatea datelor în condițiile prezentei legi;
g) sa verifice prescrierea și eliberarea medicamentelor în conformitate cu reglementările în vigoare;
h) să raporteze CNAS, la termenele stabilite, datele solicitate privind serviciile medicale furnizate, precum și evidenta asiguraților și a documentelor justificative utilizate;
i) sa furnizeze, la solicitarea Ministerului Sănătății Publice, datele de identificare a persoanelor asigurate, numai pentru bolile cu declarare nominală obligatorie, conform legislației în vigoare.
Capitolul VII - Controlul
”Secţiunea
Art. 293 - Controlul de gestiune al CNAS și al caselor de asigurări se face anual de către Curtea de Conturi.Art. 294 - Auditul intern se exercită conform legii și poate fi organizat la nivel regional, în condițiile stabilite prin ordin al președintelui CNAS, cu avizul consiliului de administrație al CNAS.
Secţiunea a 2-a - Controlul furnizarii serviciilor
Art. 295 - (1) CNAS și casele de asigurări organizează și efectuează controlul serviciilor medicale care se acordă asiguraților pe baza contractelor de furnizare de servicii încheiate, potrivit prezentei legi.
(2) În cadrul controalelor efectuate potrivit alin. (1) pot participa și reprezentanți ai CMR, CMDR, CFR și OAMMR.
Art. 296 - Salarizarea persoanelor din structurile menționate la art. 295 alin. (1) este similară cu cea prevăzută de lege pentru compartimentele de audit.
Secţiunea a 3-a
Art. 297 - CNAS prezintă anual Guvernului un raport de activitate, precum și planul de activitate pentru anul următor.
Secţiunea a 4-a - Arbitrajul
Art. 298 - (1) Litigiile dintre furnizorii de servicii medicale sau farmaceutice și casele de asigurări de sănătate pot fi soluționate, la solicitarea uneia dintre părți, pe calea arbitrajului în condițiile și procedurile dreptului comun.
(2) Comisia de arbitraj este formată din câte un arbitru desemnat de fiecare parte și unul desemnat de Consiliul de conducere al Comisiei de arbitraj.
(3) În vederea asigurării activității de arbitraj, pe lângă CNAS se înființează și funcționează Comisia de arbitraj. Comisia nu are personalitate juridică.
(4) Organizarea și funcționarea Comisiei de arbitraj se stabilesc prin ordin comun al ministrului sănătății publice, ministrului justiției și CNAS. Comisia este condusă de un consiliu de conducere format din reprezentanți ai Ministerului Sănătății Publice, CNAS, CMR, CFR și CMDR.
Art. 299 - (1) Arbitrii sunt desemnați de către părți, respectiv de către Consiliul de conducere al Comisiei de arbitraj, dintr-o lista de arbitri atestați de Ministerul Justiției, pe baza unui examen desfășurat în condițiile și potrivit procedurilor stabilite printr-un regulament aprobat prin ordinul ministrului justiției și înregistrat la Comisia de arbitraj.
(2) Pot fi arbitri persoanele care au studii medicale, economice ori studii juridice, îndeplinesc și celelalte condiții legale privind dobândirea calității de arbitru și nu sunt angajați ai niciuneia dintre părțile aflate în litigiu ori ai instituțiilor care au desemnat reprezentanți în Consiliul de conducere al Comisiei de arbitraj.
(3) Pentru activitățile desfășurate în cadrul Comisiei de arbitraj, arbitrii beneficiază de o indemnizație de ședința. Indemnizația de ședința pentru arbitri este de 15%, iar pentru membrii secretariatului tehnic este de 10% din indemnizația președintelui CNAS.
(4) Cheltuielile reprezentând indemnizațiile de ședința pentru arbitri, precum și pentru membrii secretariatului tehnic se suporta din sumele alocate pentru administrarea fondului.
(5) Celelalte cheltuieli rezultate din activitatea Comisiei centrale de arbitraj se suporta de către părțile aflate în litigiu, în condițiile art. 298 alin. (4).
Art. 300 - (1) Regulamentul de soluționare a cauzelor arbitrale, aprobat prin ordin al ministrului justiției, se completează cu prevederile Codului de procedura civilă.
(2) Comisia de arbitraj se va organiza în termen de maximum 90 de zile de la data intrării în vigoare a prezentului titlu.
Capitolul VIII - Raspunderi și sancțiuni
Art. 301 - Încălcarea prevederilor prezentei legi atrage răspunderea materială, civilă, contravențională sau penală, după caz.
Secţiunea 1 - Sancțiuni
Art. 302 - Sancțiunile pentru nerespectarea obligațiilor contractuale de către furnizorii de servicii medicale, medicamente și dispozitive medicale, cuprinse în contractele încheiate cu casele de asigurări de sănătate, se stabilesc prin contractul-cadru.
Secţiunea a 2-a - Infracțiuni
Art. 303 - Fapta persoanei care dispune utilizarea în alte scopuri sau nevirarea la fond a contribuției reținute de la asigurați constituie infracțiunea de deturnare de fonduri și se pedepsește conform prevederilor din Codul penal.
Art. 304 - Completarea declarației prevăzute la art. 215 alin. (2) cu date nereale, având ca efect denaturarea evidentelor privind asigurații, stadiul de cotizare sau contribuțiile față de fond, constituie infracțiunea de fals intelectual și se pedepsește conform prevederilor din Codul penal.
Secţiunea a 3-a - Contravenții
Art. 305 - Constituie contravenții următoarele fapte:
a) nedepunerea la termen a declarației prevăzute la art. 215 alin. (2);
b) nevirarea contribuției datorate conform art. 258 alin. (1) de către persoanele fizice și juridice angajatoare;
c) refuzul de a pune la dispoziția organelor de control ale ANAF și ale caselor de asigurări a documentelor justificative și a actelor de evidenta necesare în vederea stabilirii obligațiilor la fond;
d) refuzul de a pune la dispoziție organelor de control ale caselor de asigurări documentele justificative și actele de evidenta financiar-contabila privind sumele decontate din fond.
Art. 306 - Contravențiile prevăzute la art. 305 se sancționează după cum urmează:
a) cele prevăzute la lit. a) și c), cu amendă de la 500 lei (RON) la 1.000 lei (RON);
b) cele prevăzute la lit. b și d), cu amendă de la 3.000 lei (RON) la 5.000 lei (RON).
Art. 307 - (1) Constatarea contravențiilor și aplicarea sancțiunilor se fac de către organele de control ale ANAF și ale caselor de asigurări.
(2) Amenzile contravenționale aplicate conform prezentei legi constituie venituri la bugetul de stat.
Art. 308 - Prevederile art. 305 se completează cu dispozițiile Ordonanței Guvernului nr. 2/2001 privind regimul juridic al contravențiilor, aprobată cu modificări și completări prin Legea nr. 180/2002, cu modificările și completările ulterioare.
Art. 309 - (1) Contravenientul poate achită, pe loc sau în termen de cel mult 48 de ore de la data încheierii procesului-verbal ori, după caz, de la data comunicării acestuia, jumătate din minimul amenzii prevăzute la art. 306, agentul constatator făcând mențiune despre aceasta posibilitate în procesul-verbal.
(2) Dispozițiile prezentei legi referitoare la obligațiile față de fond se completează cu prevederile Legii nr. 241/2005 pentru prevenirea și combaterea evaziunii fiscale.
Capitolul IX - Dispoziții finale
Art. 310 - (1) Membrii Consiliului de administrație al CNAS și ai consiliilor de administrație ale caselor de asigurări, precum și personalul angajat al acestor case de asigurări, indiferent de nivel, nu pot deține funcții de conducere în cadrul Ministerului Sănătății Publice, autorităților de sănătate publică, furnizorilor de servicii medicale din sistemul de asigurări sociale de sănătate ale căror servicii se decontează din fond, unităților sanitare, cabinetelor medicale, funcții alese sau numite în cadrul CMR, colegiilor județene ale medicilor, respectiv al municipiului București, în cadrul CMDR, colegiilor județene ale medicilor dentisti, respectiv al municipiului București, în cadrul CFR, colegiilor județene ale farmacistilor, respectiv al municipiului București, organizațiilor centrale și locale ale OAMMR, organizațiilor centrale și locale ale OBBC sau funcții în cadrul societăților comerciale cu profil de asigurări, farmaceutic sau de aparatura medicală. Personalului din cadrul CNAS și caselor de asigurări, cu statut de funcționar public, îi sunt aplicabile și dispozițiile Legii nr. 161/2003 privind unele măsuri pentru asigurarea transparenței în exercitarea demnitatilor publice, a funcțiilor publice și în mediul de afaceri, prevenirea și sancționarea corupției, cu modificările și completările ulterioare.
(2) Constituie conflict de interese deținerea de către membrii Consiliului de administrație al CNAS și ai consiliilor de administrație ale caselor de asigurări, precum și de către personalul angajat al acestor case de asigurări de părți sociale, acțiuni sau interese la furnizori care stabilesc relații contractuale cu casele de asigurări de sănătate. Aceasta dispoziție se aplică și în cazul în care astfel de părți sociale, acțiuni sau interese sunt deținute de către soț, sotie, rudele sau afinii până la gradul al IV-lea inclusiv ai persoanei în cauza.
(3) Membrii Consiliului de administrație al CNAS și ai consiliilor de administrație ale caselor de asigurări care, fie personal, fie prin soț, sotie, afini sau rude până la gradul al IV-lea inclusiv, au un interes patrimonial în problema supusă dezbaterii consiliului de administrație nu pot participa la dezbaterile consiliului de administrație și nici la adoptarea hotărârilor.
(4) Persoanele care la data intrării în vigoare a prezentei legi se afla în una dintre incompatibilitățile prevăzute la alin. (1) vor opta pentru una dintre funcțiile ocupate în termen de 30 de zile.
Art. 311 - (1) CNAS gestionează și administrează bunurile mobile și imobile dobândite, în condițiile legii, din activități proprii, subvenții, donații sau din alte surse.
(2) Autoritățile publice centrale sau locale pot transmite, în condițiile prevăzute de lege, bunuri mobile și imobile în administrarea CNAS și a caselor de asigurări.
(3) Recuperarea debitelor din contribuții și majorări se poate face și prin compensarea cu active din patrimoniul debitorilor, evaluate de instituții autorizate în condițiile legii, cu condiția ca acestea să fie necesare funcționarii CNAS sau caselor de asigurări de sănătate.
Art. 312 - În teritoriile neacoperite cu medici sau cu personal sanitar, ori cu unități farmaceutice, pentru asigurarea serviciilor medicale și farmaceutice, consiliile locale pot acorda stimulente în natura și în bani.
Art. 313 - (1) Persoanele care prin faptele lor aduc prejudicii sau daune sănătății altei persoane răspund potrivit legii și sunt obligate sa suporte cheltuielile efective ocazionate de asistența medicală acordată. Sumele reprezentând cheltuielile efective vor fi recuperate de către casele de asigurări și constituie venituri ale fondului.
(2) Furnizorii de servicii care acorda asistența medicală prevăzută la alin. (1) realizează o evidenta distinctă a acestor cazuri și au obligația sa comunice lunar casei de asigurări cu care se afla în relație contractuală documentele justificative care atesta cheltuielile efective realizate.
Art. 314 - CNAS poate organiza activități finanțate din venituri proprii, în condițiile legii.
Art. 315 - Datele necesare pentru stabilirea calității de asigurat vor fi transmise în mod gratuit caselor de asigurări de sănătate de către autoritățile, instituțiile publice și alte instituții, pe bază de protocol.
Art. 316 - Până la organizarea Comisiei de arbitraj prevăzute la art. 298 și 299, litigiile dintre furnizorii de servicii medicale, medicamente și dispozitive medicale și casele de asigurări vor fi judecate de Comisia centrala de arbitraj organizată conform Ordonanței de urgenta a Guvernului nr. 150/2002 privind organizarea și funcționarea sistemului de asigurări sociale de sănătate, cu modificările și completările ulterioare.
Art. 317 - (1) În termen de 12 luni de la data intrării în vigoare a prezentului titlu, Casa Asigurărilor de Sănătate a Apărării, Ordinii Publice, Siguranței Naționale și Autorității Judecătorești și Casa Asigurărilor de Sănătate a Ministerului Transporturilor, Construcțiilor și Turismului vor intra în proces de reorganizare în vederea privatizării.
(2) Până la data reorganizării Casa Asigurărilor de Sănătate a Apărării, Ordinii Publice, Siguranței Naționale și Autorității Judecătorești și Casa Asigurărilor de Sănătate a Ministerului Transporturilor, Construcțiilor și Turismului își vor desfășura activitatea potrivit prevederilor legale de organizare și funcționare a acestora, pe principiul de funcționare al caselor de asigurări județene din cadrul sistemului de asigurări sociale de sănătate.
(3) Pe data intrării în vigoare a prezentului titlu, se abroga Ordonanța de urgenta a Guvernului nr. 150/2002 privind organizarea și funcționarea sistemului de asigurări sociale de sănătate, publicată în Monitorul Oficial al României, Partea I, nr. 838 din 20 noiembrie 2002, cu modificările și completările ulterioare, și Ordonanța de urgenta a Guvernului nr. 119/1999 privind atragerea unor sume suplimentare la bugetul Fondului de asigurări sociale de sănătate, publicată în Monitorul Oficial al României, Partea I, nr. 312 din 30 iunie 1999, aprobată cu modificări prin Legea nr. 593/2001, cu modificările ulterioare.
(4) Dispozițiile cu privire la colectarea contribuțiilor de către casele de asigurări de sănătate pentru persoanele fizice, altele decât cele care au calitatea de asigurat, se aplică până la 1 ianuarie 2007, potrivit Ordonanței Guvernului nr. 94/2004 privind reglementarea unor măsuri financiare, aprobată cu modificări și completări prin Legea nr. 507/2004, cu modificările ulterioare.
Titlul IX - Cardul european și cardul național de asigurări sociale de sănătate
Capitolul I - Dispoziții generale
Art. 318 - Prezentul titlu stabilește principiile, cadrul general și procedurile privind elaborarea, implementarea și distribuirea în România a cardului european și a cardului național de asigurări sociale de sănătate, precum și responsabilitățile instituțiilor publice implicate în acest proces.
Art. 319 - În înțelesul prezentului titlu, termenii și notiunile folosite au următoarea semnificație:
a) card european de asigurări sociale de sănătate, denumit în continuare card european – documentul care conferă titularului asigurat dreptul la prestații medicale necesare în cadrul unei sederi temporare într-un stat membru al Uniunii Europene;
b) card național de asigurări sociale de sănătate, denumit în continuare card național – documentul care dovedește ca titularul acestuia este asigurat în sistemul de asigurări sociale de sănătate din România;
c) case de asigurări de sănătate – casele de asigurări de sănătate județene și a municipiului București;
d) asigurat – persoana asigurata conform legislației în vigoare în cadrul sistemului de asigurări sociale de sănătate din România;
e) ședere temporară – deplasarea unei persoane în unul dintre statele membre ale Uniunii Europene pentru motive turistice, profesionale, familiale sau pentru studii, pentru o perioadă de timp necesară deplasarii, dar nu mai mult de 6 luni.
Capitolul II - Cardul european de asigurări sociale de sănătate
Art. 320 - Cardul european conține următorul set obligatoriu de informații vizibile:
a) numele și prenumele asiguratului;
b) codul numeric personal al asiguratului;
c) data nașterii asiguratului;
d) data expirării cardului;
e) codul Organizației Internaționale pentru Standardizare pentru statul membru emitent al cardului;
f) numărul de identificare și acronimul casei de asigurări de sănătate care emite cardul;
g) numărul cardului.
Art. 321 - (1) Cardul european se eliberează pe cheltuiala asiguratului, de către casa de asigurări de sănătate la care acesta este asigurat.
(2) Emiterea cardului european nu poate fi refuzată de casa de asigurări de sănătate decât în situația în care asiguratul nu face dovada plății la zi a contribuției de asigurări sociale de sănătate.
(3) Emiterea cardului european se face numai prin intermediul sistemului informatic unic național care gestionează aplicarea regulamentelor Uniunii Europene privind drepturile asiguraților aflați în ședere temporară într-un stat membru al Uniunii Europene.
(4) Asiguratul care solicită înlocuirea cardului european în interiorul perioadei de valabilitate stabilite prin reglementările Uniunii Europene va putea beneficia, contra cost, de un alt card a cărui perioada de valabilitate nu va putea depăși perioada de valabilitate a cardului inițial.
(5) Datele solicitate de casele de asigurări de sănătate emitente ale cardului european, precum și de alte instituții care manipuleaza aceste informații se supun legislației referitoare la prelucrarea datelor cu caracter personal.
(6) În cazul în care circumstanțe excepționale împiedica eliberarea cardului european, casa de asigurări de sănătate va elibera un certificat înlocuitor provizoriu cu o perioadă de valabilitate stabilită conform art. 323. Modelul certificatului provizoriu se aproba prin ordin al președintelui Casei Naționale de Asigurări de Sănătate.
Art. 322 - Cardul european se eliberează numai în situația deplasarii asiguratului pentru ședere temporară într-un stat membru al Uniunii Europene.
Art. 323 - Perioada de valabilitate a cardului european este stabilită astfel încât sa acopere perioada de timp necesară șederii temporare, dar nu poate depăși 6 luni de la data emiterii.
Art. 324 - (1) Cardul european poate fi utilizat de către asigurații din sistemul de asigurări sociale de sănătate din România numai pe teritoriul statelor membre ale Uniunii Europene.
(2) Pentru persoanele prevăzute la alin. (1) cardul european nu produce efecte pe teritoriul României și nu creează nici o obligație pentru furnizorii de servicii medicale din România.
Art. 325 - (1) Furnizorii de servicii medicale aflați în relații contractuale cu casele de asigurări de sănătate au obligația de a acorda asistența medicală necesară titularilor cardului european emis de unul dintre statele membre ale Uniunii Europene, în perioada de valabilitate a cardului și în aceleași condiții ca pentru persoanele asigurate în cadrul sistemului de asigurări sociale de sănătate din România, urmând a evidenția și raporta distinct caselor de asigurări sociale de sănătate serviciile medicale acordate pentru această categorie de persoane.
(2) Casele de asigurări de sănătate au obligația de a recunoaște cardurile emise de statele membre ale Uniunii Europene.
Art. 326 - (1) Cardul european conferă dreptul pentru asigurat de a beneficia de asistența medicală necesară în cursul unei sederi temporare într-un stat membru al Uniunii Europene.
(2) Cheltuielile ocazionate de asistența medicală prevăzută la alin. (1) vor fi rambursate de casa de asigurări de sănătate emitenta a cardului, prin Casa Naționala de Asigurări de Sănătate.
(3) Asistența medicală prevăzută la alin. (1) nu trebuie să depășească ceea ce este necesar din punct de vedere medical în timpul șederii temporare.
(4) Persoanele asigurate în unul dintre statele membre ale Uniunii Europene, posesoare ale unui card european, vor fi tratate în România în același mod cu asigurații români.
(5) În bugetul Casei Naționale de Asigurări de Sănătate vor fi alocate sume distincte pentru operațiunile de rambursare prevăzute la alin. (2).
Art. 327 - Cardul european se emite individual pentru fiecare asigurat care îl solicita.
Art. 328 - Cardul european nu acoperă situația în care asiguratul se deplaseaza într-un stat membru al Uniunii Europene în vederea beneficierii de tratament medical.
Art. 329 - Caracteristicile tehnice ale cardului european, precum și modalitățile de elaborare și implementare ale acestuia se aproba prin ordin al președintelui Casei Naționale de Asigurări de Sănătate.
Capitolul III - Cardul național de asigurări sociale de sănătate
Art. 330 - Cardul național de asigurări sociale de sănătate este un card electronic, distinct de cardul european de asigurări sociale de sănătate.
Art. 331 - Informațiile minime care vor putea fi accesate de pe cardul național sunt următoarele:
a) datele de identitate și codul numeric personal;
b) dovada achitării contribuției pentru asigurările sociale de sănătate;
c) înregistrarea numărului de solicitări de servicii medicale, prin codul furnizorului;
d) diagnostice medicale cu risc vital;
e) grupa sanguina și Rh;
f) data expirării cardului;
g) numărul de identificare și acronimul casei de asigurări de sănătate care emite cardul;
h) numărul cardului.
Art. 332 - (1) Cardul național se eliberează de casa de asigurări de sănătate unde figurează ca asigurat titularul cardului.
(2) Cheltuielile necesare pentru eliberarea cardului național sunt suportate de casa de asigurări de sănătate emitenta.
Art. 333 - Cardul național se eliberează numai prin sistemul informatic unic integrat al asigurărilor sociale de sănătate.
Art. 334 - Cardul național poate fi utilizat numai pe teritoriul României.
Art. 335 - Furnizorii de servicii medicale, medicamente și dispozitive medicale aflați în relații contractuale cu casele de asigurări de sănătate au obligația de a acorda asistența medicală titularilor de card național în condițiile prevăzute de contractul-cadru și de normele metodologice de aplicare a acestuia.
Art. 336 - Cardul național se emite individual pentru fiecare asigurat.
Art. 337 - Caracteristicile tehnice ale cardului național, precum și modalitățile de elaborare și implementare ale acestuia se aproba prin ordin al președintelui Casei Naționale de Asigurări de Sănătate.
Art. 338 - În bugetul Fondului național unic de asigurări sociale de sănătate vor fi alocate sume pentru cardul național, astfel încât acesta să poată fi implementat până la sfârșitul anului 2007.
Titlul X - Asigurările voluntare de sănătate
Capitolul I - Dispoziții generale
Art. 339 - În înțelesul prezentului titlu, termenii și notiunile folosite au următoarea semnificație:
a) asigurat – persoana care are un contract de asigurare încheiat cu asiguratorul și față de care asiguratorul are obligația ca la producerea riscului asigurat sa acorde indemnizația sau suma asigurata conform prevederilor contractului de asigurare voluntara de sănătate;
b) asigurator – persoana juridică sau filiala autorizata în condițiile Legii nr. 32/2000 privind activitatea de asigurare și supravegherea asigurărilor, cu modificările și completările ulterioare, sa exercite activități de asigurare, sa practice clasele de asigurări de sănătate din categoria asigurărilor de viața și/sau generale și care își asuma răspunderea de a acoperi cheltuielile cu serviciile medicale prevăzute în contractul de asigurare voluntara de sănătate, precum și sucursala unei societăți de asigurare sau a unei societăți mutuale, dintr-un stat membru al Uniunii Europene sau aparținând Spațiului Economic European, care a primit o autorizație de la autoritatea competentă a statului membru de origine în acest sens;
c) coplata pentru asigurări voluntare de sănătate de tip complementar – suma reprezentând diferența dintre prețul de referința utilizat în sistemul de asigurări sociale de sănătate și suma acceptată la plata de casele de asigurări din Fondul național unic de asigurări sociale de sănătate pentru serviciul acoperit parțial din pachetul de servicii medicale de baza;
d) furnizor de servicii medicale – persoana fizica sau juridică autorizata de Ministerul Sănătății Publice sa acorde servicii medicale în condițiile legii;
e) lista a furnizorilor agreati – totalitatea furnizorilor aflați în relații contractuale cu asiguratori care practica asigurări voluntare de sănătate de tip suplimentar;
f) pachet de servicii medicale de baza – serviciile și produsele destinate prevenirii, diagnosticarii, tratamentului, corectării și recuperării diferitelor afecțiuni, la care asigurații au acces în totalitate, parțial sau cu anumite limitări în volum ori în suma acoperită, în temeiul asigurărilor sociale de sănătate, conform prevederilor legale în vigoare;
g) persoane dependente – persoanele fizice aflate în întreținerea asiguratului și cărora li se furnizează servicii medicale dacă acest lucru este stipulat în contractul de asigurare voluntara de sănătate;
h) preț de referința – prețul utilizat în sistemul de asigurări sociale de sănătate pentru plata unor servicii și produse din pachetul de servicii medicale de baza;
i) servicii medicale furnizate sub forma de abonament servicii medicale preplatite pe care furnizorii le oferă în mod direct abonatilor și nu prin intermediul asigurătorilor, în afară serviciilor din pachetul de servicii medicale de baza din sistemul de asigurări sociale de sănătate.
Art. 340 - (1) Asigurările voluntare de sănătate reprezintă un sistem facultativ prin care un asigurator constituie, pe principiul mutualitatii, un fond de asigurare, prin contribuția unui număr de asigurați expusi la producerea riscului de imbolnavire, și îi indemnizeaza, în conformitate cu clauzele stipulate în contractul de asigurare, pe cei care suferă un prejudiciu, din fondul alcătuit din primele încasate, precum și din celelalte venituri rezultate ca urmare a activității desfășurate de asigurator și fac parte din gama asigurărilor facultative conform Legii nr. 136/1995 privind asigurările și reasigurarile în România, cu modificările și completările ulterioare.
(2) Asigurații pot primi indemnizații atât pentru acea parte a cheltuielilor cu serviciile medicale care excedeaza pachetului de servicii medicale de baza acoperite de sistemul de asigurări sociale de sănătate, cat și pentru coplati, dacă acest lucru este prevăzut în contractul de asigurare voluntara de sănătate.
(3) Nu fac obiectul prezentei legi asigurările pentru boli profesionale și accidente de muncă și serviciile medicale furnizate sub forma de abonament.
Art. 341 - (1) Asigurările voluntare de sănătate pot fi, în sensul prezentei legi, asigurări de tip complementar și suplimentar.
(2) Asigurările voluntare de sănătate de tip complementar suporta total sau parțial plata serviciilor neacoperite parțial din pachetul de servicii medicale de baza, coplati.
(3) Asigurările voluntare de sănătate de tip suplimentar suporta total sau parțial plata pentru orice tip de servicii necuprinse în pachetul de servicii medicale de baza, opțiunea pentru un anumit personal medical, solicitarea unei a doua opinii medicale, condiții hoteliere superioare, alte servicii medicale specificate în polița de asigurare.
Art. 342 - Sunt eligibile pentru serviciile oferite de sistemul de asigurări voluntare de sănătate orice persoane, cetățeni români, cetățeni străini sau apatrizi care au dreptul la pachetul de servicii medicale de baza în temeiul asigurărilor sociale de sănătate, conform prevederilor legale.
Art. 343 - (1) Angajatorii, persoane fizice sau juridice, pot sa încheie contracte de asigurare voluntara de sănătate pentru angajații lor, individual sau în grup, acordate ca beneficii adiționale la drepturile salariale ale acestora, în scopul atragerii și stabilizarii personalului angajat.
(2) În cadrul asigurărilor voluntare de sănătate raporturile dintre asigurat și asigurator, precum și drepturile și obligațiile acestora se stabilesc prin voința părților, sub forma pachetelor de servicii, și sunt menționate în contractul de asigurare voluntara de sănătate.
Art. 344 - Înființarea, autorizarea și funcționarea asigurătorilor care practica asigurări voluntare de sănătate se desfășoară în conformitate cu prevederile legislației care reglementează activitatea de asigurări.
Capitolul II - Contractul de asigurare voluntara de sănătate
Art. 345 - Contractul de asigurare voluntara de sănătate trebuie să cuprindă, pe lângă elementele obligatorii, și următoarele elemente:
a) lista și volumul de acoperire ale coplatilor pentru asigurări voluntare de sănătate de tip complementar, în conformitate cu prețul de referința stabilit de Casa Naționala de Asigurări de Sănătate;
b) lista serviciilor din asigurarea voluntara suplimentară;
c) lista furnizorilor agreati;
d) modalitatea de contactare a acestora, direct sau prin intermediul unui departament de asistența a asiguraților;
e) drepturile și obligațiile părților, cu evidentierea clara a riscului de imbolnavire individual;
f) modalitățile de decontare a serviciilor medicale;
g) modalitățile de încetare a valabilității contractului;
h) modalitățile de soluționare a eventualelor litigii.
Art. 346 - Asiguratorii sunt obligați ca la încheierea contractului de asigurare voluntara de sănătate să ofere asiguratului toate informațiile necesare privind drepturile și obligațiile rezultând din contract, în vederea protejării intereselor asiguraților.
Art. 347 - (1) Asiguratorul poate solicita, la inițierea contractului de asigurare, pe cheltuiala proprie și cu consimțământul pacientului, informații privind starea de sănătate a asiguratului, precum și efectuarea unui examen medical pentru evaluarea stării de sănătate a solicitantului de către un furnizor de servicii medicale desemnat de acesta.
(2) Informațiile cuprinse în contractul de asigurare voluntara, precum și informațiile privind starea de sănătate a asiguratului au caracter confidențial și nu pot fi divulgate unor terți de către asiguratorii care practica asigurări voluntare de sănătate sau persoanele fizice/juridice care, prin natura relațiilor de serviciu, cum ar fi controlor, auditor și alte asemenea funcții, intră în posesia informațiilor în cauza, cu excepția cazurilor prevăzute de lege.
(3) Prin contract, asiguratorul care practica asigurări voluntare de sănătate de tip suplimentar poate restrictiona pentru acest tip de asigurare accesul asiguratului, parțial sau în totalitate, la anumiti furnizori de servicii și poate condiționa utilizarea unor servicii în caz de imbolnavire de efectuarea prealabilă a unor controale periodice profilactice sau de utilizarea unor anumiti furnizori agreati.
(4) Asiguratorii care comercializează asigurări voluntare de sănătate complementare sunt obligați sa achite coplata conform contractului cu asiguratul oricărui furnizor de servicii aflat în relație contractuală cu casele de asigurări și nu pot restrictiona pentru acestea accesul asiguraților.
Capitolul III - Relația furnizorilor de servicii medicale cu societățile de asigurări voluntare de sănătate
Art. 348 - (1) Toți furnizorii care prestează servicii medicale pentru asigurările voluntare de sănătate trebuie să fie autorizați de Ministerul Sănătății Publice, în baza reglementărilor în vigoare. Pentru prestarea serviciilor care intra sub incidența asigurărilor de sănătate de tip complementar, furnizorii de servicii medicale trebuie să fie în relație contractuală cu casele de asigurări.
(2) Furnizorii de servicii medicale care sunt în relație contractuală cu casele de asigurări au obligația de a accepta coplata de la asiguratorii autorizați de a presta asigurări voluntare de sănătate de tip complementar sau, prin excepție, de la asigurați, în conformitate cu lista coplatilor și valoarea ce poate fi acoperită prin sistemul asigurărilor voluntare de sănătate.
(3) Furnizorii de servicii medicale care sunt în relație contractuală cu casele de asigurări au dreptul de a încheia contracte și cu asiguratorii autorizați de a presta asigurări voluntare de sănătate de tip suplimentar.
Art. 349 - (1) Furnizorii de servicii medicale sunt obligați sa elibereze documente justificative de decontare (factura, chitanța) pentru serviciile medicale prestate acoperite prin asigurările voluntare de sănătate.
(2) În cazul în care nu exista un contract încheiat între asigurator și furnizorii de servicii medicale, decontarea cheltuielilor se va face pe baza documentelor justificative emise de furnizorul de servicii medicale.
(3) Unitățile sanitare publice au obligația de a respecta, în relația cu asiguratorii, tarifele maximale privind asigurările suplimentare de sănătate, aprobate prin ordin al ministrului sănătății publice.
(4) Furnizorii privati pot stabili, prin negociere, alte tarife decât cele menționate la alin. (3).
Art. 350 - (1) Comisia de Supraveghere a Asigurărilor supraveghează activitatea asigurătorilor autorizați sa practice asigurări voluntare de sănătate în conformitate cu prevederile legale.
(2) Fiecare asigurator autorizat sa practice asigurările voluntare de sănătate are obligația, în vederea încheierii contractelor de asigurare de acest tip, să obțină avizarea de către direcția de specialitate din cadrul Ministerului Sănătății Publice a listei furnizorilor de servicii medicale agreati, alții decât cei aflați deja în relație contractuală cu casele de asigurări de sănătate, și sa reactualizeze aceasta lista înaintea contractării unui nou furnizor.
(3) Lista coplatilor și prețul de referința pentru serviciile din pachetul de servicii medicale de baza acoperite parțial se stabilesc anual de Casa Naționala de Asigurări de Sănătate cu avizul Ministerului Sănătății Publice.
Art. 351 - (1) În baza contractului încheiat cu furnizorii de servicii, asiguratorii au dreptul de a verifica, prin experți autorizați de Ministerul Sănătății Publice și organizațiile profesionale, direct sau prin interpusi, calitatea serviciilor prestate asiguraților.
(2) Întreaga responsabilitate a actului medical rămâne în seama furnizorilor de servicii medicale și farmaceutice.
Art. 352 - Diferendele survenite între asigurator și furnizorii de servicii medicale se soluționează pe cale amiabila. În cazul imposibilității rezolvarii pe cale amiabila, litigiile se aduc la cunoștința direcției de specialitate din cadrul Ministerului Sănătății Publice și a Comisiei de Supraveghere a Asigurărilor, care vor incerca medierea diferendului. În caz de esec al medierii, diferendele sunt deduse instanțelor judecătorești legal competente.
Art. 353 - Plângerile privind calitatea serviciilor medicale formulate direct de către asigurați sau prin intermediul asigurătorilor autorizați sa practice asigurări voluntare de sănătate se adresează Ministerului Sănătății Publice și sunt notificate Comisiei de Supraveghere a Asigurărilor.
Capitolul IV - Dispoziții finale și sancțiuni
Art. 354 - Asiguratorii care în prezent practica asigurări de sănătate facultative sunt obligați să se conformeze prevederilor art. 350 alin. (2) în termen de 90 de zile de la data publicării prezentei legi în Monitorul Oficial al României, Partea I.
Art. 355 - (1) Divulgarea cu intenție a informațiilor privind starea de sănătate a asiguraților de către un salariat al asiguratorului, fără consimțământul asiguratului, constituie infracțiune și se pedepsește cu închisoare de la 3 luni la 2 ani sau cu amendă de la 25.000 lei (RON) la 50.000 lei (RON).
(2) Dacă fapta prevăzută la alin. (1) a fost săvârșită din culpa, pedeapsa este închisoarea de la o luna la un an sau amenda de la 25.000 lei (RON) la 50.000 lei (RON).
Art. 356 - (1) Încălcarea prevederilor art. 350 alin. (2) și ale art. 354 de către asiguratorii autorizați sa practice asigurări voluntare de sănătate constituie contravenție și se sancționează cu amendă de la 25.000 lei (RON) la 50.000 lei (RON).
(2) Constatarea contravențiilor și aplicarea sancțiunilor contravenționale se fac de către personalul împuternicit al Comisiei de Supraveghere a Asigurărilor.
Art. 357 - Dispozițiile art. 356 se completează cu prevederile Ordonanței Guvernului nr. 2/2001 privind regimul juridic al contravențiilor, aprobată cu modificări și completări prin Legea nr. 180/2002, cu modificările și completările ulterioare.
Art. 358 - Ministerul Sănătății Publice și Comisia de Supraveghere a Asigurărilor vor elabora împreună sau separat, după caz, norme metodologice de aplicare a prezentului titlu în termen de 90 de zile de la data intrării în vigoare a acestuia.
Art. 359 - Lista coplatilor și prețul de referința pentru serviciile din pachetul de servicii medicale de baza acoperite parțial, menționate la alin. (3) al art. 350, se stabilesc anual de Casa Naționala de Asigurări de Sănătate, cu avizul Ministerului Sănătății Publice, și vor fi aprobate prin ordin al președintelui Casei Naționale de Asigurări de Sănătate, în termen de 90 de zile de la data intrării în vigoare a prezentului titlu.
Art. 360 - La data intrării în vigoare a prezentului titlu se abroga Legea asigurărilor private de sănătate nr. 212/2004, publicată în Monitorul Oficial al României, Partea I, nr. 505 din 4 iunie 2004, cu modificările ulterioare.
Titlul XI - Finanțarea unor cheltuieli de sănătate
Art. 361 - În scopul combaterii consumului excesiv de produse din tutun și băuturi alcoolice, altele decât vinul și berea, prevăzute în prezenta lege, precum și pentru finanțarea cheltuielilor de sănătate, se instituie unele contribuții ce se constituie ca venituri proprii ale Ministerului Sănătății Publice.
Art. 362 - Veniturile prevăzute la art. 361 vor fi folosite pentru investiții în infrastructura sistemului sanitar public, finanțarea programelor naționale de sănătate și pentru rezerva Ministerului Sănătății Publice pentru situații speciale.
Art. 363 - (1) În aplicarea prevederilor art. 361 și 362 se stabilesc următoarele măsuri:
a) persoanele juridice care produc sau importa produse din tutun contribuie astfel:
1. pentru tigarete cu suma de 10 euro/1.000 de tigarete;
2. pentru tigari și tigari de foi cu suma de 10 euro/ 1.000 de bucăți;
3. pentru tutun destinat fumatului cu suma de 13 euro/kg;
b) persoanele juridice care produc sau importa băuturi alcoolice, altele decât bere, vinuri, băuturi fermentate, altele decât bere și vinuri, produse intermediare, asa cum sunt definite prin Legea nr. 571/2003 privind Codul fiscal, cu modificările și completările ulterioare, contribuie cu suma de 200 euro/hectolitru alcool pur sau 2 euro/fiecare litru alcool pur;
c) persoanele juridice care realizează încasări din activități publicitare la produse din tutun și băuturi alcoolice contribuie cu o cota de 12% din valoarea acestor încasări, după deducerea taxei pe valoarea adăugată.
(2) Valoarea în lei a contribuțiilor prevăzute la alin. (1), stabilită potrivit legii în echivalent euro/unitate de măsura, se determina prin transformarea sumelor exprimate în echivalent euro la cursul de schimb valutar utilizat pentru calculul accizelor, la data plății acestor contribuții.
Art. 364 - Contribuțiile prevăzute la art. 363 alin. (1) lit. c) se constituie ca venituri proprii ale Ministerului Sănătății Publice începând cu data de 1 ianuarie 2007.
Art. 365 - (1) Contribuțiile prevăzute la art. 363 se virează lunar până la data de 25 a lunii următoare celei în care a avut loc livrarea produselor pe piața interna, într-un cont special, deschis la Trezoreria Statului pe numele Ministerului Sănătății Publice.
(2) Pentru neplata la scadenta a contribuțiilor se calculează și se datorează accesorii în condițiile Ordonanței Guvernului nr. 92/2003 privind Codul de procedură fiscală, republicată, cu modificările și completările ulterioare.
Art. 366 - (1) Veniturilor și cheltuielilor prevăzute la art. 361 și 362 li se aplică prevederile referitoare la bugetele de venituri și cheltuieli ale unor activități, instituite prin Legea nr. 500/2002 privind finanțele publice, cu modificările ulterioare.
(2) Se autorizeaza Ministerul Finanțelor Publice, la propunerea ordonatorului principal de credite, sa introducă modificările ce decurg din aplicarea prevederilor prezentului titlu în anexele aprobate pe anul 2006 Ministerului Sănătății Publice.
Art. 367 - Contribuțiile pentru finanțarea cheltuielilor de sănătate rămase la sfârșitul anului se reportează în anul următor și se utilizează cu aceeași destinație.
Art. 368 - În termen de 30 de zile de la data intrării în vigoare a prezentului titlu, Ministerul Sănătății Publice și Ministerul Finanțelor Publice vor elabora norme de aplicare a prezentului titlu.
Art. 369 - La data intrării în vigoare a prezentului titlu, Ordonanța Guvernului nr. 22/1992 privind finanțarea ocrotirii sănătății, publicată în Monitorul Oficial al României, Partea I, nr. 213 din 28 august 1992, aprobată prin Legea nr. 114/1992, cu modificările și completările ulterioare, se abroga, cu excepția prevederilor privind cota de 12% din încasări din activități publicitare la produse de tutun, tigari și băuturi alcoolice care se abroga la data de 1 ianuarie 2007.
Titlul XII - Exercitarea profesiei de medic. Organizarea și funcționarea Colegiului Medicilor din România
Capitolul I - Exercitarea profesiei de medic
Secţiunea 1 - Dispoziții generale
[Art. 370 - Profesia de medic se exercită, pe teritoriul României, în condițiile prezentei legi, de către persoanele fizice posesoare ale unui titlu oficial de calificare în medicina. Acestea pot fi:
a) cetățeni ai statului român;
b) cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene;
c) soțul unui cetățean român, precum și descendenții și ascendenții în linie directa, aflați în întreținerea unui cetățean român, indiferent de cetățenia acestora;
d) membrii de familie ai unui cetățean al unuia dintre statele prevăzute la lit. b), asa cum sunt definiți la art. 2 alin. (1) pct. 3 din Ordonanța de urgenta a Guvernului nr. 102/2005 privind libera circulație pe teritoriul României a cetățenilor statelor membre ale Uniunii Europene și Spațiului Economic European, aprobată cu modificări și completări prin Legea nr. 260/2005;
e) cetățenii statelor terțe beneficiari ai statutului de rezident permanent în România;
f) beneficiari ai statutului de rezident pe termen lung acordat de către unul dintre statele prevăzute la lit. b).
Art. 371 - (1) În înțelesul prezentului titlu, termenul medici cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene desemnează, prin asimilare, și medicii aflați în situațiile prevăzute la art. 370 lit. d) și f).
(2) În mod exclusiv, prin termenul stat membru de origine sau de proveniență, stat membru de stabilire sau, după caz, stat membru gazda se înțelege un stat membru al Uniunii Europene, un stat aparținând Spațiului Economic European sau Confederatia Elvetiana.
(3) Prin titlu oficial de calificare în medicina se înțelege:
a) diploma de medic, eliberata de o instituție de învățământ superior medico-farmaceutic acreditata din România;
b) certificatul de medic specialist, eliberat de Ministerul Sănătății Publice;
c) diploma, certificatul sau un alt titlu în medicina, eliberate conform normelor Uniunii Europene de statele membre ale Uniunii Europene, statele aparținând Spațiului Economic European sau de Confederatia Elvetiana;
d) diploma, certificatul sau un alt titlu în medicina, dobândite într-un stat terț și recunoscute de unul dintre statele membre prevăzute la lit. c) ori echivalate în România.
Art. 372 - Titlurile oficiale de calificare în medicina obținute în afară României, a statelor membre ale Uniunii Europene, a statelor aparținând Spațiului Economic European sau a Confederatiei Elvetiene se echivaleaza potrivit legii. Excepție de la aceste prevederi fac titlurile oficiale de calificare în medicina care au fost recunoscute de unul dintre aceste state.
Art. 373 - Monitorizarea și controlul exercitării profesiei de medic se realizează de către Colegiul Medicilor din România și Ministerul Sănătății Publice, denumite în continuare autorități competente române.
Art. 374 - (1) Profesia de medic are ca principal scop asigurarea stării de sănătate prin prevenirea imbolnavirilor, promovarea, menținerea și recuperarea sănătății individului și a colectivității.
(2) În vederea realizării acestui scop, pe tot timpul exercitării profesiei, medicul trebuie să dovedească disponibilitate, corectitudine, devotament, loialitate și respect față de fiinta umană.
(3) Deciziile și hotărârile cu caracter medical vor fi luate avându-se în vedere interesul și drepturile pacientului, principiile medicale general acceptate, nediscriminarea între pacienti, respectarea demnității umane, principiile eticii și deontologiei medicale, grija față de sănătatea pacientului și sănătatea publică.
Art. 375 - (1) În scopul asigurării în orice împrejurare a intereselor pacientului, profesia de medic are la baza exercitării sale independenta și libertatea profesională a medicului, precum și dreptul de decizie asupra hotărârilor cu caracter medical.
(2) Având în vedere natura profesiei de medic și obligațiile fundamentale ale medicului față de pacientul sau, medicul nu este funcționar public.
(3) În legătură cu exercitarea profesiei și în limita competentelor profesionale, medicului nu îi pot fi impuse îngrădiri privind prescripția și recomandările cu caracter medical, avându-se în vedere caracterul umanitar al profesiei de medic, obligația medicului de deosebit respect față de fiinta umană și de loialitate față de pacientul sau, precum și dreptul medicului de a prescrie și de a recomanda tot ceea ce este necesar din punct de vedere medical pacientului.
Art. 376 - (1) Cu excepția cazurilor de forta majoră, de urgenta ori când pacientul sau reprezentanții legali ori numiți ai acestuia sunt în imposibilitate de a-și exprima voința sau consimțământul, medicul acționează respectând voința pacientului și dreptul acestuia de a refuza ori de a opri o intervenție medicală.
(2) Responsabilitatea medicală încetează în situația în care pacientul nu respecta prescripția sau recomandarea medicală.
Art. 377 - (1) Medicii care îndeplinesc condiția de cetățenie prevăzută la art. 370 și sunt membri ai Colegiului Medicilor din România exercita profesia de medic, în regim salarial și/sau independent.
(2) Pentru accesul la una dintre activitățile de medic sau exercițiul acesteia, medicii cetățeni ai unui stat membru al Uniunii Europene, ai un stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, stabiliți în unul dintre aceste state, sunt exceptați, în caz de prestare temporară sau ocazionala de servicii medicale pe teritoriul României, de la obligativitatea înscrierii în Colegiul Medicilor din România.
Art. 378 - (1) La primirea în randurile Colegiului Medicilor din România, medicul va depune jurământul lui Hipocrate în formularea moderna adoptată de Asociația Medicală Mondială în cadrul Declarației de la Geneva din anul 1975:
„Odată admis printre membrii profesiunii de medic:
Ma angajez solemn să-mi consacru viața în slujba umanității;
Voi păstra profesorilor mei respectul și recunoștință care le sunt datorate;
Voi exercita profesiunea cu constiinta și demnitate;
Sănătatea pacientilor va fi pentru mine obligația sacră;
Voi păstra secretele încredințate de pacienti, chiar și după decesul acestora;
Voi menține, prin toate mijloacele, onoarea și nobila tradiție a profesiunii de medic;
Colegii mei vor fi frații mei;
Nu voi îngădui să se interpuna între datoria mea și pacient consideratii de naționalitate, rasa, religie, partid sau stare socială;
Voi păstra respectul deplin pentru viața umană de la inceputurile sale chiar sub amenințare și nu voi utiliza cunoștințele mele medicale contrar legilor umanității.
Fac acest jurământ în mod solemn, liber, pe onoare!”
(2) Prevederile alin. (1) se aplică și:
a) medicilor cetățeni români stabiliți în străinătate și care doresc sa exercite profesia în România;
b) medicilor cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, stabiliți în România;
c) medicilor cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, stabiliți în unul dintre aceste state și care solicită intrarea în profesie în România;
d) medicilor care întrunesc condițiile prevăzute la art. 370 lit. c) și e).
(3) Medicii prevăzuți la alin. (2) lit. b) și c) pot depune jurământul în limba română sau în una dintre limbile de circulație din Uniunea Europeană.
Art. 379 - (1) Profesia de medic se exercită pe teritoriul României de către persoanele prevăzute la art. 370 care îndeplinesc următoarele condiții:
a) dețin un titlu oficial de calificare în medicina;
b) nu se găsesc în vreunul dintre cazurile de nedemnitate sau incompatibilitate prevăzute de prezenta lege;
c) sunt apți din punct de vedere medical pentru exercitarea profesiei de medic;
d) sunt membri ai Colegiului Medicilor din România;
e) prin excepție de la lit. d), în caz de prestare temporară sau ocazionala de servicii, medicii care întrunesc condițiile prevăzute la art. 370 lit. b), d) sau f) trebuie să înștiințeze Ministerul Sănătății Publice cu privire la prestarea temporară sau ocazionala de servicii medicale pe teritoriul României și să fie înregistrați pe această perioadă la Colegiul Medicilor din România.
(2) Medicii cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, stabiliți pe teritoriul României, precum și medicii care întrunesc condițiile prevăzute la art. 370 lit. c) și e), exercita profesia de medic cu aceleași drepturi și obligații ca și medicii cetățeni români membri ai Colegiului Medicilor din România.
Art. 380 - (1) Profesia de medic se exercită în România cu tssitlul profesional corespunzător calificării profesionale însușite, după cum urmează:
a) medic de medicina generală pentru absolvenții facultăților de medicina licentiati anterior promotiei 2005 și care au dobândit drept de libera practica în baza normelor precedente prezentei legi;
b) medic specialist în una dintre specialitatile clinice sau paraclinice prevăzute de Nomenclatorul specialitatilor medicale, medico-dentare și farmaceutice pentru rețeaua de asistența medicală.
(2) Prevederile alin. (1) se aplică și cetățenilor unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, care dețin un titlu oficial de calificare în medicina și care exercită profesia în România.
(3) Medicii care au obținut certificatul de membru al Colegiului Medicilor din România pot desfășura activități medicale potrivit pregătirii profesionale în sistemul public de sănătate sau/și în sistemul privat, fie ca angajați, fie ca persoana fizica independenta pe bază de contract. Calitatea de persoana fizica independenta se dobândește în baza certificatului de membru al Colegiului Medicilor din România și a înregistrării la administrația financiară în a carei raza domiciliază medicul. În condițiile legii, medicii pot înființa și cabinete de practica medicală.
Art. 381 - (1) Certificatele eliberate de autoritățile competente ale unui stat membru al Uniunii Europene, ale unui stat aparținând Spațiului Economic European sau ale Confederatiei Elvetiene, care atesta ca medicul posesor, cetățean al acestora, este titular de drept câștigat, sunt recunoscute de autoritățile competente române, permitand exercitarea activităților de medic și, respectiv, cele de medicina de familie, inclusiv în cadrul sistemului național de asigurări sociale de sănătate, cu respectarea prezentei legi.
(2) Prin drept câștigat se înțelege dreptul cetățenilor statelor membre ale Uniunii Europene, ai statelor aparținând Spațiului Economic European sau ai Confederatiei Elvetiene de a exercita activitățile de medic, precum și pe cele de medic cu formarea specifică în medicina generală prevăzută de normele Uniunii Europene, inclusiv în cadrul sistemului de protecție socială al statului membru de origine sau de proveniență, în cazul în care aceștia beneficiau de drept de libera practica a profesiei și erau stabiliți în statul membru respectiv anterior implementarii Directivei Consiliului Uniunii Europene nr. 93/16/CEE.
Secţiunea a 2-a - Nedemnitati și incompatibilități
Art. 382 - Este nedemn de a exercita profesia de medic:
a) medicul care a fost condamnat definitiv pentru săvârșirea cu intenție a unei infracțiuni contra umanității sau vieții în împrejurări legate de exercitarea profesiei de medic și pentru care nu a intervenit reabilitarea;
b) medicul căruia i s-a aplicat pedeapsa interdicției de a exercita profesia, pe durata stabilită, prin hotărâre judecătorească sau disciplinară.
Art. 383 - (1) Exercitarea profesiei de medic este incompatibilă cu:
a) calitatea de angajat sau colaborator al unităților de producție ori de distribuție de produse farmaceutice sau materiale sanitare;
b) starea de sănătate fizica sau psihică necorespunzătoare pentru exercitarea profesiei medicale.
(2) Pe timpul stării de incompatibilitate se suspenda dreptul de exercitare a profesiei.
(3) În termen de 10 zile de la apariția situației de incompatibilitate, medicul este obligat sa anunțe colegiul al cărui membru este.
(4) La solicitarea medicului, la sesizarea oricărei persoane, instituții sau autorități interesate, președintele colegiului din care face parte medicul poate constitui o comisie specială, pentru fiecare caz în parte, alcătuită din 3 medici primari, pentru a confirma sau a infirma situația de incompatibilitate.
Secţiunea a 3-a - Autorizarea exercitării profesiei de medic
Art. 384 - (1) Medicii care întrunesc condițiile prevăzute la art. 370 exercita profesia pe baza certificatului de membru al Colegiului Medicilor din România, avizat anual pe baza asigurării de răspundere civilă, pentru greșeli în activitatea profesională, valabilă pentru anul respectiv.
(2) În caz de prestare temporară sau ocazionala de servicii pe teritoriul României, medicii cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, stabiliți în unul dintre aceste state, sunt exceptați de la obligativitatea înscrierii în Colegiul Medicilor din România. Accesul la activitățile de medic pe durata prestării serviciilor se face conform prevederilor art. 396.
(3) Certificatul de membru se acordă pe baza următoarelor acte:
a) documentele care atesta formarea în profesie;
b) certificatul de sănătate;
c) declarație pe propria răspundere privind îndeplinirea condițiilor prevăzute la art. 382 și 383;
d) certificatul de cazier judiciar.
(4) Certificatul de membru devine operativ numai după încheierea asigurării de răspundere civilă.
Art. 385 - (1) Medicii se pensionează la vârsta prevăzută de lege.
(2) În unitățile sanitare publice, medicii membri titulari și corespondenti ai Academiei Române, profesori universitari și cercetători științifici gradul I, doctori în științe medicale, care desfășoară activități medicale, pot continua, la cerere, activitatea medicală până la împlinirea vârstei de 70 de ani.
(3) Medicii care au depășit limita de vârsta prevăzută la alin. (1) pot profesa în continuare în unități sanitare private. Desfășurarea activității se face în baza certificatului de membru și a avizului anual al Colegiului Medicilor din România eliberat pe baza certificatului de sănătate și a asigurării de răspundere civilă, pentru greșeli în activitatea profesională, încheiată pentru anul respectiv.
(4) În cazul unităților sanitare publice care înregistrează deficit de personal medical, precum și al unităților sanitare publice aflate în zone defavorizate, medicii își pot continua activitatea peste vârsta de pensionare prevăzută de lege. Criteriile de menținere în activitate în aceste situații se stabilesc prin norme aprobate prin hotărâre a Guvernului.
(5) Medicii deținuți sau internati din motive politice, aflați în situațiile prevăzute la art. 1 alin. (1) și (2) din Decretul-lege nr. 118/1990 privind acordarea unor drepturi persoanelor persecutate din motive politice de dictatura instaurată cu începere de la 6 martie 1945, precum și celor deportate în străinătate ori constituite în prizonieri, republicat, cu modificările și completările ulterioare, pot fi mentinuti, la cerere, în activitatea profesională, pe baza certificatului anual de sănătate. Aceste prevederi se aplică și medicilor care, din motive politice, au fost obligați să își intrerupa studiile o anumită perioada, obtinandu-și licenta cu întârziere, ori celor care au fost împiedicați să își reia activitatea profesională.
(6) Medicii care au împlinit vârsta de pensionare prevăzută de lege nu pot deține funcții de conducere în cadrul Ministerului Sănătății Publice, al ministerelor și instituțiilor centrale cu rețea sanitară proprie, al autorităților de sănătate publică, al Casei Naționale de Asigurări de Sănătate, al caselor județene de asigurări de sănătate și a municipiului București, precum și în cadrul spitalelor publice și al oricărei alte unități sanitare publice.
Art. 386 - (1) În cazul în care un medic își întrerupe activitatea profesională sau se afla într-o situație de incompatibilitate pe o perioadă mai mare de 5 ani, Colegiul Medicilor din România atesta competența profesională a acestuia, în vederea reluării activității medicale.
(2) Procedura privind modalitățile și condițiile de verificare și atestare a nivelului profesional se stabilește de către Consiliul Național al Colegiului Medicilor din România.
(3) Prevederile alin. (1) se aplică și medicilor cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, stabiliți în România.
Art. 387 - (1) Practicarea profesiei de medic de către o persoană care nu are aceasta calitate constituie infracțiune și se pedepsește conform Codului penal.
(2) Colegiul Medicilor din România, prin președintele colegiului teritorial, este în drept sa exercite acțiunea civilă sau sa sesizeze, după caz, organele de urmărire penală ori autoritățile competente, pentru urmărirea și trimiterea în judecata a persoanelor care își atribuie sau care întrebuințează fără drept titlul ori calitatea de medic sau care practica în mod nelegal medicina.
(3) Acțiunea penală împotriva unui membru al Colegiului Medicilor din România cu privire la fapte ce au legătură cu exercitarea profesiei de medic se pune în mișcare cu înștiințarea prealabilă a colegiului al cărui membru este medicul respectiv.
(4) Instanțele de judecată civile sau penale, din oficiu, vor comunică Colegiului Medicilor din România hotărârile judecătorești rămase definitive, prin care s-au pronunțat cu privire la fapte exercitate în timpul și în legătură cu profesia de către medici pe teritoriul României.
Capitolul II - Dispoziții privind exercitarea profesiei de medic pe teritoriul României de către medicii cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene
Secţiunea 1 - Dispoziții privind facilitarea dreptului de stabilire
Art. 388 - (1) În caz de stabilire pe teritoriul României, solicitarile medicilor cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene cu privire la accesul la una dintre activitățile de medic se soluționează de Ministerul Sănătății Publice, în colaborare cu Colegiul Medicilor din România, în termen de 3 luni de la depunerea dosarului complet de către cel interesat. Aceștia primesc certificatul de membru al Colegiului Medicilor din România în urma aplicării procedurii de recunoaștere a calificării profesionale.
(2) Dosarul prevăzut la alin. (1) va cuprinde:
a) copia documentului de cetățenie;
b) copia documentelor care atesta formarea în profesie;
c) certificatul emis de autoritățile competente ale statului membru de origine sau de proveniență, prin care se atesta ca titlurile oficiale de calificare sunt cele prevăzute de Directiva 2005/36/CE;
d) certificatul de sănătate fizica și psihică emis de statul membru de origine sau de proveniență;
e) dovada emisă de statul membru de origine sau de proveniență, prin care se atesta onorabilitatea și moralitatea posesorului;
f) dovada de asigurare privind răspunderea civilă pentru greșeli în activitatea profesională, emisă de instituțiile abilitate din unul dintre statele membre prevăzute la alin. (1).
(3) Documentele prevăzute la alin. (2) lit. d)-f) sunt valabile 3 luni de la data emiterii.
Art. 389 - (1) În situația în care pentru accesul și exercițiul activității prevăzute la alin. (1) statul membru de origine sau de proveniență nu impune o astfel de cerința și, în consecința, nu emite cetățenilor săi documentul prevăzut la art. 388 alin. (2) lit. d), autoritățile competente române accepta din partea acestuia un atestat echivalent certificatului de sănătate.
(2) În cazul în care statul membru de origine sau de proveniență nu impune o astfel de cerința și, în consecința, nu emite cetățenilor săi documentul prevăzut la art. 388 alin. (2) lit. e), autoritățile competente române accepta atestatul eliberat pe baza declarației sub jurământ ori a declarației solemne a solicitantului, de către autoritatea judiciară sau administrativă competența ori, după caz, de notarul sau organizația profesională abilitata în acest sens de acel stat.
Art. 390 - (1) În termen de 30 de zile de la primirea dosarului, Ministerul Sănătății Publice informează solicitantul asupra documentelor necesare completării acestuia.
(2) Deciziile autorităților competente române în aceste cazuri pot fi atacate la instanța de contencios administrativ.
Art. 391 - (1) Atunci când autoritățile competente române au cunoștința de fapte grave și precise care pot avea repercusiuni asupra începerii activității profesionale sau asupra exercitării profesiei de medic în România, comise de medicii cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European ori ai Confederatiei Elvetiene, anterior stabilirii în România și în afară teritoriului sau, acestea informează statul membru de origine sau de proveniență al celor în cauza.
(2) Autoritățile competente române comunică statului membru gazda informațiile solicitate cu privire la sancțiunile disciplinare de natura profesională sau administrativă, precum și cu privire la sancțiunile penale interesand exercițiul profesiei de medic, aplicate medicilor pe durata exercitării profesiei în România.
(3) Autoritățile competente române analizează informațiile transmise de statul membru gazda cu privire la faptele grave și precise comise de medicii cetățeni români sau care provin din România, anterior stabilirii în statul membru gazda și în afară teritoriului, ori fapte care pot avea repercusiuni asupra începerii activității profesionale sau asupra exercitării profesiei de medic în acel stat.
(4) Autoritățile competente române decid asupra naturii și amplorii investigatiilor pe care le întreprind în situațiile pentru care au fost sesizate și comunică statului membru gazda consecințele care rezultă cu privire la atestatele și documentele pe care le-au emis în cazurile respective.
Secţiunea a 2-a - Dispoziții cu privire la libera prestare a serviciilor medicale
Art. 392 - (1) Prezentele dispoziții se aplică medicilor cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene care sunt stabiliți în vederea exercitării profesiei în unul dintre aceste state, atunci când se deplaseaza pe teritoriul României pentru a exercita în regim temporar ori ocazional activitățile de medic.
(2) Caracterul temporar sau ocazional al prestării activităților de medic este stabilit, de la caz la caz, de Ministerul Sănătății Publice în funcție de durata, frecventa, periodicitatea și continuitatea acestora.
Art. 393 - (1) Medicii cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, stabiliți în unul dintre aceste state, sunt exceptați de la obligația înscrierii în Colegiul Medicilor din România, precum și de la plata cotizatiei de membru, atunci când solicita accesul la una dintre activitățile de medic, în vederea prestării temporare sau ocazionale de servicii medicale în România.
(2) Aceștia sunt înregistrați automat la Colegiul Medicilor din România pe durata prestării serviciilor respective, în baza copiei documentelor prestatorului prevăzute la art. 396 și transmise în acest scop de Ministerul Sănătății Publice.
(3) Exercițiul activităților de medic, în aceste situații, se face în concordanta cu celelalte drepturi și obligații prevăzute de lege pentru medicii cetățeni români membri ai Colegiului Medicilor din România.
Art. 394 - Pe durata prestării cu caracter temporar sau ocazional a serviciilor medicale pe teritoriul României, persoanele prevăzute la art. 392 alin. (1) se supun dispozițiilor cu caracter profesional, regulamentar ori administrativ al calificarilor profesionale care definesc profesia și utilizarea titlurilor, dispozițiilor cu privire la faptele profesionale grave care afectează direct și specific protecția și securitatea consumatorilor, precum și dispozițiilor disciplinare prevăzute de lege pentru medicii cetățeni români membri ai Colegiului Medicilor din România.
Art. 395 - Prestarea cu caracter temporar sau ocazional a serviciilor medicale pe teritoriul României de către persoanele prevăzute la art. 392 alin. (1) se face cu titlul profesional prevăzut de lege pentru calificarea profesională însușită.
Art. 396 - (1) Solicitarile medicilor cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene stabiliți în unul dintre aceste state, cu privire la prestarea temporară ori ocazionala de servicii medicale în România, se soluționează de către Ministerul Sănătății Publice în colaborare cu Colegiul Medicilor din România.
(2) În cazul în care, în vederea prestării temporare de servicii medicale, solicitantul se afla la prima deplasare în România sau în cazul în care în situația acestuia intervin schimbări materiale atestate de documente, acesta va inainta Ministerului Sănătății Publice:
a) o declarație prealabilă scrisă, în care se precizează durata de prestare, natura, locul de desfășurare a acestor activități, precum și domeniul de asigurare sau alte mijloace de protecție personală ori colectivă privind responsabilitatea profesională de care solicitantul beneficiază în statul membru de stabilire;
b) copia documentului de cetățenie;
c) o dovadă prin care autoritățile competente ale statului membru de stabilire atesta ca la data eliberării acestui document posesorul este stabilit legal pe teritoriul sau în vederea exercitării activităților de medic și nu i-a fost interzisă exercitarea acestora, nici chiar cu titlu temporar;
d) diplomele, certificatele sau alte titluri de medic prevăzute de lege ori de normele Uniunii Europene pentru prestarea activităților în cauza.
(3) Declarația prevăzută la alin. (2) lit. a) poate fi înaintată prin toate mijloacele și se reînnoiește o dată pe an, dacă prestatorul intenționează sa furnizeze, de maniera temporară sau ocazionala, în cursul anului respectiv, servicii medicale în România.
Art. 397 - (1) În caz de prestare temporară a serviciilor medicale în România, medicii cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, stabiliți în unul dintre aceste state, sunt exceptați de la procedura de acreditare prevăzută de legislația asigurărilor sociale de sănătate.
(2) Persoanele prevăzute la alin. (1) au obligația de a informa în prealabil CNAS asupra serviciilor pe care urmează să le presteze pe teritoriul României, iar în caz de urgenta, în termen de maximum 7 zile de la prestarea acestora.
Art. 398 - Începând cu data aderării la Uniunea Europeană, autoritățile competente române vor retrage, după caz, temporar sau definitiv, documentele prevăzute la art. 396 alin. (2) lit. c), eliberate medicilor care întrunesc condițiile prevăzute la art. 370 lit. a), c) și e), precum și medicilor stabiliți în România care întrunesc condițiile prevăzute la art. 370 lit b), d) și f), în cazul în care acestora li se aplică sancțiunile prevăzute de lege cu suspendarea sau interdicția exercitării profesiei.
Art. 399 - (1) Pentru fiecare prestare de servicii, autoritățile competente române pot solicita autorităților competente omoloage din statul membru de stabilire informații pertinente cu privire la legalitatea condiției de stabilire, buna conduita profesională a solicitantului, precum și la absenta, în cazul acestuia, a sancțiunilor disciplinare sau penale.
(2) La solicitarea statului membru gazda, autoritățile competente române transmit informațiile solicitate cu respectarea prevederilor art. 403.
(3) Autoritățile competente asigura schimbul necesar de informații pentru ca plângerea beneficiarului împotriva prestatorului de servicii medicale în regim temporar și ocazional să fie corect soluționată. În aceasta situație, beneficiarul este informat asupra cursului demersului sau.
Secţiunea a 3-a - Dispoziții comune cu privire la dreptul de stabilire și libera prestare de servicii medicale
Art. 400 - Medicii cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene care, în timpul exercitării profesiei în România, încalcă dispozițiile, legile și regulamentele profesiei răspund potrivit legii.
Art. 401 - (1) Medicii cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, care exercită profesia de medic în România, au dreptul de a atașa la titlul profesional prevăzut la art. 380 titlul legal de formare obținut în statul membru de origine ori de proveniență, în limba statului emitent și, eventual, abrevierea acestui titlu. Titlul de formare va fi însoțit de numele și locul instituției sau ale organismului emitent.
(2) Dacă titlul respectiv de formare desemnează în România o pregătire complementara neinsusita de beneficiar, acesta va utiliza în exercițiul profesiei forma corespunzătoare a titlului, indicată de autoritățile competente române.
Art. 402 - (1) Medicii cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, stabiliți și care exercită profesia de medic în România, au obligația de a se informa la autoritățile competente cu privire la legislația din domeniul sănătății, domeniul securității sociale, precum și cu privire la Codul de deontologie medicală.
(2) În vederea furnizarii informațiilor prevăzute la alin. (1), autoritățile române competente vor organiza, la nivelul structurilor teritoriale și centrale, birouri de informare legislativă.
(3) Medicii cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, care exercită profesia ca urmare a recunoașterii calificării profesionale de către autoritățile competente române, trebuie să posede cunoștințele lingvistice necesare desfășurării activităților profesionale în România.
Art. 403 - (1) Autoritățile competente române colaborează îndeaproape cu autoritățile competente omoloage ale statelor membre ale Uniunii Europene, ale statelor aparținând Spațiului Economic European și, respectiv, ale Confederatiei Elvetiene, asigurând confidențialitatea informațiilor transmise.
(2) Schimbul de informații privind sancțiunile disciplinare sau penale aplicate în caz de fapte grave și precise, susceptibile de a avea consecințe asupra activităților de medic, se va face cu respectarea prevederilor Legii nr. 506/2004 privind prelucrarea datelor cu caracter personal și protecția vieții private în sectorul comunicațiilor electronice și a prevederilor Legii nr. 677/2001 pentru protecția persoanelor cu privire la prelucrarea datelor cu caracter personal și libera circulație a acestor date, cu modificările și completările ulterioare.
Capitolul III - Organizarea și funcționarea Colegiului Medicilor din România
Secţiunea 1 - Dispoziții generale
Art. 404 - (1) Colegiul Medicilor din România este organism profesional, apolitic, fără scop patrimonial, de drept public, cu responsabilități delegate de autoritatea de stat, în domeniul autorizării, controlului și supravegherii profesiei de medic ca profesie liberala, de practica publică autorizata.
(2) Colegiul Medicilor din România are autonomie instituțională în domeniul sau de competența, normativ și jurisdicțional profesional și își exercită atribuțiile fără posibilitatea vreunei imixtiuni.
(3) Ministerul Sănătății Publice urmărește modul de respectare a prevederilor legale în activitatea Colegiului Medicilor din România.
(4) Colegiul Medicilor din România cuprinde toți medicii care întrunesc condițiile prevăzute la art. 370 lit. a), c) și e), precum și medicii stabiliți în România care întrunesc condițiile prevăzute la art. 370 lit. b), d) și f) și care exercită profesia de medic în condițiile prezentei legi.
Art. 405 - (1) Colegiul Medicilor din România se organizează și functioneza pe criterii teritoriale, la nivel național și județean, respectiv la nivelul municipiului București.
(2) Între Colegiul Medicilor din România și colegiile teritoriale exista raporturi de autonomie funcțională, organizatorică și financiară.
(3) Sediul Colegiului Medicilor din România este în municipiul București.
Secţiunea a 2-a - Atribuțiile Colegiului Medicilor din România
Art. 406 - (1) Colegiul Medicilor din România are următoarele atribuții:
a) asigura aplicarea regulamentelor și normelor care organizează și reglementează exercitarea profesiei de medic, indiferent de forma de exercitare și de unitatea sanitară în care se desfășoară;
b) apara demnitatea și promovează drepturile și interesele membrilor săi în toate sferele de activitate; apara onoarea, libertatea și independenta profesională ale medicului, precum și dreptul acestuia de decizie în exercitarea actului medical;
c) atesta onorabilitatea și moralitatea profesională ale membrilor săi;
d) întocmește, actualizează permanent Registrul unic al medicilor, administrează pagina de Internet pe care este publicat acesta și înaintează trimestrial Ministerului Sănătății Publice un raport privind situația numerică a membrilor săi, precum și a evenimentelor înregistrate în domeniul autorizării, controlului și supravegherii profesiei de medic;
e) asigura respectarea de către medici a obligațiilor ce le revin față de pacient și de sănătatea publică;
f) elaborează și adopta Statutul Colegiului Medicilor din România și Codul de deontologie medicală;
g) elaborează ghiduri și protocoale de practica medicală, pe niveluri de competente ale unităților sanitare, și le propune spre aprobare Ministerului Sănătății Publice. Elaborarea ghidurilor și protocoalelor de practica medicală poate fi delegată asociațiilor profesional-științifice ale medicilor;
h) stabilește și reglementează regimul de publicitate a activităților medicale;
i) controlează modul în care sunt respectate de către angajatori independenta profesională a medicilor și dreptul acestora de decizie în exercitarea actului medical;
j) promovează și stabilește relații pe plan extern cu instituții și organizații similare;
k) organizează judecarea cazurilor de abateri de la normele de etica profesională, de deontologie medicală și de la regulile de buna practica profesională, în calitate de organ de jurisdicție profesională;
l) promovează interesele membrilor săi în cadrul asigurărilor de răspundere civilă profesională;
m) sprijină instituțiile și acțiunile de prevedere și asistența medico-socială pentru medici și familiile lor;
n) organizează centre de pregătire lingvistica, necesare pentru exercitarea activității profesionale de către medicii cetățeni ai statelor membre ale Uniunii Europene, ai statelor aparținând Spațiului Economic European sau ai Confederatiei Elvetiene;
o) participa, împreună cu Ministerul Educației și Cercetării și cu Ministerul Sănătății Publice, la stabilirea numărului anual de locuri în unitățile de învățământ superior de profil medical acreditate, precum și a numărului de locuri în rezidentiat;
p) colaborează cu organizații de profil profesional-științific, patronal, sindical din domeniul sanitar și cu organizații neguvernamentale în toate problemele ce privesc asigurarea sănătății populației;
q) colaborează cu Ministerul Sănătății Publice la elaborarea reglementărilor din domeniul medical sau al asigurărilor sociale de sănătate;
r) propune criterii și standarde de dotare a cabinetelor de practica medicală independenta, indiferent de regimul proprietății, și le supune spre aprobare Ministerului Sănătății Publice.
(2) Colegiul Medicilor din România, prin structurile naționale sau teritoriale, colaborează în domeniul sau de competența cu Ministerul Sănătății Publice, cu instituții, autorități și organizații la:
a) formarea, specializarea și perfecționarea pregătirii profesionale a medicilor;
b) stabilirea și creșterea standardelor de practica profesională în vederea asigurării calității actului medical în unitățile sanitare;
c) elaborarea metodologiei de acordare a gradului profesional și tematica de concurs;
d) inițierea și promovarea de forme de educație medicală continua în vederea ridicării gradului de competența profesională a membrilor săi;
e) elaborarea criteriilor și standardelor de dotare a cabinetelor de practica medicală independenta, pe care le supune spre aprobare Ministerului Sănătății Publice;
f) promovarea și asigurarea cadrului necesar desfășurării unei concurente loiale bazate exclusiv pe criteriile competentei profesionale;
g) reprezentarea medicilor cu practica independenta care desfășoară activități medicale în cadrul sistemului de asigurări sociale de sănătate;
h) consultarile privind normele de acordare a asistenței medicale în domeniul asigurărilor sociale de sănătate.
(3) Colegiul Medicilor din România avizează înființarea cabinetelor medicale private, indiferent de forma lor juridică, și participa, prin reprezentanți anume desemnați, la concursurile organizate pentru ocuparea posturilor din unitățile sanitare publice.
Art. 407 - În exercitarea atribuțiilor prevăzute de prezenta lege, Colegiul Medicilor din România, prin structurile naționale sau teritoriale, are dreptul de a formula acțiune în justiție în nume propriu sau în numele membrilor săi.
Secţiunea a 3-a - Membrii Colegiului Medicilor din România
Art. 408 - (1) În vederea exercitării profesiei de medic, medicii cetățeni români și medicii cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, stabiliți în România, precum și medicii care întrunesc condițiile prevăzute la art. 370 lit. c) și e) au obligația să se înscrie în Colegiul Medicilor din România.
(2) Calitatea de membru este dovedită prin certificatul de membru al Colegiului Medicilor din România, care se eliberează la înscrierea în corpul profesional.
(3) Înscrierea în Colegiul Medicilor din România și eliberarea certificatului de membru se fac numai pentru medicii care îndeplinesc condițiile prevăzute la art. 379 alin. (1) lit. a), b) și c) și au depus jurământul prevăzut la art. 378 alin. (1).
(4) Depunerea jurământului se va menționa în certificatul de membru al Colegiului Medicilor din România.
(5) Pot deveni, la cerere, membri ai Colegiului Medicilor din România și medicii cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, stabiliți în unul dintre aceste state și care prestează temporar servicii medicale în România, cu respectarea prevederilor alin. (3).
(6) Calitatea de membru al Colegiului Medicilor din România o pot păstra, la cerere, și medicii pensionari care au practicat profesia de medic.
(7) La data intrării în vigoare a prezentei legi, au de drept calitatea de membru al Colegiului Medicilor din România toți medicii înscriși până la această dată.
(8) Membrii Colegiului Medicilor din România sunt înscriși în Registrul unic al medicilor din România, care se publică pe pagina de Internet a Colegiului Medicilor din România.
(9) Evidenta și identificarea membrilor Colegiului Medicilor din România se vor putea face și prin folosirea codului numeric personal.
Art. 409 - (1) La cerere, membrii Colegiului Medicilor din România care, din motive obiective, întrerup pe o durată de până la 5 ani exercitarea profesiei de medic pot solicita suspendarea calității de membru pe acea durata.
(2) Pe durata suspendării la cerere a calității de membru al Colegiului Medicilor din România se suspenda obligațiile și drepturile ce decurg din prezenta lege.
(3) Întreruperea exercitării profesiei de medic pe o durată mai mare de 5 ani atrage, de drept, pierderea calității de membru al Colegiului Medicilor din România.
Art. 410 - (1) Medicii care îndeplinesc condițiile prevăzute de art. 370 se pot înscrie ca membri ai Colegiului Medicilor din România la colegiul teritorial în a cărui raza se afla unitatea la care urmează să își desfășoare activitatea sau la colegiul teritorial în a cărui raza își au domiciliul sau reședința.
(2) Medicii luati în evidenta unui colegiu teritorial, dacă exercita activități medicale și pe raza altui colegiu teritorial, sunt obligați sa anunțe și acest colegiu.
Secţiunea a 4-a - Drepturile și obligațiile membrilor Colegiului Medicilor din România
Art. 411 - Membrii Colegiului Medicilor din România au următoarele drepturi:
a) sa aleagă și să fie aleși în organele de conducere de la nivelul structurilor teritoriale sau naționale ale Colegiului Medicilor din România;
b) să se adreseze organelor abilitate ale Colegiului Medicilor din România și sa primească informațiile solicitate;
c) sa participe la orice acțiune a Colegiului Medicilor din România și să fie informati în timp util despre aceasta;
d) sa folosească, împreună cu membrii lor de familie, toate dotările sociale, profesionale, culturale și sportive ale Colegiului Medicilor din România și ale colegiilor teritoriale;
e) sa poarte însemnele Colegiului Medicilor din România;
f) sa conteste sancțiunile primite;
g) să solicite ajutoare materiale pentru situații deosebite, atât personal, cat și prin membrii lor de familie.
Art. 412 - Obligațiile membrilor Colegiului Medicilor din România sunt următoarele:
a) să facă dovada cunoașterii normelor de deontologie profesională și a celor care reglementează organizarea și funcționarea corpului profesional; modalitatea de testare a cunoștințelor de deontologie și a legislației profesionale se stabilește de Consiliul național al Colegiului Medicilor din România;
b) să respecte dispozițiile Statutului Colegiului Medicilor din România, ale Codului de deontologie medicală, hotărârile organelor de conducere ale Colegiului Medicilor din România și regulamentele profesiei;
c) sa rezolve sarcinile ce le-au fost încredințate în calitate de membru sau de reprezentant al corpului profesional;
d) sa participe la manifestările inițiate de organele de conducere, la activitățile profesionale sau de pregătire profesională inițiate ori organizate de către organele de conducere naționale sau locale;
e) sa participe la ședințele ori adunările la care au fost convocați;
f) să execute cu buna-credința sarcinile ce decurg din hotărârile organelor de conducere ale Colegiului Medicilor din România;
g) să se abțină de la deliberările organelor de conducere în care sunt aleși, în cazul în care, în îndeplinirea unor atribuții ale acestor organe, au un interes propriu;
h) sa păstreze secretul profesional;
i) sa păstreze confidențialitatea asupra dezbaterilor, opiniilor și voturilor exprimate în organele de conducere;
j) să respecte normele, principiile și îndatoririle deontologiei medicale;
k) să aibă un comportament demn în exercitarea profesiei ori a calității de membru al Colegiului Medicilor din România;
l) sa achite, în termenul stabilit, cotizatia datorată în calitate de membru al Colegiului Medicilor din România;
m) sa rezolve litigiile cu alți membri, în primul rând prin mediere de către comisiile organizate în acest scop în cadrul Colegiului Medicilor din România;
n) să execute cu buna-credința atribuțiile ce le revin în calitate de reprezentant sau membru în organele de conducere ale Colegiului Medicilor din România, în colegiile județene sau în Colegiul Medicilor Municipiului București.
Art. 413 - Obligațiile membrilor Colegiului Medicilor din România, ce decurg din calitatea lor specială de medici, sunt:
a) să respecte și să aplice, în orice împrejurare, normele de deontologie medicală;
b) sa nu aducă prejudicii reputației corpului medical sau altor membri, respectând statutul de corp profesional al Colegiului Medicilor din România;
c) sa acorde, cu promptitudine și necondiționat, ingrijirile medicale de urgenta, ca o îndatorire fundamentală profesională și civică;
d) sa acționeze, pe toată durata exercitării profesiei, în vederea creșterii gradului de pregătire profesională;
e) să aplice parafa, cuprinzând numele, prenumele, gradul, specialitatea și codul, pe toate actele medicale pe care le semnează;
f) să respecte drepturile pacientilor.
Art. 414 - (1) În vederea creșterii gradului de pregătire profesională și asigurării unui nivel ridicat al cunoștințelor medicale, medicii sunt obligați să efectueze un număr de cursuri de pregătire și alte forme de educație medicală continua și informare în domeniul stiintelor medicale, pentru cumularea numărului de credite stabilite în acest sens de către Colegiul Medicilor din România. Sunt creditate programele, precum și celelalte forme de educație medicală continua avizate de Colegiul Medicilor din România.
(2) Medicii care nu realizează pe parcursul a 5 ani numărul minim de credite de educație medicală continua, stabilit de Consiliul național al Colegiului Medicilor din România, sunt suspendați din exercițiul profesiei până la realizarea numărului de credite respectiv.
Secţiunea a 5-a - Organizare și funcționare
A. Organizarea la nivel teritorial
Art. 415 - (1) La nivelul fiecărui județ, respectiv la nivelul municipiului București, se organizează câte un colegiu al medicilor, format din toți medicii care exercită profesia în unitatea administrativ-teritorială respectiva, denumit în continuare colegiul teritorial.
(2) Colegiile teritoriale ale medicilor au personalitate juridică, patrimoniu și buget proprii. Patrimoniul se constituie din bunuri mobile și imobile, dobândite în condițiile legii.
(3) Sediul colegiului teritorial al medicilor este în orașul de reședința a județului, respectiv în municipiul București, pentru Colegiul Medicilor Municipiului București.
(4) Nici un colegiu teritorial nu poate funcționa în afară Colegiului Medicilor din România.
Art. 416 - Organele de conducere ale colegiului teritorial sunt:
a) adunarea generală;
b) consiliul;
c) biroul consiliului;
d) președintele.
Art. 417 - (1) Adunarea generală este formată din medicii înscriși la colegiul teritorial respectiv.
(2) Adunarea generală se întrunește anual, în primul trimestru, la convocarea consiliului, și adopta hotărâri cu majoritate simpla în prezenta a două treimi din numărul membrilor săi. Dacă la prima convocare nu s-a realizat majoritatea de două treimi, după 10 zile se organizează o noua ședința, cu aceeași ordine de zi, care va adopta hotărâri cu majoritate simpla, indiferent de numărul membrilor prezenți.
(3) Adunarea generală are următoarele atribuții:
a) alege membrii consiliului și comisia de cenzori a colegiului teritorial;
b) alege reprezentanții în Adunarea generală naționala;
c) aproba proiectul de buget al colegiului și, în baza raportului cenzorilor, descarca de gestiune consiliul pentru anul fiscal încheiat;
d) stabilește indemnizația de ședința a membrilor comisiei de disciplina.
(4) Modalitatea de exprimare a votului se stabilește prin regulamentul electoral.
Art. 418 - Membrii consiliului colegiului teritorial, membrii comisiei de cenzori a colegiului teritorial și membrii în Adunarea generală naționala se aleg pe o perioadă de 4 ani de către membrii colegiului teritorial respectiv, potrivit regulamentului electoral, aprobat de Consiliul național al Colegiului Medicilor din România.
Art. 419 - (1) Consiliul are un număr de membri proporțional cu numărul medicilor înscriși în evidenta colegiului la data organizării alegerilor, după cum urmează:
a) 11 membri, pentru un număr de până la 500 de medici înscriși;
b) 13 membri, pentru un număr de la 501 până la 1.000 de medici înscriși;
c) 19 membri, pentru un număr de la 1.001 până la 2.000 de medici înscriși;
d) 21 de membri, pentru un număr de peste 2.000 de medici înscriși.
(2) Consiliul constituit la nivelul municipiului București este format din 23 de membri.
(3) Proporțional cu numărul de membri ai consiliului se vor alege 3-9 membri supleanți.
Art. 420 - Consiliul colegiului teritorial exercita atribuțiile prevăzute de lege și date în competența sa prin Statutul Colegiului Medicilor din România sau prin hotărâre a Consiliului național.
Art. 421 - (1) Consiliul colegiului teritorial, în prima ședința, organizată în termen de maximum 5 zile de la alegere, alege biroul consiliului.
(2) Biroul consiliului colegiului teritorial este format dintr-un președinte, 3 vicepreședinți și un secretar.
(3) Președintele biroului consiliului colegiului teritorial este și președintele colegiului teritorial.
B. Organizarea la nivel național
Art. 422 - (1) Colegiul Medicilor din România este format din toți medicii înscriși în colegiile teritoriale.
(2) Colegiul Medicilor din România are personalitate juridică, patrimoniu și buget proprii. În bugetul propriu sunt cuprinse și contribuțiile colegiilor teritoriale în cota fixa de 20% din cuantumul cotizațiilor. Patrimoniul poate fi folosit și în activități producătoare de venituri, în condițiile legii.
Art. 423 - Organele de conducere la nivel național ale Colegiului Medicilor din România sunt:
a) Adunarea generală naționala;
b) Consiliul național;
c) Biroul executiv;
d) președintele.
Art. 424 - (1) Adunarea generală naționala este alcătuită din membrii Consiliului național al Colegiului Medicilor din România și din reprezentanții fiecărui colegiu teritorial, aleși potrivit regulamentului electoral prevăzut la art. 418.
(2) Norma de reprezentare în Adunarea generală naționala este de 1/200 de membri.
(3) Reprezentanții în Adunarea generală naționala sunt aleși pe o durată de 4 ani.
(4) Proporțional cu numărul de medici înscriși în evidenta colegiului teritorial se va alege un număr de 3-11 membri supleanți.
Art. 425 - Adunarea generală naționala are următoarele atribuții:
a) adopta Statutul Colegiului Medicilor din România, precum și Codul de deontologie medicală;
b) aproba modificarea acestora;
c) aproba bugetul de venituri și cheltuieli și execuția celui pentru exercițiul expirat;
d) alege, dintre membrii săi, comisia de cenzori;
e) adopta puncte de vedere care să reflecte poziția Colegiului Medicilor din România cu privire la aspecte de interes general în ceea ce privește profesia de medic ori statutul medicului în societate;
f) revoca din funcție membrii aleși pentru abateri de la prevederile prezentei legi și, respectiv, ale Regulamentului de organizare și funcționare a Colegiului Medicilor din România, care aduc prejudicii activității corpului profesional.
Art. 426 - (1) Adunarea generală naționala adopta hotărâri în prezenta a cel puțin două treimi din numărul membrilor săi, cu majoritate simpla de voturi.
(2) Dacă la prima convocare nu se realizează condiția de cvorum, după doua săptămâni se va organiza o alta ședința, cu aceeași ordine de zi, care va putea adopta hotărâri indiferent de numărul membrilor prezenți, cu excepția situațiilor prevăzute la art. 425 lit. a) și b), pentru care este necesară condiția de cvorum prevăzută la alin. (1).
(3) Adunarea generală naționala se întrunește în ședința ordinară în trimestrul I al anului în curs.
Art. 427 - Adunarea generală naționala este condusă de către președintele Colegiului Medicilor din România.
Art. 428 - Adunarea generală naționala poate fi convocată de către:
a) președintele Colegiului Medicilor din România;
b) 3 dintre membrii Biroului executiv;
c) o treime din numărul membrilor Consiliului național al Colegiului Medicilor din România.
Art. 429 - (1) Consiliul național al Colegiului Medicilor din România este alcătuit din câte un reprezentant al fiecărui județ, din 3 reprezentanți ai municipiului București și câte un reprezentant al medicilor din fiecare minister și instituție centrala cu rețea sanitară proprie. În afară de aceștia, Consiliul național al Colegiului Medicilor din România poate fi asistat, cu rol consultativ, de câte un reprezentant al Ministerului Sănătății Publice, Academiei de Științe Medicale, Ministerului Muncii, Solidarității Sociale și Familiei și Ministerului Justiției.
(2) Reprezentanții colegiilor teritoriale în Consiliul național al Colegiului Medicilor din România sunt aleși pe o perioadă de 4 ani de către membrii consiliilor și reprezentanții colegiilor teritoriale în Adunarea generală naționala intruniti într-o ședința comuna.
(3) Cheltuielile cu deplasarea și diurna reprezentanților în Consiliul național al Colegiului Medicilor din România vor fi suportate de colegiile teritoriale ai căror reprezentanți sunt.
(4) Consiliul național al Colegiului Medicilor din România se întrunește legal în prezenta a cel puțin două treimi din numărul reprezentanților stabiliți la alin. (1) și ia decizii cu majoritate simpla de voturi.
Art. 430 - Deciziile Consiliului național al Colegiului Medicilor din România sunt obligatorii pentru colegiile teritoriale și pentru toți medicii care practica medicina în România.
Art. 431 - Atribuțiile Consiliului național al Colegiului Medicilor din România sunt următoarele:
a) elaborează Statutul Colegiului Medicilor din România, precum și proiectele de modificare a acestuia;
b) elaborează Codul de deontologie medicală, precum și proiectele de modificare a acestuia;
c) colaborează cu Ministerul Sănătății Publice la elaborarea de norme privind exercitarea profesiei de medic pe teritoriul României;
d) colaborează cu Ministerul Sănătății Publice la elaborarea Nomenclatorului de specialități medicale, medico-dentare și farmaceutice pentru rețeaua de asistența medicală;
e) colaborează cu Ministerul Sănătății Publice la elaborarea tematicilor și a metodologiilor concursurilor și examenelor pentru medici;
f) stabilește sistemul de credite de educație medicală continua, pe baza căruia se evalueaza activitatea de perfecționare profesională a medicilor;
g) colaborează cu Ministerul Sănătății Publice la elaborarea criteriilor medicale de selecție a pacientilor în cazul unor tipuri de tratamente disponibile în număr limitat;
h) înaintează spre aprobare Ministerului Sănătății Publice ghidurile și protocoalele de practica medicală elaborate în condițiile art. 406 alin. (1) lit. g);
i) fixează cotizatia care trebuie plătită obligatoriu de către fiecare medic colegiului teritorial;
j) gestionează bunurile Colegiului Medicilor din România și poate să initieze și sa subventioneze acțiuni interesand profesia medicală, acțiuni de întrajutorare sau de sponsorizare;
k) soluționează, prin comisiile de specialitate, în termen de 30 de zile de la înregistrare, contestațiile formulate împotriva deciziilor date de consiliile județene, respectiv de Consiliul General al Municipiului București, în conformitate cu regulamentele proprii;
l) alege dintre membrii săi Biroul executiv al Colegiului Medicilor din România;
m) propune Adunării generale naționale proiectul privind bugetul de venituri și cheltuieli al Colegiului Medicilor din România;
n) alege dintre membrii Colegiului Medicilor din România pe cei care vor forma comisiile de lucru;
o) stabilește indemnizațiile membrilor Biroului executiv și indemnizația de ședința a membrilor Comisiei superioare de disciplina;
p) stabilește condițiile privind desfășurarea de către cabinetele și unitățile medicale a publicității, iar prin comisia de specialitate aproba conținutul materialului publicitar;
r) reprezintă, în condițiile art. 406 alin. (2), membrii săi la elaborarea contractului-cadru și negocierea normelor de acordare a asistenței medicale în domeniul asigurărilor sociale de sănătate.
Art. 432 - Consiliul național al Colegiului Medicilor din România aproba exercitarea ocazionala, cu caracter didactic, de instruire, informare și schimb de experienta, a profesiei de medic de către medicii care nu au calitatea de membru al Colegiului Medicilor din România.
Art. 433 - Consiliul național al Colegiului Medicilor din România stabilește, în domeniul sau de competența, strategia și planul anual de control și supraveghere a modului de exercitare a profesiei de medic.
Art. 434 - Biroul executiv al Colegiului Medicilor din România este format dintr-un președinte, 3 vicepreședinți și un secretar general, aleși în mod individual de către Consiliul național, dintre membrii săi, pe o durată de 4 ani.
Art. 435 - (1) Biroul executiv al Colegiului Medicilor din România lucrează legal în prezenta a cel puțin 3 dintre membrii săi și aproba deciziile cu votul a cel puțin 3 membri.
(2) Biroul executiv se întrunește o dată pe săptămâna sau ori de câte ori este cazul, la cererea președintelui sau a cel puțin 2 dintre membrii săi. În condițiile stabilite de Statutul Colegiului Medicilor din România, votul poate fi exprimat și prin corespondenta sau în format electronic.
Art. 436 - Atribuțiile Biroului executiv al Colegiului Medicilor din România sunt următoarele:
a) asigura activitatea permanenta a Colegiului Medicilor din România între ședințele Consiliului național;
b) aproba angajarea de personal și asigura execuția bugetului Colegiului Medicilor din România;
c) întocmește raportul anual de activitate și gestiune, pe care îl supune spre aprobare Consiliului național;
d) accepta donațiile, legatele și sponsorizarile făcute Colegiului Medicilor din România;
e) executa hotărârile Adunării generale naționale și ale Consiliului național;
f) elaborează și supune spre avizare Consiliului național proiectul bugetului de venituri și cheltuieli, pe baza bugetelor locale;
g) informează Consiliul național cu privire la deciziile emise între ședințele Consiliului;
h) îndeplinește orice alte sarcini stabilite de către Consiliul național.
Art. 437 - Biroul executiv al Colegiului Medicilor din România coordonează activitatea comisiilor de lucru ale Consiliului național al Colegiului Medicilor din România.
Art. 438 - În exercitarea mandatului, membrii Biroului executiv, precum și membrii birourilor consiliilor colegiilor teritoriale vor primi o indemnizație lunară, al carei cuantum va fi aprobat, după caz, de Consiliul național, respectiv de consiliile colegiilor teritoriale.
Art. 439 - Președintele Biroului executiv al Consiliului național este președintele Colegiului Medicilor din România.
Art. 440 - Președintele Colegiului Medicilor din România îndeplinește următoarele atribuții:
a) reprezintă Colegiul Medicilor din România în relațiile cu persoanele fizice și juridice din țara și străinătate;
b) încheie contracte și convenții în numele Colegiului Medicilor din România, cu aprobarea Biroului executiv;
c) convoacă și conduce ședințele adunării generale și ale Consiliului național;
d) duce la îndeplinire deciziile Biroului executiv, hotărârile Consiliului național date în sarcina sa și rezolva problemele și lucrările curente;
e) angajează personalul de specialitate și administrativ;
f) îndeplinește orice alte sarcini stabilite de Consiliul național ori de Biroul executiv, potrivit legii.
Art. 441 - (1) Nu pot primi sau exercita mandatul de membru al organelor de conducere ale Colegiului Medicilor din România, atât la nivel național, cat și teritorial, medicii care dețin funcții de conducere în cadrul Ministerului Sănătății Publice, respectiv al ministerelor și instituțiilor cu rețea sanitară proprie, al structurilor deconcentrate ale acestuia ori în cadrul Casei Naționale de Asigurări de Sănătate, al caselor județene de asigurări de sănătate și a municipiului București, al patronatelor și sindicatelor profesionale, precum și orice fel de funcții de demnitate publică.
(2) Medicii pentru care, în timpul mandatului de membru al organelor de conducere, a survenit situația de incompatibilitate sunt suspendați din funcție. Suspendarea durează până la încetarea situației de incompatibilitate sau până la expirarea mandatului.
(3) Numărul de mandate în organele de conducere de la nivel teritorial și național este de maximum doua, care pot fi și consecutive.
(4) Dispozițiile alin. (1)-(3) nu se aplică persoanelor care la data intrării în vigoare a prezentei legi îndeplinesc, în baza reglementărilor aflate în vigoare anterior, vreuna dintre funcțiile menționate până la expirarea mandatului pentru care au fost alese.
Secţiunea a 6-a - Răspunderea disciplinară
Art. 442 - (1) Medicul răspunde disciplinar pentru nerespectarea legilor și regulamentelor profesiei medicale, a Codului de deontologie medicală și a regulilor de buna practica profesională, a Statutului Colegiului Medicilor din România, pentru nerespectarea deciziilor obligatorii adoptate de organele de conducere ale Colegiului Medicilor din România, precum și pentru orice fapte săvârșite în legătură cu profesia, care sunt de natura sa prejudicieze onoarea și prestigiul profesiei sau ale Colegiului Medicilor din România.
(2) Răspunderea disciplinară a membrilor Colegiului Medicilor din România, potrivit prezentei legi, nu exclude răspunderea penală, contravențională sau civilă, conform prevederilor legale.
Art. 443 - (1) Plângerea împotriva unui medic se depune la colegiul al cărui membru este medicul. În cazul medicilor cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, plângerea se depune la colegiul în a cărui raza medicul își desfășoară activitatea.
(2) Biroul executiv al Consiliului național dispune trimiterea dosarului disciplinar la comisia de disciplina.
(3) Împotriva deciziei de respingere a plângerii persoana care a făcut plângerea poate depune contestație la colegiul a cărui decizie se contesta. Aceasta se soluționează de către Biroul executiv al Consiliului național.
(4) Plângerile împotriva unui membru al organelor de conducere de la nivel teritorial sau național se înaintează Comisiei superioare de disciplina.
Art. 444 - (1) În cadrul fiecărui colegiu teritorial se organizează și funcționează comisia de disciplina, independenta de conducerea colegiului, care judeca în complete de 3 membri abaterile disciplinare săvârșite de medicii înscriși în acel colegiu.
(2) La nivelul Colegiului Medicilor din România se organizează și funcționează Comisia superioară de disciplina, independenta de conducerea colegiului, care judeca în complete de 5 membri contestațiile formulate împotriva deciziilor comisiilor de disciplina teritoriale.
(3) Unul dintre membrii comisiilor de disciplina este desemnat de autoritățile de sănătate publică, la nivel teritorial, și de Ministerul Sănătății Publice, la nivelul Comisiei superioare de disciplina.
(4) Procedura judecării abaterilor este prevăzută în Statutul Colegiului Medicilor din România.
Art. 445 - (1) Membrii comisiilor de disciplina de la nivelul colegiului teritorial sunt aleși de adunarea generală a colegiului, iar membrii Comisiei superioare de disciplina vor fi aleși de Adunarea generală naționala.
(2) Membrii comisiilor de disciplina vor fi aleși din rândul medicilor primari cu o vechime în profesie de peste 7 ani și care nu au avut abateri disciplinare în ultimii 5 ani.
(3) Funcția de membru al comisiei de disciplina este incompatibilă cu orice alta funcție în cadrul Colegiului Medicilor din România.
(4) Durata mandatului membrilor comisiilor de disciplina este de 6 ani.
(5) Calitatea de membru al comisiilor de disciplina încetează prin deces, demisie, pierderea calității de membru al Colegiului Medicilor din România ori prin numirea unui alt reprezentant în cazul membrilor desemnați de către Ministerul Sănătății Publice sau autoritatea de sănătate publică.
Art. 446 - (1) Membrii comisiilor de disciplina se aleg prin vot secret și pe baza candidaturilor depuse.
(2) La nivel teritorial se va alege un număr de 5-9 membri, iar la nivel național, 13.
(3) Membrii comisiilor de disciplina își vor alege un președinte care conduce activitatea administrativă a comisiilor de disciplina.
(4) Președintele comisiei de disciplina prezintă adunării generale raportul anual al activității comisiei de disciplina.
Art. 447 - (1) Sancțiunile disciplinare sunt:
a) mustrare;
b) avertisment;
c) vot de blam;
d) amenda de la 100 lei (RON) la 1.500 lei (RON).
Plata amenzii se va face în termen de 30 de zile de la data rămânerii definitive a hotărârii disciplinare. Neachitarea în acest termen atrage suspendarea de drept din exercițiul profesiei, până la achitarea sumei. Sumele provenite din plata amenzilor se fac venit integral la bugetul Colegiului Medicilor din România;
e) interdicția de a exercita profesia ori anumite activități medicale pe o perioadă de la o luna la un an;
f) retragerea calității de membru al Colegiului Medicilor din România.
(2) Retragerea calității de membru al Colegiului Medicilor din România operează de drept pe durata stabilită prin hotărâre definitivă de instanțele judecătorești cu privire la interzicerea exercitării profesiei.
(3) La sancțiunile prevăzute la alin. (1) se poate prevedea, după caz, obligarea celui sancționat la efectuarea unor cursuri de perfecționare sau de educație medicală ori alte forme de pregătire profesională.
Art. 448 - (1) Decizia pronunțată se comunică medicului sancționat și Biroului executiv al Colegiului Medicilor din România.
(2) Deciziile privind aplicarea sancțiunilor care se soldeaza cu suspendarea sau interzicerea exercitării profesiei se comunică și Ministerului Sănătății Publice și, respectiv, angajatorului.
(3) Persoana fizica sau juridică care a făcut sesizarea va fi informată cu privire la soluționarea cauzei de către comisia de disciplina.
(4) În termen de 15 zile de la comunicare, medicul sancționat, persoana care a făcut sesizarea, Ministerul Sănătății Publice, președintele colegiului teritorial sau președintele Colegiului Medicilor din România poate contesta decizia pronunțată de comisia de disciplina a colegiului teritorial.
Art. 449 - (1) Acțiunea disciplinară poate fi pornită în termen de cel mult 6 luni de la data săvârșirii faptei sau de la data cunoașterii consecințelor prejudiciabile.
(2) Sancțiunile prevăzute la art. 447 alin. (1) lit. a)-d) se radiază în termen de 6 luni de la data executării lor, iar cea prevăzută la lit. e), în termen de un an de la data expirării perioadei de interdicție.
(3) În cazul aplicării sancțiunii prevăzute la art. 447 alin. (1) lit. f), medicul poate face o noua cerere de redobandire a calității de membru al colegiului după expirarea perioadei stabilite prin hotărâre judecătorească definitivă de interdicție a exercitării profesiei sau după 2 ani de la data aplicării sancțiunii de către comisiile de disciplina. Redobandirea calității de membru al Colegiului Medicilor din România se face în condițiile prezentei legi.
(4) În situația în care, prin decizia comisiei de disciplina, au fost dispuse și măsurile prevăzute la art. 447 alin. (3), radierea sancțiunii se va face numai după prezentarea dovezii ducerii la îndeplinire a măsurii dispuse de comisia de disciplina.
(5) Repetarea unei abateri disciplinare până la radierea sancțiunii aplicate constituie o circumstanță agravantă, care va fi avută în vedere la aplicarea noii sancțiuni.
Art. 450 - (1) Ancheta disciplinară se exercită prin persoane desemnate în acest scop de către biroul consiliului colegiului teritorial sau, după caz, de către Biroul executiv al Colegiului Medicilor din România.
(2) Unitățile sanitare sau cele de medicina legală au obligația de a pune la dispoziție comisiilor de disciplina sau persoanelor desemnate cu investigarea abaterilor disciplinare documentele medicale solicitate, precum și orice alte date și informații necesare soluționării cauzei.
Art. 451 - Împotriva deciziei de sancționare a Comisiei superioare de disciplina, în termen de 15 zile de la comunicare, medicul sancționat poate formula o acțiune în anulare la secția de contencios administrativ a tribunalului în a cărui raza își desfășoară activitatea.
Secţiunea a 7-a - Venituri și cheltuieli
Art. 452 - Veniturile Colegiului Medicilor din România se constituie din:
a) taxa de înscriere;
b) cotizațiile lunare ale membrilor;
c) contravaloarea serviciilor prestate membrilor sau persoanelor fizice și juridice, inclusiv din organizarea de cursuri și alte forme de educație medicală continua;
d) donații și sponsorizări de la persoane fizice și juridice;
e) legate;
f) drepturi editoriale;
g) încasări din vânzarea publicațiilor proprii;
h) fonduri rezultate din manifestările culturale și științifice;
i) alte surse.
Art. 453 - (1) Cotizațiile datorate și neplătite în termenul fixat de consiliul colegiului teritorial de către membrii Colegiului Medicilor din România determina plata unor majorări de întârziere în cuantumul prevăzut de dispozițiile legale aplicabile instituțiilor publice.
(2) Aceeași penalitate se va aplica și colegiilor teritoriale care nu vărsa partea de cotizatie datorată.
Art. 454 - (1) Neplata cotizatiei datorate de membrii Colegiului Medicilor din România pe o perioadă de 6 luni și după atenționarea scrisă a consiliului colegiului teritorial se sancționează cu suspendarea calității de membru până la plata cotizatiei datorate.
(2) Sancțiunea se aplică de către comisia de disciplina a colegiului teritorial, la sesizarea comisiei administrative și financiar-contabile a colegiului teritorial.
Art. 455 - Pentru serviciile prestate persoanelor care nu sunt membre ale Colegiului Medicilor din România, tarifele se stabilesc, după caz, de Consiliul național, respectiv de consiliul colegiului teritorial.
Art. 456 - Veniturile pot fi utilizate pentru cheltuieli cu organizarea și funcționarea, cheltuieli de personal, cheltuieli materiale și servicii, cheltuieli de capital, perfecționarea pregătirii profesionale, acordarea de burse prin concurs medicilor, intrajutorarea medicilor cu venituri mici, crearea de instituții cu scop filantropic și științific, acordarea de premii pentru membrii cu activități profesionale deosebite, alte cheltuieli aprobate, după caz, de consiliul colegiului teritorial, respectiv de Consiliul național al Colegiului Medicilor din România.
Capitolul IV - Rolul, atribuțiile și drepturile autorității de stat
Art. 457 - Ministerul Sănătății Publice, în calitate de autoritate de stat, urmărește ca activitatea Colegiului Medicilor din România să se desfășoare în condițiile legii.
Art. 458 - Reprezentantul autorității de stat cu rangul de secretar de stat în Ministerul Sănătății Publice este membru al Consiliului național al Colegiului Medicilor din România și este numit prin ordin al ministrului sănătății publice.
Art. 459 - În cazul în care reprezentantul autorității de stat constata că nu sunt respectate prevederile legale, acesta sesizează organele de conducere ale Colegiului Medicilor din România. În termen de 15 zile de la efectuarea demersului, acestea adopta măsurile necesare de încadrare în normele în vigoare și informează Ministerul Sănătății Publice în acest sens.
Art. 460 - În cazul nerespectării prevederilor art. 459, Ministerul Sănătății Publice se adresează instanțelor judecătorești competente.
Capitolul V - Dispoziții tranzitorii și finale
Art. 461 - În vederea facilitării accesului la exercițiul profesiei de medic pe teritoriul României, Ministerul Sănătății Publice în colaborare cu Colegiul Medicilor din România recunoaște calificarile de medic dobândite în conformitate cu normele Uniunii Europene într-un stat membru al Uniunii Europene, într-un stat aparținând Spațiului Economic European sau în Confederatia Elvetiana de cetățenii acestor state, iar încadrarea în munca se face conform legii.
Art. 462 - (1) Normele privind recunoașterea diplomelor, certificatelor și titlurilor de medic, eliberate de un stat membru al Uniunii Europene, de un stat aparținând Spațiului Economic European și de Confederatia Elvetiana cetățenilor acestora, se elaborează de Ministerul Sănătății Publice în colaborare cu Colegiul Medicilor din România și se aproba prin hotărâre a Guvernului.
(2) Nomenclatorul de specialități medicale, medico-dentare și farmaceutice pentru rețeaua de asistența medicală se elaborează de Ministerul Sănătății Publice și se aproba prin ordin al ministrului sănătății publice.
(3) Normele privind întocmirea, emiterea și utilizarea dovezilor de onorabilitate și moralitate profesională ale medicilor se elaborează în colaborare de autoritățile competente române definite de prezenta lege și se aproba prin hotărâre a Guvernului.
Art. 463 - (1) Atribuțiile Colegiului Medicilor din România nu pot fi exercitate de nici o alta asociație profesională.
(2) Colegiul Medicilor din România nu se poate substitui organizațiilor patronale sau sindicale și în îndeplinirea atribuțiilor sale nu poate face uz de prerogativele acestora prevăzute de lege.
(3) Membrii Colegiului Medicilor din România pot face parte și din alte asociații profesionale.
Art. 464 - Statutul Colegiului Medicilor din România, Codul de deontologie medicală, cu modificările și completările ulterioare, precum și deciziile Consiliului național care privesc organizarea și funcționarea Colegiului Medicilor din România sau drepturile și obligațiile acestora ca membri ai Colegiului Medicilor din România se publică în Monitorul Oficial al României, Partea I.
Art. 465 - Pe durata exercitării profesiei în regim salarial sau/și independent medicul este obligat sa încheie o asigurare de răspundere civilă pentru greșeli în activitatea profesională.
Art. 466 - (1) Medicii care ocupa funcții publice în cadrul aparatului central al Ministerului Sănătății Publice, în cadrul autorităților de sănătate publică județene și a municipiului București, în cadrul Casei Naționale de Asigurări de Sănătate și, respectiv, în cadrul caselor de asigurări de sănătate județene și a municipiului București, precum și cei din cadrul ministerelor sau instituțiilor centrale cu rețele sanitare proprii pot desfășura în afară programului normal de lucru, în condițiile legii, activități profesionale, potrivit calificării pe care o dețin. Prevederile se aplică, cu respectarea reglementărilor legale referitoare la conflictul de interese și incompatibilități stabilite pentru sistemul sanitar, iar activitățile profesionale se desfășoară exclusiv în unități sanitare private.
(2) Medicilor prevăzuți la alin. (1) li se aplică în mod corespunzător prevederile art. 35 alin. (1) și (3) din Legea nr. 53/2003 – Codul muncii, cu modificările și completările ulterioare.
Art. 467 - La data intrării în vigoare a prezentului titlu se abroga Legea nr. 306/2004 privind exercitarea profesiei de medic, precum și organizarea și funcționarea Colegiului Medicilor din România, publicată în Monitorul Oficial al României, Partea I, nr. 578 din 30 iunie 2004, cu modificările și completările ulterioare, precum și orice alte dispoziții contrare.
Prezentul titlu transpune integral prevederile referitoare la exercițiul profesiei de medic cuprinse în:
– Directiva Consiliului nr. 93/16 din 5 aprilie 1993 privind facilitarea liberei circulatii a medicilor și recunoașterea reciprocă a diplomelor, certificatelor și a altor titluri de medic, cu modificările și completările ulterioare, publicată în Jurnalul Oficial al Comunităților Europene (JOCE) nr. 165 din 7 iulie 1993, p. 1;
– art. 5 alin. (1) lit. a), alin. (2) și (3), art. 6, art. 7 alin. (1), alin. (2) lit. a)-c) și alin. (3), art. 8, art. 50 alin. (1) și (4), art. 51, art. 52 alin. (1), art. 53, 54 și art. 56 alin. (1) și (2) din Directiva 2005/36/CE din 7 septembrie 2005 privind recunoașterea calificarilor profesionale, publicată în Jurnalul Oficial al Comunităților Europene (JOCE) nr. L 255 din 30 septembrie 2005;
– art. 11 din Regulamentul Consiliului nr. 1.612/68CEE din 15 octombrie 1968 privind libera circulație a lucrătorilor în interiorul Comunității Europene, publicat în Jurnalul Oficial al Comunităților Europene (JOCE) nr. L 257 din 19 octombrie 1968;
– Directiva Consiliului 2003/109/CE din 25 noiembrie 2003 privind statutul cetățenilor din statele terțe care sunt rezidenți pe termen lung, publicat în Jurnalul Oficial al Comunităților Europene (JOCE) nr. L 16 din 23 ianuarie 2004.
Capitolul I - Exercitarea profesiei de medic dentist
Secţiunea 1 - Dispoziții generale
Art. 468 - Prevederile prezentului titlu se aplică activităților de medic dentist exercitate în România în regim salarial și/sau independent.
Art. 469 - Profesia de medic dentist se exercită, pe teritoriul României, în condițiile prezentei legi, de către persoanele fizice posesoare ale unui titlu oficial de calificare în medicina dentara, după cum urmează:
a) cetățeni ai statului român;
b) cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene;
c) soțul unui cetățean român, precum și descedentii și ascendenții în linie directa aflați în întreținerea unui cetățean român, indiferent de cetățenia acestora;
d) membrii de familie ai unui cetățean al unuia dintre statele prevăzute la lit. b), asa cum sunt definiți la art. 2 alin. (1) pct. 3 din Ordonanța de urgenta a Guvernului nr. 102/2005 privind libera circulație pe teritoriul României a cetățenilor statelor membre ale Uniunii Europene și Spațiului Economic European, aprobată cu modificări prin Legea nr. 260/2005;
e) cetățenii statelor terțe beneficiari ai statutului de rezident permanent în România;
f) beneficiari ai statutului de rezident pe termen lung acordat de unul dintre statele prevăzute la lit. b).
Art. 470 - (1) În sensul prezentului titlu, expresiile folosite au următoarele semnificatii:
a) medici dentisti, cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene – persoanele prevăzute la art. 469 lit. b) și, prin asimilare, medicii dentisti aflați în situațiile prevăzute la art. 469 lit. d) și f);
b) stat membru de origine sau de proveniență, stat membru de stabilire sau, după caz, stat membru gazda – un stat membru al Uniunii Europene, un stat aparținând Spațiului Economic European sau Confederatia Elvetiana;
(2) Prin titlu oficial de calificare în medicina dentara se înțelege:
a) diploma de medic stomatolog sau diploma de medic dentist, eliberate de o instituție de învățământ superior din domeniul medicinei dentare, acreditata din România;
b) certificatul de specialist în ortodontie și ortopedie dento-faciala, precum și certificatul de specialist în chirurgie dento-alveolara, eliberate de Ministerul Sănătății Publice;
c) diploma, certificatul sau un alt titlu în medicina dentara, eliberate conform normelor Uniunii Europene de statele membre ale Uniunii Europene, statele aparținând Spațiului Economic European sau de Confederatia Elvetiana;
d) diploma, certificatul sau un alt titlu în medicina dentara, dobândite într-un stat terț și recunoscute de unul dintre statele membre enumerate la lit. c) ori echivalate de România.
Art. 471 - (1) Titlurile oficiale de calificare în medicina dentara obținute în afară României, a statelor membre ale Uniunii Europene, a statelor aparținând Spațiului Economic European sau a Confederatiei Elvetiene se echivaleaza potrivit legii.
(2) Excepție de la prevederile alin. (1) fac titlurile oficiale de calificare în medicina dentara care au fost recunoscute de unul dintre aceste state.
Art. 472 - (1) Profesia de medic dentist are ca scop asigurarea sănătății publice și a individului prin activități de preventie, diagnostic și tratament ale maladiilor și anomaliilor oro-dento-maxilare și ale tesuturilor adiacente, desfășurate cu respectarea prevederilor Codului deontologic al medicului dentist.
(2) Natura acestor activități încadrează profesia de medic dentist în rândul profesiilor din sectorul sanitar cu risc crescut de biocontaminare, beneficiind de toate facilitățile acordate de legislația în vigoare.
(3) Caracterul specific al activităților exercitate în baza titlurilor oficiale de calificare în medicina dentara, prevăzute de lege, individualizează, distinge și separa profesia de medic dentist de profesia de medic.
Art. 473 - (1) În exercitarea profesiei medicul dentist trebuie să dovedească disponibilitate, corectitudine, devotament și respect față de fiinta umană. Independenta profesională conferă medicului dentist dreptul de inițiativa și decizie în exercitarea actului medico-dentar și deplina răspundere a acestuia.
(2) Medicul dentist nu este funcționar public în timpul exercitării profesiei, prin natura umanitara și liberala a acesteia.
Art. 474 - (1) Profesia de medic dentist, indiferent de forma de exercitare, salariata și/sau independenta, se exercită numai de către medicii dentisti membri ai Colegiului Medicilor Dentisti din România.
(2) În vederea accesului la una dintre activitățile de medic dentist și exercițiului acesteia, medicii dentisti cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, stabiliți în unul dintre aceste state, sunt exceptați, în caz de prestare temporară sau ocazionala de servicii medico-dentare, de la obligativitatea înscrierii în Colegiul Medicilor Dentisti din România.
Art. 475 - (1) La primirea ca membru în Colegiul Medicilor Dentisti din România medicul dentist va depune următorul jurământ:
„Odată admis printre membrii profesiei de medic dentist:
Ma angajez solemn să-mi consacru viața în slujba umanității;
Voi păstra profesorilor mei respectul și recunoștință care le sunt datorate;
Voi exercita profesia cu constiinta și demnitate;
Sănătatea pacientilor va fi pentru mine obligație sacră;
Voi păstra secretele încredințate de pacienti, chiar și după decesul acestora;
Voi menține prin toate mijloacele onoarea și nobila tradiție a profesiei de medic dentist;
Colegii mei vor fi frații mei;
Nu voi îngădui să se interpuna între datoria mea și pacient consideratii de naționalitate, rasa, religie, partid sau stare socială;
Voi păstra respectul deplin pentru viața umană de la inceputurile sale, chiar sub amenințare, și nu voi utiliza cunoștințele mele profesionale contrar legilor umanității.
Fac acest jurământ în mod solemn, liber, pe onoare!”
(2) Prevederile alin. (1) se aplică și:
a) medicilor dentisti cetățeni români stabiliți în străinătate și care doresc sa exercite profesia în România;
b) medicilor dentisti cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, stabiliți în România și care doresc sa profeseze;
c) medicilor dentisti cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, stabiliți în unul dintre aceste state și care solicită intrarea în profesie în România;
d) medicilor dentisti care întrunesc condițiile prevăzute la art. 469 lit. c) și e).
(3) Medicii dentisti prevăzuți la alin. (2) lit. b) și c) pot depune jurământul în limba română sau în una dintre limbile de circulație în Uniunea Europeană.
Art. 476 - (1) Profesia de medic dentist se exercită pe teritoriul României de persoanele prevăzute la art. 469 care îndeplinesc următoarele condiții:
a) dețin un titlu oficial de calificare în medicina dentara prevăzut de prezenta lege;
b) nu se găsesc în vreunul dintre cazurile de nedemnitate sau incompatibilitate prevăzute de prezenta lege;
c) sunt apți din punct de vedere medical pentru exercitarea profesiei de medic dentist;
d) sunt membri ai Colegiului Medicilor Dentisti din România;
e) prin excepție de la lit. d), în caz de prestare temporară sau ocazionala de servicii, medicii dentisti care întrunesc condițiile prevăzute la art. 469 lit. b), d) și f) trebuie să înștiințeze Ministerul Sănătății Publice cu privire la prestarea temporară sau ocazionala de servicii medico-dentare pe teritoriul României și să fie înregistrați pe această perioadă la Colegiul Medicilor Dentisti din România.
(2) Medicii dentisti cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, stabiliți pe teritoriul României, precum și medicii dentisti care întrunesc condițiile prevăzute la art. 469 lit. c) și e) exercita profesia de medic dentist cu aceleași drepturi și obligații ca și medicii dentisti cetățeni români membri ai Colegiului Medicilor Dentisti din România.
Art. 477 - (1) Profesia de medic dentist se exercită în România cu titlul profesional corespunzător calificării profesionale însușite, după cum urmează:
a) medic dentist;
b) specialist în ortodontie și ortopedie dento-faciala;
c) specialist în chirurgia dento-alveolara.
(2) Prevederile alin. (1) se aplică și cetățenilor unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene care dețin un titlu oficial de calificare în medicina dentara și care exercită profesia în România.
(3) Medicii dentisti care întrunesc condițiile prevăzute la art. 469 și la art. 476 alin. (1) lit. a)-d) pot desfășura activități medico-dentare conform pregătirii profesionale în sistemul național de asigurări de sănătate sau/și în sistemul privat, fie ca angajați, fie ca persoana fizica independenta în formele prevăzute de lege.
Art. 478 - Controlul și supravegherea profesiei de medic dentist se realizează de Ministerul Sănătății Publice și de Colegiul Medicilor Dentisti din România, denumite în continuare autorități competente române.
Art. 479 - (1) În cazul în care un medic dentist își întrerupe activitatea profesională sau se afla într-o situație de incompatibilitate pe o perioadă mai mare de 5 ani, Colegiul Medicilor Dentisti din România va reatesta competența profesională a acestuia în vederea reluării activității medico-dentare.(2) Procedura privind modalitățile și condițiile de verificare și atestare a nivelului profesional se stabilește de Consiliul național al Colegiului Medicilor Dentisti din România, conform Codului deontologic al medicului dentist și Regulamentului de organizare și funcționare al Colegiului Medicilor Dentisti din România.
(3) Prevederile alin. (1) se aplică și medicilor dentisti cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene stabiliți pe teritoriul României.
Art. 480 - (1) Practicarea profesiei de medic dentist de către o persoană care nu are aceasta calitate constituie infracțiune și se pedepsește conform Codului penal.
(2) Colegiul Medicilor Dentisti din România, prin președintele colegiului teritorial sau al Consiliului național al Colegiului Medicilor Dentisti din România, este în drept sa exercite acțiunea civilă sau sa sesizeze, după caz, organele judiciare și autoritățile competente pentru urmărirea și trimiterea în judecata a persoanelor care își atribuie sau care întrebuințează fără drept titlul ori calitatea de medic dentist sau care practica în mod ilegal medicina dentara.
(3) Acțiunea penală împotriva unui membru al Colegiului Medicilor Dentisti din România cu privire la fapte ce au legătură cu exercitarea profesiei de medic dentist se pune în mișcare cu înștiințarea prealabilă a colegiului teritorial al cărui membru este medicul dentist respectiv și a Biroului executiv național.
Secţiunea a 2-a - Nedemnitati și incompatibilități
Art. 481 - Este nedemn de a exercita profesia de medic dentist:
a) medicul dentist care a fost condamnat definitiv pentru săvârșirea cu intenție a unei infracțiuni contra umanității sau vieții în împrejurări legate de exercitarea profesiei de medic dentist și pentru care nu a intervenit reabilitarea;
b) medicul dentist căruia i s-a aplicat pedeapsa interdicției de a exercita profesia, pe durata stabilită, prin hotărâre judecătorească sau disciplinară.
Art. 482 - (1) Exercitarea profesiei de medic dentist este incompatibilă cu:
a) calitatea de angajat sau colaborator al unităților de producție ori distribuție de produse farmaceutice, materiale sanitare sau materiale de tehnica dentara;
b) exercitarea în calitate de medic dentist, în mod nemijlocit, de acte și fapte de comerț;
c) orice ocupație de natura a aduce atingere demnității profesionale de medic dentist sau bunelor moravuri;
d) starea de sănătate fizica sau psihică necorepunzatoare pentru exercitarea acestei profesii, atestata ca atare prin certificat medical eliberat de comisia de expertiza medicală și recuperare a capacității de muncă;
e) folosirea cu buna știința a cunoștințelor medico-dentare în defavoarea sănătății pacientului sau în scop criminal.
(2) Excepție de la prevederile alin. (1) lit. b) fac activitățile de preventie de medicina dentara.
(3) La solicitarea medicului dentist în cauza sau la sesizarea oricărei persoane sau autorități/instituții interesate, președintele colegiului din care face parte medicul dentist respectiv poate constitui o comisie, special instituită pentru fiecare caz în parte, alcătuită din 3 medici dentisti primari, pentru a confirma sau infirma situația de incompatibilitate prevăzută la alin. (1) lit. a)-c) sau e). În cazurile prevăzute la alin. (1) lit. d) acesta poate solicita organelor în drept confirmarea sau infirmarea stării de incompatibilitate.
(4) Pe timpul stării de incompatibilitate se suspenda dreptul de exercitare a profesiei.
(5) În termen de 10 zile de la apariția situației de incompatibilitate, medicul dentist este obligat sa anunțe colegiul teritorial al cărui membru este.
Secţiunea a 3-a - Autorizarea exercitării profesiei de medic dentist
Art. 483 - (1) Medicii dentisti care întrunesc condițiile prevăzute la art. 469 exercita profesia pe baza certificatului de membru al Colegiului Medicilor Dentisti din România, avizat anual pe baza asigurării de răspundere civilă, pentru greșeli în activitatea profesională, valabilă pentru anul respectiv.
(2) În caz de prestare temporară sau ocazionala de servicii medico-dentare pe teritoriul României, medicii dentisti cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, stabiliți în unul dintre aceste state, sunt exceptați de la obligativitatea obținerii certificatului de membru al Colegiului Medicilor Dentisti din România. Accesul la activitățile de medic dentist pe durata prestării serviciilor se face conform prevederilor art. 492.
(3) Certificatul de membru al Colegiului Medicilor Dentisti din România se acordă pe baza următoarelor acte:
a) documentele care atesta formarea în profesie;
b) certificatul de sănătate;
c) declarația pe propria răspundere privind îndeplinirea condițiilor prevăzute la art. 481 și 482;
d) certificatul de cazier judiciar.
(4) Certificatul de membru devine operativ numai după încheierea asigurării de răspundere civilă.
Art. 484 - (1) Medicii se pensionează la vârsta prevăzută de lege.
(2) În unitățile sanitare publice, medicii membri titulari și corespondenti ai Academiei Române, profesori universitari, cercetători științifici gradul I, doctori în științe medicale care desfășoară activități medico-dentare pot continua, la cerere, activitatea până la împlinirea vârstei de 70 de ani.
(3) Medicii dentisti care au depășit limita de vârsta prevăzută la alin. (1) pot profesa în continuare în unități sanitare private. Desfășurarea activității se face în baza certificatului de membru și a avizului anual al Colegiului Medicilor Dentisti din România eliberat pe baza certificatului de sănătate și a asigurării privind răspunderea civilă pentru greșeli în activitatea profesională, încheiată pentru anul respectiv.
(4) Medicii dentisti deținuți sau internati din motive politice, aflați în situațiile prevăzute la art. 1 alin. (1) și (2) din Decretul-lege nr. 118/1990 privind acordarea unor drepturi persoanelor persecutate din motive politice de dictatura instaurată cu începere de la 6 martie 1945, precum și a celor deportate în străinătate ori constituite în prizonieri, republicat, cu modificările și completările ulterioare, pot fi mentinuti, la cerere, în activitatea profesională, pe baza certificatului anual de sănătate. Aceste prevederi se aplică și medicilor dentisti care, din motive politice, au fost obligați să își intrerupa studiile o anumită perioada, obtinandu-și licenta cu întârziere, ori celor care au fost împiedicați să își reia activitatea profesională.
(5) În cazul unităților sanitare publice care înregistrează deficit de personal medico-dentar, precum și al unităților sanitare publice aflate în zone defavorizate, medicii dentisti își pot continua activitatea peste vârsta de pensionare prevăzută de lege. Criteriile de menținere în activitate în aceste situații se stabilesc prin norme aprobate prin hotărâre a Guvernului.
(6) Medicii dentisti care au împlinit vârsta de pensionare prevăzută de lege nu pot deține funcții de conducere în cadrul Ministerului Sănătății Publice, ministerelor și instituțiilor centrale cu rețea sanitară proprie, autorităților de sănătate publică, Casei Naționale de Asigurări de Sănătate, caselor județene de asigurări de sănătate și a municipiului București, precum și în cadrul spitalelor publice și oricărei alte unități sanitare publice.
Capitolul II - Dispoziții privind exercitarea profesiei de medic dentist în România de către medicii dentisti cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene
Secţiunea 1 - Dispoziții privind facilitarea dreptului de stabilire
Art. 485 - (1) În caz de stabilire pe teritoriul României, solicitarile medicilor dentisti cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene cu privire la accesul la una dintre activitățile prevăzute la art. 472 se soluționează de Ministerul Sănătății Publice, în colaborare cu Colegiul Medicilor Dentisti din România, în termen de 3 luni de la depunerea dosarului complet de către cel interesat. Aceștia primesc certificatul de membru al Colegiului Medicilor Dentisti din România în urma aplicării procedurii de recunoaștere a calificării profesionale.
(2) Dosarul prevăzut la alin. (1) cuprinde:
a) copia documentului de cetățenie;
b) copia documentelor care atesta formarea în profesie;
c) certificatul emis de autoritățile competente ale statului membru de origine sau de proveniență prin care se atesta ca titlurile oficiale de calificare sunt cele prevăzute de Directiva 2005/36CE;
d) certificatul de sănătate fizica și psihică emis de statul membru de origine sau de proveniență;
e) dovada emisă de statul membru de origine sau de proveniență, prin care se atesta onorabilitatea și moralitatea posesorului;
f) dovada de asigurare privind răspunderea civilă pentru greșeli în activitatea profesională, emisă de instituțiile abilitate din unul dintre statele membre prevăzute la alin. (1).
(3) Documentele prevăzute la alin. (2) lit. d)-f) sunt valabile 3 luni de la data emiterii.
(4) În situația în care pentru accesul și exercițiul activității prevăzute la alin. (1) statul membru de origine sau proveniență nu impune o astfel de cerința și, în consecința, nu emite cetățenilor săi documentul prevăzut la alin. (2) lit. d), autoritățile competente române accepta din partea acestuia un atestat echivalent certificatului de sănătate.
(5) În cazul în care statul membru de origine sau de proveniență nu impune o astfel de cerința și, în consecința, nu emite cetățenilor săi documentul prevăzut la alin. (2) lit. e), autoritățile competente române accepta atestatul eliberat pe baza declarației sub jurământ sau a declarației solemne a solicitantului de către autoritatea judiciară sau administrativă competența sau, după caz, de notarul sau organizația profesională abilitata în acest sens de acel stat.
Art. 486 - (1) În termen de 30 de zile de la primirea dosarului, Ministerul Sănătății Publice informează solicitantul asupra documentelor necesare completării acestuia.
(2) Deciziile autorităților competente române în aceste cazuri pot fi atacate la instanța de contencios administrativ.
Art. 487 - (1) Atunci când autoritățile competente române au cunoștința de fapte grave și precise care pot avea repercusiuni asupra începerii activității profesionale sau asupra exercitării profesiei de medic dentist în România, comise de medicii dentisti cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, anterior stabilirii în România și în afară teritoriului sau, acestea informează statul membru de origine sau de proveniență al celor în cauza.
(2) Autoritățile competente române comunică statului membru gazda informațiile solicitate cu privire la sancțiunile disciplinare de natura profesională sau administrativă, precum și cu privire la sancțiunile penale interesand exercițiul profesiei de medic dentist, aplicate medicilor dentisti pe durata exercitării profesiei în România.
(3) Autoritățile competente române analizează informațiile transmise de statul membru gazda cu privire la faptele grave și precise comise de medicii dentisti cetățeni români sau care provin din România, anterior stabilirii în statul membru gazda și în afară teritoriului sau, fapte care pot avea repercusiuni asupra începerii activității profesionale sau asupra exercitării profesiei de medic dentist în acel stat.
(4) Autoritățile competente române decid asupra naturii și amplorii investigatiilor pe care le întreprind în situațiile pentru care au fost sesizate și comunică statului membru gazda consecințele care rezultă cu privire la atestatele și documentele pe care le-au emis în cazurile respective.
Secţiunea a 2-a - Dispoziții cu privire la libera prestare a serviciilor medico-dentare
Art. 488 - (1) Prezentele dispoziții se aplică medicilor dentisti cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, care sunt stabiliți în vederea exercitării profesiei în unul dintre aceste state, atunci când se deplaseaza pe teritoriul României pentru a exercita în regim temporar și ocazional activitățile de medic dentist.
(2) Caracterul temporar și ocazional al prestării activităților medico-dentare este stabilit, de la caz la caz, de Ministerul Sănătății Publice în funcție de durata, frecventa, periodicitatea și continuitatea acestora.
Art. 489 - (1) Medicii dentisti cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, stabiliți în unul dintre aceste state, sunt exceptați de la obligația înscrierii în Colegiul Medicilor Dentisti din România, precum și de la plata cotizatiei de membru, atunci când solicita accesul la una dintre activitățile de medic dentist în vederea prestării temporare sau ocazionale de servicii medico-dentare în România.
(2) Aceștia sunt înregistrați automat la Colegiul Medicilor Dentisti din România pe durata prestării serviciilor respective, în baza copiei documentelor prestatorului prevăzute la art. 492 și transmise în acest scop de Ministerul Sănătății Publice.
(3) Exercițiul activităților de medic dentist, în aceste situații, se face în concordanta cu celelalte drepturi și obligații prevăzute de lege pentru medicii dentisti cetățeni români membri ai Colegiului Medicilor Dentisti din România.
Art. 490 - Pe durata prestării cu caracter temporar sau ocazional a serviciilor medico-dentare pe teritoriul României, persoanele prevăzute la art. 489 alin. (1) se supun dispozițiilor cu caracter profesional, regulamentar sau administrativ al calificarilor profesionale care definesc profesia și utilizarea titlurilor, dispozițiilor cu privire la faptele profesionale grave care afectează direct și specific protecția și securitatea consumatorilor, precum și dispozițiilor disciplinare prevăzute de lege pentru medicii dentisti cetățeni români membri ai Colegiului Medicilor Dentisti din România.
Art. 491 - Prestarea cu caracter temporar sau ocazional a serviciilor medico-dentare pe teritoriul României de către persoanele prevăzute la art. 489 alin. (1) se face cu titlul profesional prevăzut de lege pentru calificarea profesională însușită.
Art. 492 - (1) Solicitarile medicilor dentisti cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, stabiliți în unul dintre aceste state, cu privire la prestarea temporară sau ocazionala de servicii medico-dentare în România, se soluționează de Ministerul Sănătății Publice în colaborare cu Colegiul Medicilor Dentisti din România.
(2) În cazul în care, în scopul prestării temporare de servicii medico-dentare, solicitantul se afla la prima deplasare în România sau în cazul în care în situația acestuia intervin schimbări materiale atestate de documente, acesta va inainta Ministerului Sănătății Publice:
a) o declarație prealabilă scrisă, în care se precizează durata de prestare, natura, locul de desfășurare a acestor activități, precum și domeniul de asigurare sau alte mijloace de protecție personală sau colectivă privind responsabilitatea profesională de care solicitantul beneficiază în statul membru de stabilire;
b) copia documentului de cetățenie;
c) o dovadă prin care autoritățile competente ale statului membru de stabilire atesta ca la data eliberării acestui document posesorul este stabilit legal pe teritoriul sau în vederea exercitării activităților de medic dentist și nu i-a fost interzisă exercitarea acestora, nici chiar cu titlu temporar;
d) diplomele, certificatele sau alte titluri de medic dentist prevăzute de lege sau de normele Uniunii Europene pentru prestarea activităților în cauza.
(3) Declarația prevăzută la alin. (2) lit. a) poate fi înaintată prin toate mijloacele și se reînnoiește o dată pe an, dacă prestatorul intenționează sa furnizeze, de maniera temporară sau ocazionala, în cursul anului respectiv, servicii medico-dentare în România.
Art. 493 - (1) În caz de prestare temporară a serviciilor, medicii dentisti cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, stabiliți în unul dintre aceste state, sunt exceptați de la procedura de acreditare prevăzută de legislația asigurărilor sociale de sănătate.
(2) Persoanele prevăzute la alin. (1) au obligația de a informa în prealabil Casa Naționala de Asigurări de Sănătate asupra serviciilor pe care urmează să le presteze pe teritoriul României, iar în caz de urgenta, în termen de maximum 7 zile de la prestarea acestora.
Art. 494 - Începând cu data aderării la Uniunea Europeană, autoritățile competente române vor retrage, după caz, temporar sau definitiv, documentele prevăzute la art. 492 alin. (2) lit. c) eliberate medicilor dentisti care întrunesc condițiile prevăzute la art. 469 lit. a), c) și e), precum și medicilor dentisti stabiliți în România care întrunesc condițiile prevăzute la art. 469 lit. b), d) și f), în cazul în care acestora li se aplică sancțiunile prevăzute de lege cu suspendarea sau interdicția exercitării profesiei.
Art. 495 - (1) Pentru fiecare prestare de servicii autoritățile competente române pot solicita autorităților competente omoloage din statul membru de stabilire informații pertinente cu privire la legalitatea condiției de stabilire, buna conduita profesională a solicitantului, precum și la absenta în cazul acestuia a sancțiunilor disciplinare sau penale.
(2) La solicitarea statului membru gazda, autoritățile competente române transmit informațiile solicitate cu respectarea prevederilor art. 499.
(3) Autoritățile competente asigura schimbul necesar de informații pentru ca plângerea beneficiarului împotriva prestatorului de servicii medico-dentare în regim temporar sau ocazional să fie corect soluționată. În aceasta situație, beneficiarul este informat asupra cursului demersului sau.
Secţiunea a 3-a - Dispoziții comune cu privire la dreptul de stabilire și libera prestare de servicii medico-dentare
Art. 496 - Medicii dentisti cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene care, în timpul exercitării profesiei în România încalcă dispozițiile, legile și regulamentele profesiei răspund potrivit legii.
Art. 497 - (1) Medicii dentisti cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene care exercită profesia de medic dentist în România au dreptul de a atașa la titlul profesional prevăzut la art. 477 titlul legal de formare obținut în statul membru de origine sau de proveniență, în limba statului emitent și, eventual, abrevierea acestui titlu în măsura în care nu este identic cu titlul profesional. Titlul legal de formare va fi însoțit de numele și locul instituției sau ale organismului emitent.
(2) Dacă titlul respectiv de formare desemnează în România o pregătire complementara neinsusita de beneficiar, acesta va utiliza în exercițiul profesiei forma corespunzătoare a titlului indicată de autoritățile competente române.
Art. 498 - (1) Medicii dentisti cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene care doresc sa exercite profesia în România pot obține de la autoritățile competente române informații cu privire la legislația din domeniul sănătății, din domeniul securității sociale, precum și cu privire la Codul deontologic al medicului dentist.
(2) În vederea furnizarii informațiilor prevăzute la alin. (1), autoritățile competente române vor organiza la nivelul structurilor teritoriale și centrale birouri de informare legislativă.
(3) Medicii dentisti cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, care exercită profesia ca urmare a recunoașterii calificării profesionale de către autoritățile competente române, trebuie să posede cunoștințele lingvistice necesare desfășurării activităților profesionale în România.
Art. 499 - (1) Autoritățile competente române colaborează îndeaproape cu autoritățile competente omoloage ale statelor membre ale Uniunii Europene, ale statelor aparținând Spațiului Economic European și, respectiv, ale Confederatiei Elvetiene, asigurând confidențialitatea informațiilor transmise.
(2) Schimbul de informații privind sancțiunile disciplinare sau penale aplicate în caz de fapte grave și precise, susceptibile de a avea consecințe asupra activităților de medic dentist, se va face cu respectarea prevederilor Legii nr. 506/2004 privind prelucrarea datelor cu caracter personal și protecția vieții private în sectorul comunicațiilor electronice și a prevederilor Legii nr. 677/2001 pentru protecția persoanelor cu privire la prelucrarea datelor cu caracter personal și libera circulație a acestor date, cu modificările și completările ulterioare.
Capitolul III - Organizarea și funcționarea Colegiului Medicilor Dentisti din România
Secţiunea 1 - Caracteristici generale
Art. 500 - (1) Colegiul Medicilor Dentisti din România este organism profesional, apolitic, fără scop patrimonial, de drept public, cu responsabilități delegate de autoritatea de stat, în domeniul autorizării, controlului și supravegherii profesiei de medic dentist ca profesie liberala, de practica publică autorizata.
(2) Colegiul Medicilor Dentisti din România are autonomie instituțională în domeniul sau de competența, normativ și jurisdicțional profesional.
(3) Ministerul Sănătății Publice urmărește modul de respectare a prevederilor legale în activitatea Colegiului Medicilor Dentisti din România.
(4) Colegiul Medicilor Dentisti din România cuprinde toți medicii dentisti care întrunesc condițiile prevăzute la art. 469 lit. a), c) și e), precum și medicii dentisti stabiliți în România care întrunesc condițiile prevăzute la art. 469 lit. b), d) și f) și care exercită profesia de medic dentist în condițiile prezentului titlu.
Art. 501 - (1) Colegiul Medicilor Dentisti din România se organizează și funcționează pe criterii teritoriale, la nivel național și județean, respectiv la nivelul municipiului București.
(2) Sediul Colegiului Medicilor Dentisti din România este în municipiul București.
(3) Patrimoniul este format din bunuri mobile și imobile dobândite în condițiile legii.
Secţiunea a 2-a - Atribuțiile Colegiului Medicilor Dentisti din România
Art. 502 - (1) Colegiul Medicilor Dentisti din România are următoarele atribuții generale:
a) colaborează în domeniul sau de competența cu Ministerul Sănătății Publice, prin asigurarea controlului aplicării regulamentelor și normelor care organizează și reglementează exercitarea profesiei de medic dentist, indiferent de forma de exercitare și de unitatea sanitară în care se desfășoară;
b) apara demnitatea, promovează drepturile și interesele membrilor săi în toate sferele de activitate, apara onoarea, libertatea și independenta profesională ale medicului dentist în exercitarea profesiei;
c) asigura respectarea de către medicii dentisti a obligațiilor ce le revin față de pacient și de sănătatea publică;
d) atesta onorabilitatea și moralitatea profesională ale membrilor săi;
e) întocmește, actualizează permanent Registrul unic al medicilor dentisti din România, administrează pagina de Internet de publicare a acestuia și înaintează trimestrial Ministerului Sănătății Publice un raport privind situația numerică a membrilor săi, precum și a evenimentelor înregistrate în domeniul autorizării, controlului și supravegherii exercitării profesiei de medic dentist;
f) elaborează și adopta Regulamentul de organizare și funcționare al Colegiului Medicilor Dentisti din România și Codul deontologic al medicului dentist, luând măsurile necesare pentru respectarea unitară a acestora;
g) dezvolta metodologii, inițiază și elaborează ghiduri și protocoale de practica medico-dentara, pe nivelurile de competența ale unităților sanitare, pe care le propune spre aprobare Ministerului Sănătății Publice;
h) colaborează în domeniul sau de competența cu instituții/autorități publice, organizații desemnate de Ministerul Sănătății Publice la elaborarea criteriilor și standardelor de dotare a cabinetelor de practica medico-dentara, indiferent de forma de proprietate, și le supune spre aprobare Ministerului Sănătății Publice;
i) îi reprezintă pe membrii săi în relațiile cu asociații științifice, profesionale, patronale și cu sindicatele;
j) stabilește și reglementează regimul de publicitate a activităților medico-dentare;
k) colaborează în domeniul sau de competența cu organizații, autorități/instituții publice, persoane fizice/juridice cu atribuții desemnate de Ministerul Sănătății Publice, asigurând cadrul necesar desfășurării unei concurente loiale bazate exclusiv pe promovarea competentei profesionale;
l) controlează modul în care sunt respectate de către angajatori independenta profesională a medicilor dentisti și dreptul acestora de decizie în exercitarea actului medico-dentar;
m) colaborează în domeniul sau de competența cu Ministerul Sănătății Publice la consultarile privind reglementările din domeniul medico-dentar sau al asigurărilor sociale de sănătate;
n) acționează, alături de instituțiile sanitare centrale și teritoriale, ca în unitățile medico-dentare publice și private (cabinete, ambulatorii, spitale) să fie asigurată calitatea actului medico-dentar;
o) organizează judecarea cazurilor de abateri de la normele de etica profesională și de deontologie medico-dentara și a cazurilor de greșeli în activitatea profesională, în calitate de organ de jurisdicție profesională;
p) sprijină instituțiile și acțiunile de asistența medico-socială pentru medicii dentisti și familiile lor;
q) promovează relațiile pe plan extern cu organizații și formațiuni similare;
r) în cadrul Colegiului Medicilor Dentisti din România funcționează comisii ce reprezintă specialitatile medicinei dentare prevăzute în Nomenclatorul specialitatilor medicale, medico-dentare și farmaceutice pentru rețeaua de asistența medicală, elaborat de Ministerul Sănătății Publice;
s) colaborează cu organizații, autorități/instituții publice, persoane fizice/juridice cu atribuții desemnate de Ministerul Sănătății Publice, reprezentând în domeniul sau de competența medicii dentisti cu practica independenta care desfășoară activități medicale în cadrul sistemului de asigurări sociale de sănătate;
t) avizează, în domeniul sau de competența, autorizarea de instalare a cabinetelor medicale dentare publice sau private și se pronunța în acest sens în legătură cu demersurile întreprinse în vederea interzicerii instalării și funcționarii acestora, ținând seama ca exercitarea activităților medico-dentare să se facă în concordanta cu competența profesională a medicului dentist, cu dotarea tehnica, precum și cu respectarea normelor de igiena;
u) colaborează cu Ordinul Asistentilor Medicali și Moașelor din România în ceea ce privește activitatea profesională a tehnicienilor dentari și asistentilor medicali care desfășoară activitate în medicina dentara;
v) organizează centre de pregătire lingvistica, necesare pentru exercitarea activității profesionale de către medicii cetățeni ai statelor membre ale Uniunii Europene, ai statelor aparținând Spațiului Economic European sau ai Confederatiei Elvetiene;
x) colaborează în domeniul sau de competența cu organizații de profil profesional-științific, patronal, sindical, din domeniul sanitar, și cu organizații neguvernamentale în toate problemele ce privesc asigurarea sănătății populației;
y) coordonează, controlează și supraveghează funcțional, organizatoric și financiar colegiile teritoriale.
(2) În domeniul formării profesionale, Colegiul Medicilor Dentisti din România are următoarele atribuții:
a) participa în domeniul sau de competența cu Ministerul Educației și Cercetării și Ministerul Sănătății Publice la stabilirea numărului anual de locuri de pregătire în unitățile de învățământ superior de medicina dentara;
b) colaborează în domeniul sau de competența cu Ministerul Sănătății Publice, alături de alte organizații, persoane fizice/juridice, la formarea, specializarea și perfecționarea pregătirii profesionale a medicilor dentisti;
c) colaborează în domeniul sau de competența cu Ministerul Sănătății Publice la elaborarea metodologiei de acordare a gradului profesional, a tematicii de concurs și la elaborarea Nomenclatorului de specialități medicale, medico-dentare și farmaceutice pentru rețeaua de asistența medicală;
d) inițiază și promovează, în domeniul sau de competența, împreună cu organizații, autorități/instituții publice, persoane fizice/juridice cu atribuții desemnate de Ministerul Sănătății Publice, forme de educație medicală continua și de ridicare a gradului de competența profesională a membrilor săi;
e) urmărește realizarea orelor de educație medicală continua necesare reavizarii la 5 ani a calității de membru al Colegiului Medicilor Dentisti din România;
f) susține activitatea și dezvoltarea cercetării științifice și organizează manifestări științifice în domeniul medicinei dentare;
g) colaborează prin compartimentul de calitate a serviciilor de sănătate cu autorități/instituții publice, persoane fizice/juridice cu atribuții desemnate de Ministerul Sănătății Publice, în vederea stabilirii și creșterii standardelor de practica profesională, a asigurării calității actului medico-dentar în unitățile sanitare.
Art. 503 - În exercitarea atribuțiilor prevăzute de prezentul titlu Colegiul Medicilor Dentisti din România, prin structurile naționale sau teritoriale, are dreptul de a formula acțiune în justiție în nume propriu sau în numele membrilor săi.
Secţiunea a 3-a - Membrii Colegiului Medicilor Dentisti din România
Art. 504 - (1) În vederea exercitării profesiei de medic dentist, medicii dentisti cetățeni români și medicii dentisti cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, stabiliți în România, precum și medicii dentisti care întrunesc condițiile prevăzute de art. 469 lit. c) și e) au obligația să se înscrie în Colegiul Medicilor Dentisti din România.
(2) Calitatea de membru este dovedită prin certificatul de membru al Colegiului Medicilor Dentisti din România, care se eliberează la înscrierea în corpul profesional.
(3) Înscrierea în Colegiul Medicilor Dentisti din România și eliberarea certificatului de membru se fac numai pentru medicii dentisti care îndeplinesc condițiile prevăzute la art. 476 alin. (1) lit. a), b) și c) și au depus jurământul prevăzut la art. 475.
(4) Depunerea jurământului se va menționa în certificatul de membru al Colegiului Medicilor Dentisti din România.
(5) Pot deveni la cerere membri ai Colegiului Medicilor Dentisti din România și medicii dentisti cetățeni ai unui stat membru al Uniunii Europe, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, stabiliți în unul dintre aceste state și care prestează temporar sau ocazional servicii medico-dentare în România, cu respectarea prevederilor alin. (3).
(6) Membrii Colegiului Medicilor Dentisti din România sunt înscriși în Registrul unic al medicilor dentisti din România, care se publică pe pagina de Internet a Colegiului Medicilor Dentisti din România.
Art. 505 - (1) La cerere, membrii Colegiului Medicilor Dentisti din România, care din motive obiective întrerup pe o durată de până la 5 ani exercitarea profesiei de medic dentist, pot solicita suspendarea calității de membru pe acea durata.
(2) Pe durata suspendării la cerere a calității de membru al Colegiului Medicilor Dentisti din România se suspenda obligațiile și drepturile ce decurg din prezenta lege.
(3) Întreruperea exercitării profesiei de medic dentist pe o durată mai mare de 5 ani atrage, de drept, pierderea calității de membru al Colegiului Medicilor Dentisti din România.
Art. 506 - Medicii dentisti cetățeni români și medicii dentisti cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, stabiliți în România, care doresc sa exercite profesia, se înscriu ca membri ai Colegiului Medicilor Dentisti din România la colegiul teritorial în raza căruia se afla unitatea la care urmează să își desfășoare activitatea sau la colegiul teritorial în raza căruia își au domiciliul sau, după caz, reședința.
Secţiunea a 4-a - Drepturile și obligațiile membrilor Colegiului Medicilor Dentisti din România
Art. 507 - Membrii Colegiului Medicilor Dentisti din România au următoarele drepturi:
a) dreptul sa aleagă și să fie aleși în organele de conducere de la nivelul structurilor teritoriale și/sau naționale ale Colegiului Medicilor Dentisti din România;
b) dreptul să se adreseze organelor abilitate ale Colegiului Medicilor Dentisti din România și sa primească informațiile solicitate;
c) dreptul sa participe la orice acțiune a Colegiului Medicilor Dentisti din România și să fie informati în timp util despre aceasta;
d) dreptul sa folosească împreună cu membrii lor de familie toate dotările sociale, profesionale, culturale și sportive ale Colegiului Medicilor Dentisti din România și ale colegiilor teritoriale;
e) dreptul sa poarte însemnele Colegiului Medicilor Dentisti din România;
f) dreptul de a contesta sancțiunile primite;
g) dreptul de a solicita ajutoare materiale pentru situații deosebite, atât personal, cat și prin membrii lor de familie.
Art. 508 - Obligațiile membrilor Colegiului Medicilor Dentisti din România sunt următoarele:
a) să respecte dispozițiile Regulamentului de organizare și funcționare al Colegiului Medicilor Dentisti din România, ale Codului deontologic al medicului dentist, hotărârile organelor de conducere ale Colegiului Medicilor Dentisti din România și regulamentele profesiei;
b) sa rezolve sarcinile ce le-au fost încredințate în calitate de membru sau de reprezentant al corpului profesional;
c) sa participe la manifestările inițiate de organele de conducere, la activitățile profesionale ori de pregătire profesională inițiate ori organizate de organele de conducere naționale sau locale;
d) sa participe la ședințele ori adunările la care au fost convocați;
e) să execute cu buna-credința sarcinile care decurg din hotărârile organelor de conducere ale Colegiului Medicilor Dentisti din România;
f) să se abțină de la deliberările organelor de conducere în care sunt aleși, în cazul în care, în îndeplinirea unor atribuții ale acestor organe, au un interes propriu;
g) sa păstreze secretul profesional;
h) să respecte normele, principiile și îndatoririle deontologiei medicale;
i) să aibă un comportament demn în exercitarea profesiei ori a calității de membru al Colegiului Medicilor Dentisti din România;
j) sa achite în termenul stabilit cotizatia datorată în calitate de membru al Colegiului Medicilor Dentisti din România;
k) sa rezolve litigiile cu alți membri, în primul rând prin mediere de către comisiile organizate în acest scop în cadrul Colegiului Medicilor Dentisti din România;
l) să execute cu buna-credința atribuțiile ce le revin în calitate de reprezentant sau membru în organele de conducere ale Colegiului Medicilor Dentisti din România, în colegiile județene sau în Colegiul Medicilor Dentisti al Municipiului București.
Art. 509 - Obligațiile membrilor Colegiului Medicilor Dentisti din România, ce decurg din calitatea lor specială de medici dentisti, sunt:
a) să respecte și să aplice în orice împrejurare normele de deontologie ale profesiei de medic dentist;
b) sa nu aducă prejudicii reputației profesiei sau altor membri, respectând statutul de corp profesional al Colegiului Medicilor Dentisti din România;
c) sa acorde cu promptitudine și necondiționat ingrijirile medico-dentare de urgenta, ca o îndatorire fundamentală profesională și civică;
d) sa acționeze pe toată durata exercitării profesiei în vederea creșterii gradului de pregătire profesională;
e) să aplice parafa cuprinzând numele, prenumele, gradul profesional, specialitatea și codul pe toate actele medicale pe care le semnează;
f) să respecte drepturile pacientilor.
Art. 510 - (1) În vederea creșterii gradului de pregătire profesională și asigurării unui nivel ridicat al cunoștințelor medico-dentare, medicii dentisti sunt obligați să efectueze un număr de cursuri de pregătire și alte forme de educație medicală continua și informare în domeniul stiintelor medicale, pentru cumularea numărului de credite stabilit în acest sens de Colegiul Medicilor Dentisti din România. Sunt creditate programele, precum și celelalte forme de educație medicală continua avizate de Colegiul Medicilor Dentisti din România.
(2) Medicii dentisti care nu realizează pe parcursul a 5 ani numărul minim de credite de educație medicală continua, stabilit de Consiliul național al Colegiului Medicilor Dentisti din România, sunt suspendați din exercitarea profesiei până la realizarea numărului de credite respectiv.
Secţiunea a 5-a - Organizare și funcționare
A. Organizarea la nivel teritorial
Art. 511 - (1) Colegiul Medicilor Dentisti din România este organizat la nivel național și județean, respectiv al municipiului București, în colegii ale medicilor dentisti, denumite în continuare colegii teritoriale.
(2) Colegiile teritoriale au personalitate juridică, patrimoniu și buget proprii, precum și autonomie funcțională, organizatorică și financiară în condițiile prezentei legi. Sediul colegiului teritorial este în reședința de județ, respectiv în municipiul București.
Art. 512 - Organele de conducere ale Colegiului Medicilor Dentisti din România, la nivel județean sau al municipiului București, sunt: adunarea generală, consiliul județean, respectiv al municipiului București, și biroul consiliului.
Art. 513 - (1) Adunarea generală a colegiilor teritoriale este alcătuită din medicii dentisti înscriși în colegiul teritorial respectiv.
(2) Adunarea generală a colegiilor teritoriale are următoarele atribuții:
a) aproba planul de activitate al consiliului;
b) aproba bugetul de venituri și cheltuieli;
c) alege membrii consiliului;
d) alege membrii comisiei de cenzori a colegiului teritorial sau, după caz, aproba cenzorul extern propus de colegiul teritorial;
e) alege reprezentanții colegiului teritorial în Adunarea generală naționala a Colegiului Medicilor Dentisti din România.
(3) Adunarea generală a colegiului teritorial se întrunește anual în primul trimestru al anului sau, în mod extraordinar, ori de câte ori este nevoie.
Art. 514 - (1) Consiliul colegiului județean, respectiv al municipiului București, este format din:
a) 7 membri pentru un număr de până la 100 medici dentisti înscriși;
b) 11 membri pentru 101-300 de medici dentisti înscriși;
c) 15 membri pentru 301-500 de medici dentisti înscriși;
d) 29 de membri pentru 501-1.000 de medici dentisti înscriși;
e) 49 de membri pentru colegiile cu peste 1.000 de medici dentisti înscriși.
(2) Proporțional cu numărul de membri ai consiliului se vor alege 3-9 membri supleanți.
Art. 515 - (1) Consiliul colegiului județean, respectiv al municipiului București, va alege dintre membrii săi un birou executiv format din președinte, 2 vicepreședinți, un secretar și un trezorier, aleși pentru un mandat de 4 ani.
(2) Membrii organelor de conducere de la nivel teritorial se aleg prin vot secret, pentru un mandat de 4 ani.
Art. 516 - (1) Alegerea organelor de conducere de la nivel teritorial sau național se face conform Regulamentului electoral aprobat de Consiliul național al Colegiului Medicilor Dentisti din România.
(2) Funcțiile în biroul executiv al colegiilor teritoriale, în Biroul executiv național și în Consiliul național al Colegiului Medicilor Dentisti din România sunt incompatibile cu:
a) funcția corespunzătoare dintr-un patronat/sindicat profesional;
b) funcții de conducere în cadrul Ministerului Sănătății Publice și ministerelor cu rețea sanitară proprie, autorităților de sănătate publică teritoriale, Casei Naționale de Asigurări de Sănătate, precum și caselor județene de asigurări de sănătate.
Art. 517 - (1) Consiliul colegiului județean, respectiv al municipiului București, se întrunește la convocarea președintelui, în ședințe ordinare, la interval de doua luni. În mod excepțional, la solicitarea a două treimi din numărul membrilor săi, consiliul colegiului județean, respectiv al municipiului București, poate fi convocat în ședințe extraordinare. Între ședințe, consiliul colegiului județean, respectiv al municipiului București, este condus de biroul executiv, care asigura activitatea permanenta a acestuia.
(2) Deciziile consiliului colegiului județean, respectiv al municipiului București, se adoptă în prezenta a cel puțin două treimi din numărul membrilor săi, cu votul favorabil a jumătate plus unu din numărul total al acestora.
Art. 518 - (1) Consiliul colegiului județean, respectiv al municipiului București, și, respectiv, biroul executiv al acestora exercita atribuțiile date în competența lor, prin Regulamentul de organizare și funcționare al Colegiului Medicilor Dentisti din România, adoptat de adunarea generală a acestuia.
(2) În vederea exercitării atribuțiilor, consiliul colegiului județean, respectiv al municipiului București, își desfășoară activitatea în comisii, alese de adunarea generală teritorială respectiva, pe domenii de activitate sau pe specialități ale medicinei dentare, în conformitate cu Regulamentul de organizare și funcționare adoptat de adunarea generală a Colegiului Medicilor Dentisti din România.
B. Organizarea la nivel național
Art. 519 - (1) Conducerea Colegiului Medicilor Dentisti din România, la nivel național, se exercită de către:
a) Adunarea generală naționala;
b) Consiliul național;
c) Biroul executiv național.
(2) Biroul executiv național și președintele acestuia, aleși de Adunarea generală naționala, sunt de drept organele de conducere ale Consiliului național al Colegiului Medicilor Dentisti din România.
(3) Nu pot primi sau exercita mandatul de membru al organelor de conducere ale Colegiului Medicilor Dentisti din România, atât la nivel național, cat și teritorial, medicii dentisti care dețin funcții de conducere în cadrul Ministerului Sănătății Publice, respectiv ministerelor și instituțiilor cu rețea sanitară proprie, structurilor deconcentrate ale acestora ori în cadrul Casei Naționale de Asigurări de Sănătate, caselor județene de asigurări de sănătate, respectiv a municipiului București, patronatelor și sindicatelor profesionale, precum și orice fel de funcții de demnitate publică.
(4) Medicii dentisti pentru care, în timpul mandatului de membru al organelor de conducere, a survenit situația de incompatibilitate sunt suspendați din funcție. Suspendarea durează până la încetarea situației de incompatibilitate sau până la expirarea mandatului.
(5) Numărul de mandate în organele de conducere de la nivel teritorial și național este de maximum doua, care pot fi și consecutive.
Art. 520 - (1) Adunarea generală naționala a Colegiului Medicilor Dentisti din România este alcătuită din reprezentanți aleși de adunarea generală din fiecare județ și din municipiul București, prin vot direct și secret.
(2) Norma de reprezentare în Adunarea generală naționala este de:
a) 2 reprezentanți pentru colegiile județene care au sub 50 de membri înscriși;
b) 4 reprezentanți pentru colegiile județene care au sub 120 de membri înscriși;
c) 6 reprezentanți pentru colegiile județene care au sub 200 de membri înscriși;
d) 8 reprezentanți pentru colegiile județene care au sub 300 de membri înscriși;
e) 10 reprezentanți pentru colegiile județene cu peste 300 de membri înscriși;
f) 15 reprezentanți pentru colegiile județene cu peste 500 de membri înscriși;
g) 20 de reprezentanți pentru colegiile județene cu peste 701 membri înscriși;
h) un reprezentant la 100 de membri înscriși pentru Colegiul Medicilor Dentisti al Municipiului București.
(3) Adunarea generală naționala a Colegiului Medicilor Dentisti din România se întrunește anual în primul trimestru al anului sau în mod extraordinar ori de câte ori este nevoie.
Art. 521 - (1) Adunarea generală naționala adopta Codul deontologic al medicului dentist și Regulamentul de organizare și funcționare al Colegiului Medicilor Dentisti din România în prezenta a cel puțin două treimi din numărul reprezentanților aleși.
(2) Deciziile Adunării generale naționale a Colegiului Medicilor Dentisti din România se adoptă cu majoritate simpla de voturi în prezenta a cel puțin două treimi din numărul reprezentanților aleși.
Art. 522 - Adunarea generală naționala a Colegiului Medicilor Dentisti din România are următoarele atribuții:
a) adopta atât Codul deontologic al medicului dentist și Regulamentul de organizare și funcționare al Colegiului Medicilor Dentisti din România, cat și modificările lor ulterioare;
b) alege membrii Biroului executiv național pentru mandatul de 4 ani;
c) dezbate și votează Raportul anual de activitate prezentat de Biroul executiv național și de comisiile de specialitate ale Colegiului Medicilor Dentisti din România privind activitatea desfășurată între sesiunile adunării generale;
d) revoca din funcție membrii aleși, pentru abateri de la prevederile prezentei legi și, respectiv, ale Regulamentului de organizare și funcționare al Colegiului Medicilor Dentisi din România, care aduc prejudicii activității organismului profesional;
e) alege comisia de cenzori sau, după caz, aproba cenzorul contabil autorizat, propus de Consiliul național al Colegiului Medicilor Dentisti din România;
f) aproba bugetul de venituri și cheltuieli anual al Colegiului Medicilor Dentisti din România;
g) dezbate și votează raportul Comisiei de cenzori;
h) stabilește obiectivele generale ale Colegiului Medicilor Dentisti din România pe termen scurt, mediu și lung.
Art. 523 - (1) Între sesiunile Adunării generale naționale Colegiul Medicilor Dentisti din România este condus de Consiliul național.
(2) Consiliul național al Colegiului Medicilor Dentisti din România este alcătuit din Biroul executiv național, câte un reprezentant al fiecărui județ, din 3 reprezentanți ai municipiului București, un reprezentant numit de Ministerul Sănătății Publice, ca autoritate de stat, și câte un reprezentant din fiecare minister și instituție centrala cu rețea sanitară proprie.
(3) Consiliul național al Colegiului Medicilor Dentisti din România se întrunește legal în prezenta a cel puțin două treimi din numărul reprezentanților stabiliți la alin. (2).
Art. 524 - Deciziile Consiliului național al Colegiului Medicilor Dentisti din România se adoptă în prezenta a cel puțin două treimi din numărul membrilor săi, cu votul favorabil a jumătate plus unu din numărul total al membrilor.
Art. 525 - Atribuțiile Consiliului național al Colegiului Medicilor Dentisti din România sunt următoarele:
a) elaborează Codul deontologic al medicului dentist, precum și Regulamentul de organizare și funcționare al Colegiului Medicilor Dentisti din România;
b) fixează cotizatia care trebuie plătită obligatoriu de către fiecare medic dentist consiliului județean, respectiv al municipiului București, stabilind partea din aceasta cotizatie care trebuie virata către Consiliul național al Colegiului Medicilor Dentisti din România;
c) stabilește indemnizația pentru membrii Biroului executiv național și biroului consiliilor teritoriale, precum și indemnizațiile de ședința pentru membrii Consiliului național;
d) gestionează bunurile Colegiului Medicilor Dentisti din România și poate să initieze și sa subventioneze acțiuni interesand profesiunea de medic dentist și acțiuni de întrajutorare;
e) controlează și coordonează activitatea consiliului județean, respectiv al municipiului București, și controlează gestiunea acestora;
f) soluționează, în termen de 30 de zile de la înregistrare, contestațiile formulate împotriva deciziilor date de consiliile județene, respectiv al municipiului București, în conformitate cu regulamentele proprii;
g) colaborează cu Ministerul Sănătății Publice la elaborarea Nomenclatorului de specialități medicale, medico-dentare și farmaceutice pentru rețeaua de asistența medicală;
h) colaborează, în domeniul sau de competența, cu Ministerul Sănătății Publice la elaborarea de norme privind exercitarea profesiei de medic dentist pe teritoriul României;
i) colaborează cu Ministerul Sănătății Publice la elaborarea tematicilor și a metodologiilor concursurilor și examenelor pentru medicii dentisti;
j) stabilește sistemul de credite de educație medicală continua pe baza căruia se evalueaza activitatea de perfecționare profesională a medicilor dentisti;
k) stabilește condițiile privind desfășurarea de către cabinetele și unitățile medico-dentare a publicității și aproba conținutul materialului publicitar.
Art. 526 - În cadrul Consiliului național al Colegiului Medicilor Dentisti din România funcționează mai multe comisii al căror număr, competente, precum și regulament de funcționare sunt stabilite de acesta.
Art. 527 - (1) Biroul executiv național al Colegiului Medicilor Dentisti din România asigura activitatea permanenta a acestuia, în conformitate cu legea și regulamentele proprii.
(2) Biroul executiv național este alcătuit dintr-un președinte, 3 vicepreședinți, un secretar general și un trezorier, aleși în mod individual pe funcții de Adunarea generală naționala, pentru un mandat de 4 ani.
(3) Biroul executiv național conduce ședințele Consiliului național și activitatea Colegiului Medicilor Dentisti din România între ședințele Consiliului național.
Art. 528 - (1) Consiliul național al Colegiului Medicilor Dentisti din România participa, în domeniul sau de competența, în colaborare cu Ministerul Sănătății Publice, la elaborarea tuturor programelor de sănătate și a actelor normative cu efect asupra medicinei dentare.
(2) La negocierea anuală a contractului-cadru pentru specialitatea medicina dentara Consiliul național al Colegiului Medicilor Dentisti din România reprezintă în domeniul sau de competența medicii dentisti cu practica independenta, aflați în relații contractuale cu casele de asigurări sociale de sănătate.
Art. 529 - (1) Contractul de muncă al persoanei care exercită o funcție de conducere în Biroul executiv al consiliului județean, respectiv al municipiului București, și al Consiliului național al Colegiului Medicilor Dentisti din România se suspenda, la cererea persoanei în cauza, pe perioada cat îndeplinește funcția respectiva, cu menținerea locului de muncă.
(2) Persoana aflată în situația prevăzută la alin. (1) beneficiază de vechime în munca pe perioada exercitării funcției respective.
(3) Remunerarea persoanelor care exercită funcții de conducere în Biroul executiv național sau local este stabilită prin vot, cu majoritate simpla, de Consiliul național al Colegiului Medicilor Dentisti din România.
Secţiunea a 6-a - Răspunderea disciplinară
Art. 530 - (1) Medicul dentist răspunde disciplinar pentru nerespectarea legilor și regulamentelor profesiei de medic dentist, a Codului deontologic al medicului dentist, a regulilor de buna practica profesională, a Regulamentului de organizare și funcționare al Colegiului Medicilor Dentisti din România, pentru nerespectarea deciziilor obligatorii adoptate de organele de conducere ale Colegiului Medicilor Dentisti din România, precum și pentru orice fapte săvârșite în legătură cu profesia sau în afară acesteia, care sunt de natura sa prejudicieze onoarea și prestigiul profesiei sau ale instituției Colegiului Medicilor Dentisti din România.
(2) Răspunderea disciplinară a membrilor Colegiului Medicilor Dentisti din România, potrivit prezentului titlu, nu exclude răspunderea penală, contravențională, civilă sau materială, conform prevederilor legale.
Art. 531 - (1) Sancțiunile disciplinare sunt:
a) mustrare;
b) avertisment;
c) vot de blam;
d) interdicția de a exercita profesia ori anumite activități medico-dentare pe o perioadă de la o luna la 6 luni;
e) retragerea calității de membru al Colegiului Medicilor Dentisti din România.
(2) Retragerea calității de membru al Colegiului Medicilor Dentisti din România operează de drept pe durata stabilită prin hotărâre definitivă de instanțele judecătorești cu privire la interzicerea exercitării profesiei.
(3) La sancțiunile prevăzute la alin. (1) se poate prevedea, după caz, obligarea celui sancționat la efectuarea unor cursuri de perfecționare sau de educație medico-dentara ori alte forme de pregătire profesională.
Art. 532 - (1) În cadrul fiecărui colegiu teritorial se organizează și funcționează comisia de disciplina care judeca în complete de 3 membri abaterile disciplinare săvârșite de medicii dentisti înscriși în acel colegiu.
(2) La nivelul Colegiului Medicilor Dentisti din România se organizează și funcționează Comisia superioară de disciplina care judeca în complete de 5 membri contestațiile formulate împotriva deciziilor comisiilor de disciplina teritoriale.
(3) Unul dintre membrii comisiilor de disciplina este desemnat de autoritățile de sănătate publică, la nivel teritorial, și de Ministerul Sănătății Publice, la nivelul Comisiei superioare de disciplina.
(4) Calitatea de membru al comisiilor de disciplina încetează prin deces, demisie, pierderea calității de membru al Colegiului Medicilor Dentisti din România ori prin numirea unui alt reprezentant în cazul membrilor desemnați de Ministerul Sănătății Publice sau de autoritățile de sănătate publică.
(5) Procedura judecării abaterilor, alegerea membrilor comisiilor de disciplina, durata mandatului acestora și încetarea mandatului sunt prevăzute de Regulamentul de organizare și funcționare al Colegiului Medicilor Dentisti din România.
(6) Deciziile de sancționare pronunțate de comisiile de disciplina de la nivelul colegiilor teritoriale pot fi contestate de medicul dentist sancționat, în termen de 15 zile de la comunicare.
(7) Împotriva deciziei Comisiei superioare de disciplina, în termen de 15 zile de la comunicare, medicul dentist sancționat poate formula o acțiune în anulare la secția de contencios administrativ a tribunalului în raza căruia își desfășoară activitatea.
Art. 533 - Unitățile sanitare sau cele de medicina legală au obligația de a pune la dispoziția comisiilor de disciplina sau a persoanelor desemnate cu investigarea abaterilor disciplinare documentele medicale solicitate, precum și orice alte date și informații necesare soluționării cauzei.
Art. 534 - (1) Acțiunea disciplinară poate fi pornită în termen de cel mult 6 luni de la data săvârșirii faptei sau de la data cunoașterii consecințelor prejudiciabile.
(2) Sancțiunile prevăzute la art. 531 alin. (1) lit. a)-c) se radiază în termen de 6 luni de la data executării lor, iar cea prevăzută la lit. d), în termen de un an de la data expirării perioadei de interdicție.
(3) În cazul aplicării sancțiunii prevăzute la art. 531 alin. (1) lit. e), medicul dentist poate face o noua cerere de redobandire a calității de membru al colegiului după un an de la data aplicării sancțiunii de comisiile de disciplina. Redobandirea calității de membru al Colegiului Medicilor Dentisti din România se face în condițiile prezentei legi.
(4) În situația în care, prin decizia comisiei de disciplina, au fost dispuse și măsurile prevăzute la art. 531 alin. (3), radierea sancțiunii se va face numai după prezentarea dovezii ducerii la îndeplinire a măsurii dispuse de comisia de disciplina.
(5) Repetarea unei abateri disciplinare până la radierea sancțiunii aplicate constituie o circumstanță agravantă, care va fi avută în vedere la aplicarea noii sancțiuni.
(6) Decizia pronunțată se comunică medicului dentist sancționat și Biroului executiv al Colegiului Medicilor Dentisti din România.
(7) Deciziile privind aplicarea sancțiunilor care se soldeaza cu suspendarea sau interzicerea exercitării profesiei se comunică și Ministerului Sănătății Publice și, respectiv, angajatorului.
(8) Persoana fizica/juridică ce a făcut sesizarea va fi informată cu privire la soluționarea cauzei de către comisia de disciplina.
Secţiunea a 7-a - Venituri și cheltuieli
Art. 535 - Veniturile Colegiului Medicilor Dentisti din România se constituie din:
a) taxa de înscriere;
b) cotizațiile lunare ale membrilor;
c) contravaloarea serviciilor prestate membrilor sau persoanelor fizice și juridice;
d) donații de la persoane fizice și juridice;
e) legate;
f) drepturi editoriale;
g) încasări din vânzarea publicațiilor proprii;
h) fonduri rezultate din manifestările culturale și științifice;
i) alte surse.
Art. 536 - (1) Neplata cotizatiei datorate Colegiului Medicilor Dentisti din România pe o perioadă de 6 luni și după atenționarea scrisă de către consiliul teritorial al Colegiului Medicilor Dentisti din România se sancționează cu suspendarea exercitării profesiei până la plata cotizatiei datorate și atrage plata unor majorări de întârziere în cuantumul prevăzut de dispozițiile legale aplicabile instituțiilor publice.
(2) Penalitățile de întârziere se vor aplica și colegiilor teritoriale care nu vărsa partea de cotizatie stabilită de Consiliul național.
Art. 537 - (1) Cuantumul cotizatiei de membru al Colegiului Medicilor Dentisti din România, precum și partea din aceasta care trebuie vărsată către forurile naționale se stabilesc de către Consiliul național al Colegiului Medicilor Dentisti din România.
(2) Partea din cotizatie aferentă funcționarii Colegiului Medicilor Dentisti din România va fi virata, până cel mai târziu la sfârșitul lunii următoare celei pentru care a fost percepută cotizatia, înaintea oricăror alte plati.
(3) Obligația urmăririi și efectuării varsarii cotei aferente Consiliului național revine președintelui consiliului teritorial. Neîndeplinirea acestei obligații se sancționează de Consiliul național conform art. 531 lit. a)-c).
Art. 538 - Pentru serviciile prestate persoanelor care nu sunt membre ale Colegiului Medicilor Dentisti din România tarifele se stabilesc, după caz, de Consiliul național, respectiv de consiliul colegiului teritorial.
Art. 539 - (1) Fondurile bănești pot fi utilizate pentru cheltuieli de administrație, salarizare personal, fonduri fixe, material gospodăresc, finanțarea cheltuielilor organizatorice, perfecționarea pregătirii profesionale, acordarea de burse de merit prin concurs medicilor dentisti, intrajutorarea medicilor dentisti cu venituri mici și a familiilor lor.
(2) Modul de alocare a fondurilor prevăzute la alin. (1) se stabilește de Consiliul național al Colegiului Medicilor Dentisti din România.
Capitolul IV - Rolul, atribuțiile și drepturile autorității de stat
Art. 540 - Ministerul Sănătății Publice, în calitate de autoritate de stat, urmărește ca activitatea Colegiului Medicilor Dentisti din România să se desfășoare în condițiile legii.
Art. 541 - Reprezentantul autorității de stat cu rangul de secretar de stat în Ministerul Sănătății Publice este membru al Consiliului național al Colegiului Medicilor Dentisti din România și este numit prin ordin al ministrului sănătății publice.
Art. 542 - În cazul în care reprezentantul autorității de stat constata că nu sunt respectate prevederile legale, acesta sesizează organele de conducere ale Colegiului Medicilor Dentisti din România. În termen de 15 zile de la efectuarea demersului, acestea adopta măsurile necesare de încadrare în normele în vigoare și informează Ministerul Sănătății Publice în acest sens.
Art. 543 - În cazul nerespectării prevederilor art. 542, Ministerul Sănătății Publice se adresează instanțelor judecătorești competente.
Capitolul V - Dispoziții tranzitorii și finale
Art. 544 - (1) Atribuțiile Colegiului Medicilor Dentisti din România nu pot fi exercitate de nici o alta asociație profesională.
(2) Colegiul Medicilor Dentisti din România nu se poate substitui organizațiilor patronale sau sindicale și în îndeplinirea atribuțiilor sale nu poate face uz de prerogativele acestora prevăzute de lege.
(3) Membrii Colegiului Medicilor Dentisti din România pot face parte și din alte asociații profesionale.
Art. 545 - (1) Actualele organe de conducere ale Colegiului Medicilor Dentisti din România de la nivel național și teritorial vor rămâne în funcție și își vor exercita mandatul până la împlinirea duratei pentru care au fost alese.
(2) În termen de 90 de zile de la intrarea în vigoare a noului statut al Colegiului Medicilor Dentisti din România se vor organiza comisii de disciplina, în condițiile prezentului titlu.
Art. 546 - Regulamentul de organizare și funcționare al Colegiului Medicilor Dentisti din România, Codul de deontologie al medicului dentist, cu modificările și completările ulterioare, precum și deciziile Consiliului național care privesc organizarea și funcționarea Colegiului Medicilor Dentisti din România sau drepturile și obligațiile acestora ca membri ai Colegiului Medicilor Dentisti din România se vor publică în Monitorul Oficial al României, Partea I.
Art. 547 - Pe durata exercitării profesiei în regim salarial sau/și independent medicul dentist este obligat sa încheie o asigurare de răspundere civilă pentru greșeli în activitatea profesională.
Art. 548 - (1) Medicii dentisti care ocupa funcții publice în cadrul aparatului central al Ministerului Sănătății Publice, în cadrul autorităților de sănătate publică județene, respectiv a municipiului București, în cadrul Casei Naționale de Asigurări de Sănătate și, respectiv, în cadrul caselor de asigurări de sănătate județene și a municipiului București, pot desfășura în afară programului normal de lucru, în condițiile legii, activități profesionale, potrivit calificării pe care o dețin, exclusiv în unități sanitare private.
(2) Medicilor dentisti prevăzuți la alin. (1) li se aplică în mod corespunzător prevederile art. 35 alin. (1) și (3) din Legea nr. 53/2003 – Codul muncii, cu modificările și completările ulterioare.
Art. 549 - În termen de 60 de zile de la intrarea în vigoare a prezentului titlu, administrația publică locală, prin consiliile județene și Consiliul General al Municipiului București, va da în administrare colegiilor județene, respectiv al municipiului București, și Colegiului Medicilor Dentisti din România spații corespunzătoare pentru desfășurarea activității.
Art. 550 - În vederea facilitării accesului la exercițiul profesiei de medic dentist pe teritoriul României Ministerul Sănătății Publice, în colaborare cu Colegiul Medicilor Dentisti din România, recunoaște calificarile de medic dentist dobândite în conformitate cu normele Uniunii Europene, într-un stat membru al Uniunii Europene, într-un stat aparținând Spațiului Economic European sau în Confederatia Elvetiana, de cetățenii acestor state, iar încadrarea în munca se face conform legii.
Art. 551 - (1) Normele privind recunoașterea diplomelor, certificatelor și titlurilor de medic dentist, eliberate de un stat membru al Uniunii Europene, de un stat aparținând Spațiului Economic European și de Confederatia Elvetiana cetățenilor acestora, se elaborează de Ministerul Sănătății Publice, în colaborare cu Colegiul Medicilor Dentisti din România, și se aproba prin hotărâre a Guvernului.
(2) Nomenclatorul de specialități medicale, medico-dentare și farmaceutice pentru rețeaua de asistența medicală se elaborează de Ministerul Sănătății Publice și se aproba prin ordin al ministrului sănătății publice.
(3) Normele privind întocmirea, emiterea și utilizarea dovezilor de onorabilitate și moralitate profesională a medicilor dentisti se elaborează în colaborare de către autoritățile competente române definite de prezenta lege și se aproba prin hotărâre a Guvernului.
Art. 552 - La data intrării în vigoare a prezentului titlu se abroga Legea nr. 308/2004 privind exercitarea profesiei de medic dentist, precum și înființarea, organizarea și funcționarea Colegiului Medicilor Dentisti din România, publicată în Monitorul Oficial al României, Partea I, nr. 582 din 30 iunie 2004, cu modificările și completările ulterioare, precum și orice alte dispoziții contrare.
*
Prezentul titlu transpune în totalitate prevederile referitoare la exercitarea profesiei de medic dentist, cuprinse în:a) Directiva 78/686/CEE din 25 iulie 1978 privind recunoașterea reciprocă a diplomelor, certificatelor și altor titluri de medic dentist, inclusiv măsuri pentru facilitarea exercitării efective a dreptului de stabilire și a libertății de prestare a serviciilor, cu modificările și completările ulterioare, publicată în Jurnalul Oficial al Comunităților Europene (JOCE) nr. L 233 din 24 august 1978;
b) art. 5 alin. (1) lit. a), alin. (2) și (3), art. 6, art. 7 alin. (1), alin. (2) lit. a)-c) și alin. (3), art. 8, art. 36 alin. (2), art. 50 alin. (1) și (4), art. 51, art. 52 alin. (1), art. 53, 54 și art. 56 alin. (1) și (2) din Directiva 2005/36/CE din 7 septembrie 2005 privind recunoașterea calificarilor profesionale, publicată în Jurnalul Oficial al Comunităților Europene (JOCE) nr. L 255 din 30 septembrie 2005;
c) art. 11 din Regulamentul Consiliului nr. 1.612/68 CEE din 15 octombrie 1968 privind libera circulație a lucrătorilor în interiorul Comunității Europene, publicat în Jurnalul Oficial al Comunităților Europene (JOCE) nr. L 257 din 19 octombrie 1968;
d) Directiva Consiliului 2003/109/CE din 25 noiembrie 2003 privind statutul cetățenilor din statele terțe care sunt rezidenți pe termen lung, publicat în Jurnalul Oficial al Comunităților Europene (JOCE) nr. L 16 din 23 ianuarie 2004.
Titlul XIV - Exercitarea profesiei de farmacist. Organizarea și funcționarea Colegiului Farmacistilor din România
Capitolul I - Exercitarea profesiei de farmacist
Secţiunea 1 - Dispoziții generale
Art. 553 - Profesia de farmacist se exercită pe teritoriul României, în condițiile prezentei legi, de către persoanele fizice posesoare ale unui titlu oficial de calificare în farmacie, după cum urmează:
a) cetățeni ai statului român;
b) cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene;
c) soțul unui cetățean român, precum și descendenții și ascendenții în linie directa, aflați în întreținerea unui cetățean român, indiferent de cetățenia acestora;
d) membrii de familie ai unui cetățean al unuia dintre statele prevăzute la lit. b), asa cum sunt definiți de art. 2 alin. (1) pct. 3 din Ordonanța de urgenta a Guvernului nr. 102/2005 privind libera circulație pe teritoriul României a cetățenilor statelor membre ale Uniunii Europene și Spațiului Economic European, aprobată cu modificări și completări prin Legea nr. 260/2005;
e) cetățenii statelor terțe beneficiari ai statutului de rezident permanent în România;
f) beneficiari ai statutului de rezident pe termen lung, acordat de unul dintre statele prevăzute la lit. b).
Art. 554 - (1) În înțelesul prezentului titlu, termenii și notiunile folosite au următoarele semnificatii:
a) farmacisti cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene – persoanele prevăzute la art. 553 lit. b) și, prin asimilare, și farmaciștii aflați în situațiile prevăzute la art. 553 lit. d) și f);
b) stat membru de origine sau de proveniență sau stat membru gazda – un stat membru al Uniunii Europene, un stat aparținând Spațiului Economic European sau Confederatia Elvetiana.
(2) Prin titlu oficial de calificare în farmacie se înțelege:
a) diploma de farmacist, eliberata de o instituție de învățământ superior medico-farmaceutic acreditata din România;
b) certificatul de farmacist specialist, eliberat de Ministerul Sănătății Publice;
c) diploma, certificatul sau un alt titlu de farmacist, eliberate conform normelor Uniunii Europene de statele membre ale Uniunii Europene, statele aparținând Spațiului Economic European sau de Conferința Elvetiana;
d) diploma, certificatul sau un alt titlu de farmacist, dobândite într-un stat terț și recunoscute de unul dintre statele membre prevăzute la lit. c) ori echivalate în România.
Art. 555 - (1) Titlurile oficiale de calificare în profesia de farmacist, obținute în afară României, a statelor membre ale Uniunii Europene, a statelor aparținând Spațiului Economic European sau a Confederatiei Elvetiene, se echivaleaza potrivit legii.
(2) Excepție de la prevederile alin. (1) fac titlurile oficiale de calificare în profesia de farmacist care au fost recunoscute de unul dintre aceste state.
Art. 556 - Monitorizarea și controlul exercitării profesiei de farmacist se realizează de Colegiul Farmacistilor din România și de Ministerul Sănătății Publice, denumite în continuare autorități competente române.
Art. 557 - (1) Profesia de farmacist este profesie independenta și se exercită pe baza certificatului de membru al Colegiului Farmacistilor din România, în regim salarial și/sau independent, cu respectarea prevederilor prezentei legi.
(2) Profesia de farmacist se exercită pe bază de contract de muncă și/sau contract de furnizare de servicii farmaceutice. Profesia de farmacist se exercită în regim independent, după înregistrarea la administrația financiară din raza de domiciliu.
(3) În timpul exercitării profesiei, farmacistul nu este funcționar public.
(4) Apărarea principiilor prevăzute la alin. (1) este asigurata de Colegiul Farmacistilor din România.
Art. 558 - (1) Exercitarea profesiei de farmacist se realizează prin următoarele activități:
a) prepararea formelor farmaceutice ale medicamentelor;
b) fabricarea și controlul medicamentelor;
c) controlul medicamentelor într-un laborator pentru controlul medicamentelor;
d) depozitarea, conservarea și distribuirea medicamentelor en gros;
e) prepararea, controlul, depozitarea și distribuția medicamentelor în farmacii deschise publicului;
f) prepararea, controlul, depozitarea și eliberarea medicamentelor din farmaciile de spital;
g) acordarea de informații și consultanța privind medicamentele.
(2) Farmacistul, în conformitate cu pregătirea sa universitară, este competent sa exercite și alte activități profesionale precum:
a) colaborare cu medicul pentru stabilirea și urmărirea terapiei pacientului;
b) farmacovigilenta;
c) fabricarea, controlul, depozitarea, conservarea și distribuția produselor din plante, suplimentelor nutritive, produselor igieno-cosmetice, dispozitivelor medicale, medicamentelor de uz veterinar, substanțelor farmaceutice active și auxiliare;
d) analize în laboratoare de biochimie, toxicologie și igiena a mediului și alimentelor;
e) marketing și management farmaceutic;
f) activități didactice sau administrație sanitară.
(3) În toate activitățile prevăzute la alin. (1) farmacistul are deplina răspundere și drept de decizie.
Art. 559 - (1) În exercitarea profesiei farmacistul trebuie să dovedească profesionalism, devotament, corectitudine, disponibilitate și respect față de persoana care i se adresează pentru obținerea serviciilor farmaceutice necesare.
(2) La absolvirea instituției de învățământ din România farmacistul va depune următorul jurământ:
„În întreaga mea activitate de farmacist voi da dovada de o atitudine profund umană față de om și colectivitate.
Voi respecta demnitatea și personalitatea bolnavului, exercitând profesiunea cu conștiinciozitate, respectând normele de etica și de deontologie farmaceutica.
Voi fi corect cu mine insumi și cu confratii mei, cărora le voi cere colaborarea, și nu voi refuza să le acord sprijinul, când mi se va cere, în interesul bolnavului.
Voi păstra secretele încredințate de pacienti, chiar și după decesul acestora.
Nu voi accepta sub nici un motiv ca activitatea mea de farmacist să fie utilizata împotriva sănătății și vieții omului.
Voi fi rabdator și înțelegator față de cel care, datorită bolii, nu-mi acorda respectul cuvenit.
Jur, pe onoare, în mod solemn și liber!”
Art. 560 - (1) Profesia de farmacist poate fi exercitată pe teritoriul României de persoanele prevăzute la art. 553, care îndeplinesc următoarele condiții:
a) dețin un titlu oficial de calificare în farmacie, prevăzut de lege;
b) nu se găsesc în vreunul dintre cazurile de nedemnitate sau incompatibilitate prevăzute de prezenta lege;
c) sunt apte din punct de vedere medical pentru exercitarea profesiei de farmacist;
d) sunt membri ai Colegiului Farmacistilor din România.
(2) Farmaciștii cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, stabiliți în România, precum și farmaciștii care întrunesc condițiile prevăzute la art. 553 lit. c) și e) au, în exercitarea profesiei, aceleași drepturi și obligații ca și farmaciștii cetățeni români, membri ai Colegiului Farmacistilor din România.
Art. 561 - (1) Profesia de farmacist se exercită în România cu titlul profesional corespunzător calificării profesionale însușite, după cum urmează:
a) farmacist;
b) farmacist specialist în una dintre specialitatile farmaceutice prevăzute de Nomenclatorul de specialități medicale, medico-dentare și farmaceutice pentru rețeaua de asistența medicală.
(2) Prevederile alin. (1) se aplică și cetățenilor unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, care dețin un titlu oficial de calificare în farmacie, precum și experienta profesională complementara prevăzută la art. 568, atunci când este cazul, și care exercită profesia în România.
Secţiunea a 2-a - Nedemnitati și incompatibilități
Art. 562 - Este nedemn sa exercite profesia de farmacist:
a) farmacistul care a fost condamnat definitiv prin hotărâre judecătorească pentru săvârșirea cu intenție a unei infracțiuni contra umanității sau vieții, în împrejurări legate de exercitarea profesiei de farmacist, și pentru care nu a intervenit reabilitarea;
b) farmacistul căruia i s-a aplicat pedeapsa interdicției de a exercita profesia, pe durata stabilită prin hotărâre judecătorească definitivă sau disciplinară.
Art. 563 - (1) Exercitarea profesiei de farmacist este incompatibilă cu:
a) profesia de medic;
b) oricare ocupație de natura a aduce atingere demnității profesiei de farmacist sau bunelor moravuri, conform Codului deontologic al farmacistului;
c) starea de sănătate fizica sau psihică necorespunzătoare pentru exercitarea profesiei de farmacist.
(2) În termen de 10 zile de la nașterea situației de incompatibilitate, farmacistul este obligat sa anunțe colegiul al cărui membru este.
(3) Președintele colegiului din care face parte farmacistul poate desemna o comisie special constituită pentru fiecare caz în parte, alcătuită din 3 farmacisti primari, pentru a confirma sau a infirma situația de incompatibilitate prevăzută la alin. (1) lit. a) și b). În cazurile prevăzute la alin. (1) lit. c), acesta poate solicita organelor în drept confirmarea sau infirmarea stării de incompatibilitate.
(4) Pe timpul stării de incompatibilitate se suspenda de drept calitatea de membru al Colegiului Farmacistilor din România și dreptul de exercițiu al profesiei.
Secţiunea a 3-a - Autorizarea exercitării profesiei de farmacist
Art. 564 - (1) Farmaciștii care întrunesc condițiile prevăzute la art. 553 exercita profesia pe baza certificatului de membru al Colegiului Farmacistilor din România, avizat anual pe baza asigurării de răspundere civilă, pentru greșeli în activitatea profesională, valabilă pentru anul respectiv.
(2) Certificatul de membru al Colegiului Farmacistilor din România are valabilitate pe toată durata de exercitare a profesiei, în cazul în care nu intervin situațiile prevăzute la art. 562 și 563 sau nu se produc abateri sancționate de lege cu suspendarea sau interdicția exercitării profesiei.
(3) Certificatul de membru al Colegiului Farmacistilor din România se acordă pe baza următoarelor acte:
a) documentele care atesta formarea în profesie;
b) certificatul de sănătate;
c) declarația pe propria răspundere privind îndeplinirea condițiilor prevăzute la art. 562 și 563;
d) certificatul de cazier judiciar.
(4) Certificatul de membru devine operativ numai după încheierea asigurării de răspundere civilă pentru greșeli în activitatea profesională.
Art. 565 - (1) Farmaciștii se pensionează la vârsta prevăzută de lege.
(2) În unitățile sanitare publice farmaciștii membri titulari și corespondenti ai Academiei Române, profesori universitari, cercetători științifici gradul I, doctori în științe farmaceutice care desfășoară activități farmaceutice pot continua, la cerere, activitatea, până la împlinirea vârstei de 70 de ani.
(3) Farmaciștii care au depășit limita de vârsta prevăzută la alin. (1) pot profesa în continuare în unități sanitare private. Desfășurarea activității se face în baza certificatului de membru și a avizului anual al Colegiului Farmacistilor din România, eliberat pe baza certificatului de sănătate și a asigurării de răspundere civilă pentru greșeli în activitatea profesională, încheiată pentru anul respectiv.
(4) În cazul unităților sanitare publice care înregistrează deficit de farmacisti, precum și al unităților sanitare publice aflate în zone defavorizate, farmaciștii își pot continua activitatea peste vârsta de pensionare prevăzută de lege. Criteriile de menținere în activitate în aceste situații se stabilesc prin norme aprobate prin hotărâre a Guvernului.
(5) Farmaciștii care au împlinit vârsta de pensionare prevăzută de lege nu pot deține funcții de conducere în cadrul Ministerului Sănătății Publice, al ministerelor și instituțiilor centrale cu rețea sanitară proprie, al autorităților de sănătate publică, al Casei Naționale de Asigurări de Sănătate, al caselor județene de asigurări de sănătate, respectiv a municipiului București, precum și în cadrul spitalelor publice și al oricărei alte unități sanitare publice.
Art. 566 - În farmaciile de spital farmacistul este autorizat sa elibereze medicamente numai pentru secțiile spitalului.
Capitolul II - Dispoziții privind exercitarea profesiei de farmacist pe teritoriul României de către farmaciștii cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene
Secţiunea 1 - Dispoziții privind dreptul utilizării titlului de formare
Art. 567 - (1) Farmaciștii cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, care exercită profesia de farmacist în România, au dreptul de a atașa, la titlul profesional prevăzut la art. 561, titlul licit de formare obținut în statul membru de origine sau de proveniență în limba acelui stat și, eventual, abrevierea lui. titlul licit de formare va fi însoțit de numele și locul instituției sau ale organului emitent.
(2) Dacă titlul respectiv de formare desemnează în România o pregătire complementara neinsusita de beneficiar, acesta va utiliza, în exercițiul profesiei, forma corespunzătoare a titlului, indicată de autoritățile competente române.
Art. 568 - În cazul în care accesul la una dintre activitățile prevăzute la art. 558 sau exercitarea acesteia necesita, în afară titlului oficial de calificare de farmacist prevăzut de lege, și o experienta profesională complementara, autoritățile competente române recunosc certificatul emis de statul membru de origine sau de proveniență a posesorului, prin care se atesta ca acesta a desfășurat activitatea în cauza în acel stat pentru o perioadă de timp echivalenta cu cea prevăzută de legislația română pentru activitatea în cauza.
Secţiunea a 2-a - Dispoziții privind facilitarea exercitării dreptului de stabilire
Art. 569 - (1) Solicitarile farmacistilor cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene cu privire la accesul în România la una dintre activitățile farmaceutice se soluționează de către Ministerul Sănătății Publice, în colaborare cu Colegiul Farmacistilor din România, în termen de 3 luni de la data depunerii dosarului complet de către cel interesat. Aceștia primesc certificatul de membru al Colegiului Farmacistilor din România în urma aplicării procedurii de recunoaștere a calificării profesionale.
(2) Dosarul prevăzut la alin. (1) cuprinde următoarele documente:
a) copia documentului de cetățenie;
b) copia titlurilor oficiale de calificare în farmacie prevăzute de lege;
c) certificatul emis de autoritățile competente ale statului membru de origine sau proveniență, prin care se atesta ca titlurile oficiale de calificare sunt cele prevăzute de Directiva 2005/36/CE;
d) certificatul de sănătate fizica și psihică emis de statul membru de origine sau proveniență;
e) dovada emisă de statul membru de origine sau proveniență, prin care se atesta onorabilitatea și moralitatea posesorului;
f) dovada de asigurare privind răspunderea civilă pentru greșeli în activitatea profesională, emisă de instituțiile abilitate din unul dintre statele membre prevăzute la alin. (1).
(3) Documentele prevăzute la alin. (2) lit. d)-f) sunt valabile 3 luni de la data emiterii.
Art. 570 - (1) În situația în care pentru accesul și exercițiul activității prevăzute la art. 569 alin. (1) statul membru de origine sau proveniență nu impune o astfel de cerința și, în consecința, nu emite cetățenilor săi documentul prevăzut la art. 569 alin. (2) lit. d), autoritățile competente române accepta din partea acestuia un atestat echivalent certificatului de sănătate.
(2) În cazul în care statul membru de origine sau proveniență nu impune o astfel de cerința și, în consecința, nu emite cetățenilor săi documentul prevăzut la art. 569 alin. (2) lit. e), autoritățile competente române accepta atestatul eliberat pe baza declarației sub jurământ sau a declarației solemne a solicitantului de către autoritatea judiciară sau administrativă competența sau, după caz, de notarul sau organizația profesională abilitata în acest sens de acel stat.
Art. 571 - (1) În termen de 30 de zile de la primirea dosarului, Ministerul Sănătății Publice informează solicitantul asupra documentelor necesare completării acestuia.
(2) Deciziile autorităților competente române în aceste cazuri pot fi atacate la instanța de contencios administrativ.
Art. 572 - Farmaciștii cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, stabiliți în România și care, în timpul exercitării profesiei, încalcă dispozițiile, legile și regulamentele profesiei, răspund potrivit legii.
Art. 573 - (1) Atunci când autoritățile competente române au cunoștința de fapte grave și precise care pot avea repercusiuni asupra începerii activității profesionale sau asupra exercitării profesiei de farmacist în România, comise de farmaciștii cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, anterior stabilirii în România și în afară teritoriului sau, acestea informează statul de origine sau de proveniență a celor în cauza.
(2) Autoritățile competente române comunică statului membru gazda informațiile solicitate cu privire la sancțiunile disciplinare de natura profesională sau administrativă, precum și cu privire la sancțiunile penale interesand exercițiul profesiei de farmacist, aplicate farmacistilor pe durata exercitării profesiei în România.
(3) Autoritățile competente române analizează informațiile transmise de statul membru gazda cu privire la faptele grave și precise comise de farmaciștii cetățeni români sau care provin din România, anterior stabilirii acestora în statul membru gazda și în afară teritoriului sau, fapte care pot avea repercusiuni asupra începerii activității profesionale sau asupra exercitării profesiei de farmacist în acel stat.
(4) Autoritățile competente române decid asupra naturii și amplorii investigatiilor pe care le întreprind în situațiile pentru care au fost sesizate și comunică statului membru gazda consecințele care rezultă cu privire la atestatele și documentele pe care le-au emis în cazurile respective.
Art. 574 - (1) Autoritățile competente române colaborează îndeaproape cu autoritățile competente omoloage ale statelor membre ale Uniunii Europene, ale statelor aparținând Spațiului Economic European și, respectiv, ale Confederatiei Elvetiene, asigurând confidențialitatea informațiilor transmise.
(2) Schimbul de informații privind sancțiunile disciplinare sau penale aplicate în caz de fapte grave și precise, susceptibile de a avea consecințe asupra activităților de farmacist, se va face cu respectarea prevederilor Legii nr. 506/2004 privind prelucrarea datelor cu caracter personal și protecția vieții private în sectorul comunicațiilor electronice și a prevederilor Legii nr. 677/2001 pentru protecția persoanelor cu privire la prelucrarea datelor cu caracter personal și libera circulație a acestor date, cu modificările și completările ulterioare.
Art. 575 - (1) Farmaciștii cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, care exercită profesia de farmacist în România, au obligația de a se informa la autoritățile competente cu privire la legislația care reglementează sectorul de sănătate, domeniul securității sociale, precum și cu privire la Codul deontologic al farmacistului.
(2) În vederea furnizarii informațiilor prevăzute la alin. (1), autoritățile competente române vor organiza la nivelul structurilor teritoriale și centrale birouri de informare legislativă.
(3) Farmaciștii cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, care exercită profesia ca urmare a recunoașterii calificării profesionale de către autoritățile competente române, trebuie să posede cunoștințele lingvistice necesare desfășurării activităților profesionale în România.
Capitolul III - Organizarea și funcționarea Colegiului Farmacistilor din România
Secţiunea 1 - Dispoziții generale
Art. 576 - (1) Colegiul Farmacistilor din România este organism profesional, apolitic, fără scop patrimonial, de drept public, cu responsabilități delegate de autoritatea de stat, în domeniul autorizării, controlului și supravegherii profesiei de farmacist ca profesie liberala, de practica publică autorizata.
(2) Colegiul Farmacistilor din România are autonomie instituțională în domeniul sau de competența, normativ și jurisdicțional profesional.
(3) Ministerul Sănătății Publice urmărește modul de respectare a prevederilor legale în activitatea Colegiului Farmacistilor din România.
(4) Colegiul Farmacistilor din România cuprinde toți farmaciștii care întrunesc condițiile prevăzute la art. 553 lit. a), c) și e), precum și farmaciștii stabiliți în România care întrunesc condițiile prevăzute la art. 553 lit. b), d) și f) și care exercită profesia de farmacist în condițiile prezentei legi și sunt înregistrați la colegiile teritoriale.
Art. 577 - Colegiul Farmacistilor din România se organizează și funcționează pe criterii teritoriale, la nivel național și județean, respectiv la nivelul municipiului București.
Art. 578 - (1) Între Colegiul Farmacistilor din România și colegiile teritoriale exista raporturi de autonomie funcțională, organizatorică și financiară, în condițiile legii.
(2) Sediul Colegiului Farmacistilor din România este în municipiul București.
Secţiunea a 2-a - Atribuțiile Colegiului Farmacistilor din România
Art. 579 - Colegiul Farmacistilor din România are următoarele atribuții:
a) colaborează în domeniul sau de competența cu Ministerul Sănătății Publice prin asigurarea controlului aplicării regulamentelor și normelor care organizează și reglementează exercitarea profesiei de farmacist, indiferent de forma de exercitare și de unitatea farmaceutica în care se desfășoară;
b) apara demnitatea și promovează drepturile și interesele membrilor săi în toate sferele de activitate; apara onoarea, libertatea și independenta profesională a farmacistului, precum și dreptul acestuia de decizie în exercitarea actului profesional; asigura respectarea de către farmacisti a obligațiilor ce le revin față de pacient și de sănătatea publică;
c) atesta onorabilitatea și moralitatea profesională a membrilor săi;
d) întocmește și actualizează permanent Registrul unic al farmacistilor din România, administrează pagina de Internet de publicare a acestuia și înaintează trimestrial Ministerului Sănătății Publice un raport privind situația numerică a membrilor săi, precum și a evenimentelor înregistrate în domeniul autorizării, controlului și supravegherii profesiei de farmacist;
e) elaborează și adopta Regulamentul de organizare și funcționare a Colegiului Farmacistilor din România și Codul deontologic al farmacistului;
f) colaborează în domeniul sau de competența cu Ministerul Sănătății Publice la formarea, specializarea și perfecționarea pregătirii profesionale a farmacistilor;
g) avizează, conform regulamentelor de organizare și funcționare a unităților farmaceutice, fișa de atribuții a postului de farmacist, întocmită obligatoriu la nivelul fiecărei farmacii;
h) colaborează cu Ministerul Sănătății Publice în vederea stabilirii și creșterii standardelor de practica profesională, a asigurării calității actului farmaceutic în unitățile farmaceutice;
i) colaborează cu Ministerul Sănătății Publice și participa, prin reprezentanții săi, la activitatea de inspecție farmaceutica organizată de acesta, inclusiv pe bază de tematici comune de inspecție și control;
j) colaborează cu Ministerul Sănătății Publice la elaborarea metodologiei de acordare a gradului profesional și a tematicii de concurs;
k) inițiază, promovează, organizează și acreditează în domeniul sau de competența forme de educație farmaceutica continua și de ridicare a gradului de competența profesională a membrilor săi, cu excepția programelor de studii complementare în vederea obținerii de atestate;
l) controlează modul în care sunt respectate de către angajatori independenta profesională și dreptul de decizie profesională ale farmacistului;
m) reprezintă și apara în domeniul sau de competența interesele membrilor, la solicitarea acestora, în fața angajatorilor;
n) promovează și stabilește relații pe plan extern cu instituții și organizații similare;
o) colaborează în domeniul sau de competența cu Ministerul Sănătății Publice la elaborarea reglementărilor profesiei de farmacist;
p) organizează judecarea cazurilor de încălcare a normelor de deontologie profesională ori a celor care reglementează exercitarea profesiei sau a actului profesional;
q) organizează centre de pregătire lingvistica, necesare pentru exercitarea activității profesionale de către farmaciștii cetățeni ai statelor membre ale Uniunii Europene, ai statelor aparținând Spațiului Economic European sau ai Confederatiei Elvetiene;
r) colaborează în domeniul sau de competența cu Ministerul Sănătății Publice, organizații patronale și sindicale, precum și cu alte asociații ori cu organizații neguvernamentale, în toate problemele ce privesc asigurarea sănătății populației.
Art. 580 - În exercitarea atribuțiilor prevăzute de prezentul titlu, Colegiul Farmacistilor din România, prin structurile naționale sau teritoriale, are dreptul de a formula acțiune în justiție în nume propriu sau în numele membrilor săi.
Secţiunea a 3-a - Membrii Colegiului Farmacistilor din România
Art. 581 - (1) În vederea exercitării profesiei de farmacist, farmaciștii cetățeni români și farmaciștii cetățeni ai unui stat membru al Uniunii Europene, ai unui stat aparținând Spațiului Economic European sau ai Confederatiei Elvetiene, stabiliți în România, precum și farmaciștii care întrunesc condițiile prevăzute la art. 553 lit. c) și e) au obligația să se înscrie în Colegiul Farmacistilor din România.
(2) La data intrării în vigoare a prezentei legi au de drept calitatea de membru al Colegiului Farmacistilor din România toți farmaciștii înscriși până la acea data.
(3) Calitatea de membru al Colegiului Farmacistilor din România o pot păstra, la cerere, și farmaciștii pensionari care au practicat profesia de farmacist.
(4) Membrii Colegiului Farmacistilor din România sunt înscriși în Registrul unic al farmacistilor din România, care se publică pe pagina de Internet a Colegiului Farmacistilor din România.
Art. 582 - (1) La cerere, membrii Colegiului Farmacistilor din România care, din motive obiective, întrerup pe o durată de până la 5 ani exercitarea profesiei de farmacist pot solicita suspendarea calității de membru pe acea durata.
(2) Pe durata suspendării la cerere a calității de membru al Colegiului Farmacistilor din România se suspenda obligațiile și drepturile ce decurg din prezenta lege.
(3) Întreruperea exercitării profesiei de farmacist pe o durată mai mare de 5 ani atrage, de drept, pierderea calității de membru al Colegiului Farmacistilor din România.
(4) O noua înscriere se poate face numai în condițiile prezentei legi și cu avizul favorabil al Consiliului național al Colegiului Farmacistilor din România.
Art. 583 - Farmaciștii care doresc sa exercite profesia se înscriu ca membri ai Colegiului Farmacistilor din România la colegiul teritorial în raza căruia se afla unitatea la care își desfășoară activitatea sau la colegiul teritorial în raza căruia își au domiciliul sau reședința, dacă nu au încă un loc de muncă.
Secţiunea a 4-a - Drepturile și obligațiile membrilor Colegiului Farmacistilor din România
Art. 584 - Membrii Colegiului Farmacistilor din România au următoarele drepturi:
a) sa aleagă și să fie aleși în organele de conducere de la nivelul structurilor teritoriale sau naționale ale Colegiului Farmacistilor din România;
b) să se adreseze organelor abilitate ale Colegiului Farmacistilor din România și sa primească informațiile solicitate;
c) sa participe la orice acțiune a Colegiului Farmacistilor din România și să fie informati în timp util despre aceasta;
d) sa folosească, împreună cu membrii săi de familie, toate dotările sociale, profesionale, culturale și sportive ale Colegiului Farmacistilor din România și ale colegiilor locale;
e) sa poarte însemnele Colegiului Farmacistilor din România;
f) sa conteste sancțiunile primite;
g) să solicite ajutoare materiale pentru situații deosebite, atât personal, cat și prin membrii lor de familie.
Art. 585 - Obligațiile membrilor Colegiului Farmacistilor din România sunt următoarele:
a) să respecte dispozițiile Regulamentului de organizare și funcționare a Colegiului Farmacistilor din România, Codul deontologic al farmacistului, hotărârile organelor de conducere ale Colegiului Farmacistilor din România și regulamentele profesiei;
b) sa rezolve sarcinile ce le-au fost încredințate în calitate de membri sau reprezentanți ai corpului profesional;
c) sa participe la manifestările inițiate de organele de conducere, la activitățile profesionale ori de pregătire profesională inițiate ori organizate de către organele de conducere naționale sau locale;
d) sa participe la ședințele ori adunările la care au fost convocați;
e) să execute cu buna-credința sarcinile ce decurg din hotărârile organelor de conducere ale corpului profesional;
f) să se abțină de la deliberările organelor de conducere în care sunt aleși, în cazul în care, în îndeplinirea unor atribuții ale acestor organe, au un interes propriu;
g) sa păstreze secretul profesional;
h) să respecte normele, principiile și îndatoririle deontologiei profesionale și să aibă un comportament demn în exercitarea profesiei ori a calității de membru al Colegiului Farmacistilor din România;
i) sa achite, în termenul stabilit, cotizatia datorată în calitate de membru al Colegiului Farmacistilor din România;
j) sa rezolve litigiile cu alți membri, în primul rând prin intermediul medierii de către comisiile de specialitate din cadrul Colegiului Farmacistilor din România;
k) să execute cu buna-credința atribuțiile ce le revin în calitate de reprezentant sau membru în organele de conducere ale Colegiului Farmacistilor din România, ale colegiilor județene, respectiv al municipiul București.
Art. 586 - Obligațiile membrilor Colegiului Farmacistilor din România, ce decurg din calitatea lor specială de farmacisti, sunt următoarele:
a) să respecte și să aplice în orice împrejurare normele de deontologie farmaceutica;
b) sa nu aducă prejudicii reputației corpului profesional sau altor membri, respectând statutul de corp profesional al Colegiului Farmacistilor din România;
c) sa acționeze, pe toată durata exercitării profesiei, în vederea creșterii gradului de pregătire profesională și cunoașterii noutatilor profesionale;
d) să respecte drepturile legale ale pacientilor;
e) sa acorde, cu promptitudine, asistența farmaceutica de urgenta, ca o îndatorire fundamentală, profesională și civică.
Art. 587 - (1) În vederea creșterii gradului de pregătire profesională și asigurării unui nivel ridicat al cunoștințelor profesionale, farmaciștii sunt obligați să urmeze un număr de cursuri de pregătire și alte forme de educație continua și informare în domeniul stiintelor profesionale, pentru cumularea numărului de credite stabilit în acest sens de către Colegiul Farmacistilor din România. Sunt creditate programele, precum și celelalte forme de educație farmaceutica continua avizate de Colegiul Farmacistilor din România.
(2) Farmaciștii care nu realizează pe parcursul a 3 ani numărul minim de credite de educație profesională continua stabilit de Consiliul Național al Colegiului Farmacistilor din România sunt suspendați din exercițiul profesiei, până la realizarea numărului de credite respectiv.
Secţiunea a 5-a - Organizarea și funcționarea
A. Organizarea la nivel teritorial
Art. 588 - (1) La nivelul fiecărui județ, respectiv al municipiului București, se organizează câte un colegiu al farmacistilor, format din toți farmaciștii care exercită profesia în unitatea administrativ-teritorială respectiva.
(2) Colegiile farmacistilor au personalitate juridică, patrimoniu și buget propriu.
(3) Personalitatea juridică se dobândește de la data constituirii și înregistrării la administrația financiară în raza căreia se afla sediul instituției.
(4) Sediul colegiului este în orașul de reședința a județului, respectiv în municipiul București, pentru Colegiul Farmacistilor București.
(5) Nici un colegiu teritorial nu poate funcționa în afară Colegiului Farmacistilor din România.
Art. 589 - Organele de conducere ale colegiului teritorial sunt:
a) adunarea generală a farmacistilor;
b) consiliul;
c) biroul consiliului;
d) președintele.
Art. 590 - (1) Adunarea generală este formată din toți farmaciștii înscriși în colegiul teritorial respectiv.
(2) Adunarea generală se întrunește anual, în primul trimestru, la convocarea consiliului, și adopta hotărâri cu majoritate simpla, în prezenta a două treimi din numărul membrilor săi. Dacă la prima convocare nu s-a realizat majoritatea de două treimi, după 10 zile se organizează o noua ședința, cu aceeași ordine de zi, care va adopta hotărâri indiferent de numărul membrilor prezenți, dar nu mai puțin de jumătate plus unu din totalul membrilor.
(3) Adunarea generală are următoarele atribuții:
a) aproba proiectul de buget al colegiului și, în baza raportului cenzorilor, descarca de gestiune consiliul pentru anul fiscal încheiat;
b) alege, dintre membrii săi, consiliul colegiului și reprezentanții în Adunarea generală naționala a Colegiului Farmacistilor din România;
c) stabilește indemnizația de ședința a membrilor comisiei de disciplina;
d) alege comisia de cenzori a colegiului.
Art. 591 - (1) Membrii consiliului structurilor teritoriale și reprezentanții în Adunarea generală naționala se aleg pe o perioadă de 4 ani de către adunările generale teritoriale prin vot secret și în condițiile participării a minimum două treimi din numărul membrilor adunării generale.
(2) Dacă la adunarea de alegeri nu se realizeza condiția de participare, după doua săptămâni se va organiza un nou scrutin care va alege reprezentanții, indiferent de numărul participanților.
Art. 592 - (1) Colegiul colegiului are un număr de membri proporțional cu numărul farmacistilor înscriși în evidenta colegiului la data organizării alegerilor, după cum urmează:
a) 7 membri, pentru un număr de până la 100 de farmacisti înscriși;
b) 11 membri, pentru un număr de 101 până la 500 de farmacisti înscriși;
c) 13 membri, pentru un număr de 501 până la 1.000 de farmacisti înscriși;
d) 19 membri, pentru un număr de peste 1.000 de farmacisti înscriși.
(2) Consiliul județean sau al municipiului București, după caz, are un număr de 3-11 membri supleanți, aleși de adunarea generală.
Art. 593 - Consiliul colegiului teritorial exercita atribuțiile prevăzute de lege și date în competența sa prin Statutul Colegiului Farmacistilor din România sau prin hotărârea Consiliului național.
Art. 594 - (1) Consiliul colegiului teritorial, în prima ședința organizată în termen de maximum 5 zile de la alegere, alege biroul consiliului.
(2) Biroul consiliului este format dintr-un președinte, 3 vicepreședinți și un secretar.
B. Organizarea la nivel național
Art. 595 - (1) Colegiul Farmacistilor din România este format din toți farmaciștii înscriși în colegiile teritoriale.
(2) Colegiul Farmacistilor din România are personalitate juridică, patrimoniu și buget propriu. Bugetul se formează din contribuția colegiilor teritoriale, în cote stabilite de Consiliul național. Patrimoniul poate fi folosit și în activități producătoare de venituri, în condițiile legii.
Art. 596 - Organele de conducere, la nivel național, ale Colegiului Farmacistilor din România sunt:
a) Adunarea generală naționala;
b) Consiliul național;
c) Biroul executiv;
d) președintele.
Art. 597 - (1) Adunarea generală naționala este alcătuită din președinții colegiilor teritoriale și reprezentanți aleși de adunările generale locale prin vot direct și secret.
(2) Norma de reprezentare în adunarea generală este de 1/50 de membri.
(3) Reprezentanții în adunarea generală sunt aleși pe o durată de 4 ani.
(4) Proporțional cu numărul de farmacisti înscriși în evidenta colegiului teritorial, se vor alege 3-11 membrii supleanți.
Art. 598 - Adunarea generală naționala are următoarele atribuții:
a) adopta Statutul Colegiului Farmacistilor din România, precum și Codul deontologic al farmacistului;
b) aproba modificarea acestora;
c) aproba bugetul de venituri și cheltuieli și execuția celui pentru exercițiul financiar expirat;
d) alege, dintre membrii săi, comisia de cenzori;
e) adopta declarații care să reflecte poziția Colegiului Farmacistilor din România cu privire la aspecte de interes general în ceea ce privește profesia de farmacist ori statutul farmacistului în societate;
f) revoca din funcție membri aleși, pentru abateri de la prevederile prezentei legi și, respectiv, ale Regulamentului de organizare și funcționare a Colegiului Farmacistilor din România, care aduc prejudicii activității organismului profesional.
Art. 599 - (1) Adunarea generală naționala adopta hotărâri în prezenta a cel puțin două treimi din numărul membrilor săi, cu majoritate simpla de voturi.
(2) Dacă la prima convocare nu se realizează condiția de cvorum, după doua săptămâni se va organiza o alta ședința, cu aceeași ordine de zi, care va putea adopta hotărâri indiferent de numărul membrilor prezenți, cu excepția situațiilor prevăzute la art. 598 lit. a) și b), pentru care este necesară condiția de cvorum prevăzută de lege.
(3) Adunarea generală naționala se întrunește în ședința ordinară în primul trimestru al anului în curs.
Art. 600 - Adunarea generală naționala este condusă de președintele Colegiului Farmacistilor din România.
Art. 601 - (1) Consiliul național al Colegiului Farmacistilor din România este alcătuit din președinții colegiilor teritoriale, 3 reprezentanți ai Colegiului Farmacistilor din București, respectiv președintele și 2 vicepreședinți, un reprezentant numit de Ministerul Sănătății Publice ca autoritate de stat și câte un reprezentant al farmacistilor din fiecare minister ori instituție centrala cu rețea sanitară proprie. Consiliul național al Colegiului Farmacistilor din România poate fi asistat, cu rol consultativ, de către un reprezentant al Academiei de Științe Medicale, al Ministerului Muncii, Solidarității Sociale și Familiei și al Ministerului Justiției.
(2) Cheltuielile de deplasare și diurna reprezentanților în Consiliul național al Colegiului Farmacistilor din România vor fi suportate de către colegiile teritoriale ai căror reprezentanți sunt.
(3) Consilul național al Colegiului Farmacistilor din România se întrunește legal în prezenta a cel puțin două treimi din numărul reprezentanților prevăzuți la alin. (1).
Art. 602 - Consiliul național lucrează în prezenta a două treimi din numărul membrilor cu drept de vot și decide cu o majoritate absolută de voturi, cu excepția deciziilor referitoare la cotizatie, pentru care sunt necesare voturile favorabile a două treimi din numărul total al membrilor.
Art. 603 - Deciziile Consiliului național al Colegiului Farmacistilor din România sunt obligatorii pentru colegiile teritoriale și pentru toți farmaciștii care practica profesia de farmacist în România.
Art. 604 - Atribuțiile Consiliului național sunt următoarele:
a) elaborează Statutul Colegiului Farmacistilor din România, precum și proiectele de modificare a acestuia;
b) elaborează Codul deontologic al farmacistului, precum și proiectele de modificare a acestuia;
c) colaborează cu Ministerul Sănătății Publice la elaborarea Nomenclatorului de specialități medicale, medico-dentare și farmaceutice pentru rețeaua de asistența medicală;
d) colaborează cu Ministerul Sănătății Publice la elaborarea tematicilor, metodologiilor, concursurilor și examenelor pentru farmacisti;
e) stabilește sistemul de credite de educație continua, pe baza căruia se evalueaza activitatea de perfecționare profesională a farmacistilor;
f) colaborează cu Ministerul Sănătății Publice la elaborarea normelor privind exercitarea profesiei de farmacist pe teritoriul României;
g) colaborează cu Ministerul Sănătății Publice și Ministerul Educației și Cercetării la elaborarea strategiei și programelor privind dezvoltarea învățământului farmaceutic;
h) fixează cotizatia care trebuie plătită obligatoriu de către fiecare farmacist consiliului județean sau al municipiului București, stabilind partea din aceasta cotizatie care trebuie virata către Consiliul național al Colegiului Farmacistilor din România;
i) gestionează bunurile Colegiului Farmacistilor din România și poate să creeze și sa subventioneze acțiuni interesand profesiunea, acțiuni de întrajutorare sau de sponsorizare;
j) soluționează, prin comisiile de specialitate ale Colegiului Farmacistilor din România, în termen de 30 de zile de la înregistrare, contestațiile formulate împotriva deciziilor date de consiliile județene, respectiv al municipiului București, în conformitate cu regulamentele proprii;
k) alege, dintre membrii săi, Biroul executiv al Colegiului Farmacistilor din România;
l) propune Adunării generale naționale proiectul privind bugetul de venituri și cheltuieli al Colegiului Farmacistilor din România;
m) alege, dintre membrii săi, pe cei care vor forma comisiile de lucru;
n) stabilește indemnizațiile membrilor Biroului executiv și indemnizația de ședința a membrilor Comisiei superioare de disciplina;
o) avizează reînscrierea farmacistilor care au pierdut calitatea de membru al Colegiului Farmacistilor din România, conform Codului deontologic al farmacistului.
Art. 605 - (1) Consiliul național stabilește, în domeniul sau de competența, strategia și planul anual de control și supraveghere a modului de exercitare a profesiei de farmacist, precum și condițiile în care se desfășoară aceasta.
(2) Reprezentanții Colegiului Farmacistilor din România, anume desemnați, au dreptul de a desfășura activități de control și supraveghere privind modul de exercitare a profesiei de farmacist în toate unitățile farmaceutice din România.
Art. 606 - Biroul executiv al Colegiului Farmacistilor din România este format dintr-un președinte, 3 vicepreședinți și un secretar general, aleși în mod individual de către Consiliul național dintre membrii săi.
Art. 607 - Atribuțiile Biroului executiv sunt următoarele:
a) asigura activitatea permanenta a Colegiului Farmacistilor din România între ședințele Consiliului național;
b) aproba angajarea de personal și asigura execuția bugetului Colegiului Farmacistilor din România;
c) întocmește raportul anual de activitate și gestiune, pe care îl supune aprobării Consiliului național;
d) accepta donațiile, legatele și sponsorizarile făcute Colegiului Farmacistilor din România și le face publice în presa de specialitate;
e) executa hotărârile Adunării generale naționale și ale Consiliului național;
f) elaborează și supune spre avizare Consiliului național proiectul bugetului de venituri și cheltuieli, pe baza bugetelor de venituri și cheltuieli ale colegiilor teritoriale;
g) informează Consiliul național cu privire la deciziile emise între ședințele Consiliului;
h) îndeplinește orice alte sarcini stabilite de către Consiliul național.
Art. 608 - Biroul executiv coordonează activitatea comisiilor de lucru ale Consiliului național al Colegiului Farmacistilor din România.
Art. 609 - În exercitarea mandatului, membrii Biroului executiv, precum și membrii birourilor consiliilor colegiilor teritoriale vor primi o indemnizație lunară, al carei cuantum va fi aprobat, după caz, de Consiliul național, respectiv consiliile colegiilor teritoriale.
Art. 610 - Președintele Biroului executiv al Consiliului național este președintele Colegiului Farmacistilor din România.
Art. 611 - Atribuțiile președintelui Colegiului Farmacistilor din România sunt următoarele:
a) reprezintă Colegiul Farmacistilor din România în relațiile cu persoanele fizice și juridice din țara și din străinătate;
b) încheie contracte și convenții în numele Colegiului Farmacistilor din România, cu aprobarea Biroului executiv;
c) convoacă și conduce ședințele Adunării generale, ale Consiliului național;
d) aduce la îndeplinire deciziile Biroului executiv, hotărârile Consiliului național date în sarcina sa și rezolva problemele și lucrările curente;
e) angajează personalul de specialitate și administrativ;
f) îndeplinește orice alte sarcini încredințate de Consiliul național ori de Biroul executiv.
Art. 612 - (1) Nu pot primi sau exercita mandatul de membru al organelor de conducere ale Colegiului Farmacistilor din România, atât la nivel național, cat și teritorial, farmaciștii care dețin funcții de conducere în cadrul Ministerului Sănătății Publice, respectiv al ministerelor și instituțiilor cu rețea sanitară proprie, al structurilor deconcentrate ale acestuia ori în cadrul Casei Naționale de Asigurări de Sănătate, al caselor județene de asigurări de sănătate și a municipiului București, al patronatelor și sindicatelor profesionale, precum și orice fel de funcții de demnitate publică.
(2) Farmaciștii pentru care pe timpul exercitării mandatului de membru al organelor de conducere a survenit situația de incompatibilitate pierd de drept mandatul încredințat, urmând ca locul rămas vacant să fie ocupat, după caz, de primul membru aflat pe lista supleanților sau prin organizarea unei noi alegeri.
(3) Numărul de mandate în organele de conducere de la nivel teritorial și național este de maximum doua, care pot fi și consecutive.
Secţiunea a 6-a - Răspunderea disciplinară
Art. 613 - Farmacistul răspunde disciplinar pentru nerespectarea legilor și regulamentelor profesionale, a Codului deontologic al farmacistului și a regulilor de buna practica profesională, a Statutului Colegiului Farmacistilor din România, pentru nerespectarea deciziilor obligatorii adoptate de organele de conducere ale Colegiului Farmacistilor din România, precum și pentru orice fapte săvârșite în legătură cu profesia sau în afară acesteia, care sunt de natura sa prejudicieze onoarea și prestigiul profesiei sau ale Colegiului Farmacistilor din România.
Art. 614 - (1) În cazurile prevăzute la art. 613, plângerea împotriva unui farmacist se depune la colegiul al cărui membru este.
(2) Biroul consiliului, în baza anchetei disciplinare efectuate de către departamentul de jurisdicție profesională, poate decide:
a) respingerea plângerii ca vadit nefondata;
b) solicitarea completării anchetei disciplinare;
c) dispunerea trimiterii dosarului disciplinar la comisia de disciplina.
(3) Împotriva deciziei de respingere a plângerii persoana care a făcut plângerea poate depune contestație la colegiul a cărui decizie se contesta. Aceasta se soluționează de către Biroul executiv al Consiliului național.
Art. 615 - (1) În cadrul fiecărui colegiu teritorial se organizează și funcționează o comisie de disciplina, constituită din 3 membri, independenta de conducerea colegiului, care judeca abaterile disciplinare săvârșite de farmaciștii cuprinși în acel colegiu.
(2) În cadrul Colegiului Farmacistilor din România se organizează și funcționează Comisia superioară de disciplina.
(3) Procedura judecării abaterilor este prevăzută în Statutul Colegiului Farmacistilor din România, cu respectarea principiului egalității, a dreptului de apărare, precum și a principiului contradictorialității.
Art. 616 - (1) Membrii comisiilor de disciplina de la nivelul colegiului teritorial sunt aleși de către adunarea generală judeteana, respectiv de cea a municipiului București, iar membrii Comisiei superioare de disciplina vor fi aleși de către Adunarea generală naționala.
(2) Membrii comisiilor de disciplina vor fi aleși din rândul farmacistilor cu o vechime de peste 7 ani în profesie și care nu au avut abateri disciplinare în ultimii 5 ani.
(3) Funcția de membru al comisiei de disciplina este incompatibilă cu orice alta funcție în cadrul Colegiului Farmacistilor din România.
(4) Durata mandatului membrilor comisiilor de disciplina este de 4 ani.
(5) Unul dintre membrii comisiilor de disciplina este desemnat de autoritățile de sănătate publică, la nivel teritorial, și de către Ministerul Sănătății Publice, la nivelul Comisiei superioare de disciplina.
(6) Calitatea de membru al comisiilor de disciplina încetează prin deces, demisie, pierderea calității de membru al Colegiului Farmacistilor din România ori prin numirea unui alt reprezentant în cazul membrilor desemnați de către Ministerul Sănătății Publice sau autoritatea de sănătate publică.
Art. 617 - (1) Membrii comisiilor de disciplina se aleg prin vot secret și pe baza candidaturilor depuse.
(2) La nivel teritorial se va alege un număr de 3 membri, iar la nivel național 5 membri.
(3) Membrii comisiilor de disciplina își vor alege un președinte, care conduce activitatea administrativă a comisiilor de disciplina.
(4) Președintele comisiei de disciplina prezintă adunării generale raportul anual al activității comisiei de disciplina.
Art. 618 - (1) Sancțiunile disciplinare sunt:
a) mustrare;
b) avertisment;
c) vot de blam;
d) suspendarea calității de membru al Colegiului Farmacistilor din România pe o perioadă determinata, de la o luna la un an;
e) retragerea calității de membru al Colegiului Farmacistilor din România.
(2) Retragerea calității de membru al Colegiului Farmacistilor din România operează de drept pe durata stabilită de instanța de judecată prin hotărâre definitivă a instanței judecătorești, cu privire la interzicerea exercitării profesiei.
(3) La sancțiunile prevăzute la alin. (1) se poate prevedea, după caz, obligarea celui sancționat la efectuarea unor cursuri de perfecționare sau de educație farmaceutica ori altor forme de pregătire profesională.
Art. 619 - (1) Decizia comisiei de disciplina se comunică farmacistului cercetat disciplinar, persoanei care a făcut sesizarea, Ministerului Sănătății Publice, Biroului executiv al Colegiului Farmacistilor din România și persoanei cu care farmacistul sancționat are încheiat contractul de muncă.
(2) În termen de 15 zile de la comunicare, persoanele și autoritățile prevăzute la alin. (1) pot contesta la Comisia superioară de disciplina decizia pronunțată.
Art. 620 - (1) Acțiunea disciplinară poate fi pornită în termen de cel mult 6 luni de la data săvârșirii faptei sau data luării la cunoștința.
(2) Consecințele executării aplicării sancțiunilor prevăzute la art. 618 alin. (1) lit. a)-c) se radiază în termen de 6 luni de la data executării lor, iar cea prevăzută la art. 618 alin. (1) lit. d), în termen de un an de la data expirării perioadei de suspendare.
(3) În cazul aplicării sancțiunii prevăzute la art. 618 alin. (1) lit. e), farmacistul poate face o noua cerere de redobandire a calității de membru al colegiului, după expirarea perioadei stabilite de instanța judecătorească prin hotărâre penală definitivă, prin care s-a dispus interdicția exercitării profesiei, sau după 2 ani de la data aplicării sancțiunii de către comisia de disciplina. Redobandirea calității de membru al Colegiului Farmacistilor din România se face în condițiile legii.
(4) În situația în care prin decizia comisiei de disciplina au fost dispuse și măsurile prevăzute la art. 618 alin. (3), radierea sancțiunii se va face numai după prezentarea dovezii aducerii la îndeplinire a măsurii dispuse de comisia de disciplina.
(5) Repetarea unei abateri disciplinare până la radierea sancțiunii aplicate constituie circumstanță agravantă care va fi avută în vedere la aplicarea unei noi sancțiuni.
Art. 621 - (1) Ancheta disciplinară se exercită prin persoane desemnate de către biroul consiliului teritorial sau, după caz, de către Biroul executiv al Colegiului Farmacistilor din România.
(2) Unitățile sanitare sau farmaceutice au obligația de a pune la dispoziție comisiilor de disciplina sau persoanelor desemnate cu investigarea abaterii disciplinare documentele profesionale solicitate, precum și orice alte date și informații necesare soluționării cauzei.
Art. 622 - Decizia pronunțată de Comisia superioară de disciplina, precum și cea pronunțată de Consiliul național pot fi contestate la secția de contencios administrativ a tribunalului în a cărui circumscripție își desfășoară activitatea farmacistul sancționat, în termen de 30 de zile de la comunicare.
Secţiunea a 7-a - Venituri și cheltuieli
Art. 623 - Veniturile Colegiului Farmacistilor din România se constituie din:
a) taxa de înscriere;
b) cotizatii lunare ale membrilor;
c) contravaloarea serviciilor prestate membrilor sau persoanelor fizice și juridice;
d) donații și sponsorizări de la persoane fizice și juridice;
e) legate;
f) drepturi editoriale;
g) încasări din vânzarea publicațiilor proprii;
h) fonduri rezultate din manifestările culturale și științifice;
i) organizarea de cursuri de educație profesională continua;
j) alte surse.
Art. 624 - (1) Cotizațiile datorate și neplătite în termenul fixat de către consiliul teritorial de către membrii Colegiului Farmacistilor din România determina plata unor penalități de întârziere în cuantumul prevăzut de dispozițiile legale aplicabile instituțiilor publice.
(2) Aceeași măsura se va aplica și colegiilor teritoriale care nu vărsa partea de cotizatie stabilită de Consiliul național.
Art. 625 - (1) Neplata cotizatiei datorate de membrii Colegiului Farmacistilor din România pe o perioadă de 3 luni și după atenționarea scrisă a consiliului local se sancționează cu suspendarea calității de membru al Colegiului, până la plata cotizatiei datorate.
(2) Sancțiunea se aplică de către comisia locală de disciplina, la sesizarea comisiei administrative și financiar-contabile a colegiului teritorial.
Art. 626 - Pentru serviciile prestate persoanelor care nu sunt membre ale Colegiului Farmacistilor din România, tarifele se stabilesc, după caz, de către Consiliul național, respectiv consiliul colegiului teritorial.
Art. 627 - (1) Cuantumul cotizatiei de membru al Colegiului Farmacistilor din România, precum și partea din aceasta care trebuie vărsată către forurile naționale se stabilesc de către Consiliul național al Colegiului Farmacistilor din România.
(2) Partea din cotizatie aferentă funcționarii structurii naționale va fi virata până cel mai târziu la sfârșitul lunii următoare aceleia pentru care a fost percepută cotizatia.
Art. 628 - (1) Partea de cotizatie datorată Colegiului Farmacistilor din România de către consiliile colegiilor teritoriale se va vira către acesta înaintea altor plati.
(2) Obligația urmăririi și efectuării varsarii cotei aferente Colegiului Farmacistilor din România revine președintelui consiliului colegiului teritorial.
Art. 629 - Veniturile pot fi utilizate pentru cheltuieli cu organizarea și funcționarea, cheltuieli de personal, cheltuieli materiale și servicii, cheltuieli de capital, perfecționarea pregătirii profesionale, acordarea de burse prin concurs farmacistilor, intrajutorarea farmacistilor cu venituri mici, crearea de instituții cu scop filantropic și științific, alte cheltuieli aprobate, după caz, de consiliul colegiului teritorial, respectiv de Consiliul național.
Capitolul IV - Rolul, atribuțiile și drepturile autorității de stat
Art. 630 - Ministerul Sănătății Publice, în calitate de autoritate de stat, urmărește ca activitatea Colegiului Farmacistilor din România să se desfășoare în condițiile legii.
Art. 631 - Reprezentantul autorității de stat cu rangul de secretar de stat în Ministerul Sănătății Publice este membru al Consiliului național al Colegiului Farmacistilor din România și este numit prin ordin al ministrului sănătății publice.
Art. 632 - În cazul în care reprezentantul autorității de stat constata că nu sunt respectate prevederile legale, acesta sesizează organele de conducere ale Colegiului Farmacistilor din România. În termen de 15 zile de la efectuarea demersului acestea adopta măsurile necesare de încadrare în normele în vigoare și informează Ministerul Sănătății Publice în acest sens.
Art. 633 - În cazul nerespectării prevederilor art. 632, Ministerul Sănătății Publice se adresează instanțelor judecătorești competente.
Capitolul V - Dispoziții tranzitorii și finale
Art. 634 - Practicarea profesiei de farmacist de o persoană care nu are aceasta calitate constituie infracțiune și se pedepsește conform Codului penal.
Art. 635 - În vederea facilitării accesului la exercitarea profesiei de farmacist pe teritoriul României, Ministerul Sănătății Publice, în colaborare cu Colegiul Farmacistilor din România, recunoaște calificarile de farmacist dobândite în conformitate cu normele Uniunii Europene, într-un stat membru al Uniunii Europene, într-un stat aparținând Spațiului Economic European sau în Confederatia Elvetiana, de către cetățenii acestor state, iar încadrarea în munca se face conform legii.
Art. 636 - (1) Normele privind recunoașterea diplomelor, certificatelor și titlurilor de farmacist eliberate de un stat membru al Uniunii Europene, de un stat aparținând Spațiului Economic European și de Confederatia Elvetiana cetățenilor acestora se elaborează de către Ministerul Sănătății Publice, în colaborare cu Colegiul Farmacistilor din România, și se aproba prin hotărâre a Guvernului.
(2) Nomenclatorul de specialități medicale, medico-dentare și farmaceutice pentru rețeaua de asistența medicală se elaborează de către Ministerul Sănătății Publice și se aproba prin ordin al ministrului sănătății publice.
(3) Normele privind întocmirea, emiterea și utilizarea dovezilor de onorabilitate și moralitate profesională a farmacistilor se elaborează în colaborare, de către autoritățile competente române definite de prezenta lege, și se aproba prin hotărâre a Guvernului.
Art. 637 - (1) Atribuțiile Colegiului Farmacistilor din România nu pot fi exercitate de nici o alta asociație profesională.
(2) Colegiul Farmacistilor din România nu se poate substitui organizațiilor patronale sau sindicale și în îndeplinirea atribuțiilor sale nu poate face uz de prerogativele acestora prevăzute de lege.
(3) Membrii Colegiului Farmacistilor din România pot face parte și din alte asociații profesionale.
Art. 638 - Codul deontologic al farmacistului, cu modificările și completările ulterioare, precum și deciziile Consiliului național care privesc organizarea și funcționarea Colegiului Farmacistilor din România se publică în Monitorul Oficial al României, Partea I.
Art. 639 - Pe durata exercitării profesiei în regim salarial sau/și independent, farmacistul este obligat sa încheie o asigurare de răspundere civilă pentru greșeli în activitatea profesională și sa înștiințeze colegiul teritorial al cărui membru este.
Art. 640 - (1) Farmaciștii care ocupa funcții publice în cadrul aparatului central al Ministerului Sănătății Publice, în cadrul autorităților de sănătate publică județene și a municipiului București, în cadrul Casei Naționale de Asigurări de Sănătate și, respectiv, în cadrul caselor de asigurări de sănătate județene și a municipiului București, pot desfășura în afară programului normal de lucru, în condițiile legii, activități profesionale, potrivit calificării pe care o dețin exclusiv în unități sanitare sau farmaceutice private.
(2) Farmacistilor prevăzuți la alin. (1) li se aplică în mod corespunzător prevederile art. 35 alin. (1) și (3) din Legea nr. 53/2003 – Codul muncii, cu modificările și completările ulterioare.
Art. 641 - La data intrării în vigoare a prezentului titlu, se abroga Legea nr. 305/2004 privind exercitarea profesiei de farmacist, precum și organizarea și funcționarea Colegiului Farmacistilor din România, publicată în Monitorul Oficial al României, Partea I, nr. 578 din 30 iunie 2004.
*
Prezentul titlu transpune integral prevederile referitoare la exercițiul profesiei de farmacist, cuprinse în următoarele acte normative ale Uniunii Europene:a) art. 11 al Regulamentului Consiliului nr. 1.612/68/CEE din 15 octombrie 1968 privind libera circulație a lucrătorilor în interiorul Comunității Europene, publicat în Jurnalul Oficial al Comunităților Europene (JOCE) nr. L 257 din 19 octombrie 1968;
b) Directiva Consiliului nr. 85/432/CEE din 16 septembrie 1985 pentru coordonarea dispozițiilor legislative, regulamentare și administrative privind anumite activități din domeniul farmaceutic, cu modificările și completările ulterioare, publicată în Jurnalul Oficial al Comunităților Europene (JOCE) nr. L 253 din 24 septembrie 1985, p. 34;
c) Directiva Consiliului nr. 85/433/CEE din 16 septembrie 1985 privind recunoașterea reciprocă a diplomelor, certificatelor și a altor titluri de farmacist, inclusiv măsuri pentru facilitarea exercitării efective a dreptului de stabilire privind anumite activități în domeniul farmaceutic, cu modificările și completările ulterioare, publicată în Jurnalul Oficial al Comunităților Europene (JOCE) nr. L 253 din 24 septembrie 1985, p. 37;
d) Directiva Consiliului 2003/109/CE din 25 noiembrie 2003 privind statutul cetățenilor din statele terțe care sunt rezidenți pe termen lung, publicat în Jurnalul Oficial al Comunităților Europene (JOCE) nr. L 16 din 23 ianuarie 2004;
e) art. 45, art. 50 alin. (1) și (4), art. 51, art. 52 alin. (1), art. 53, art. 54 și art. 56 alin. (1) și (2) din Directiva Consiliului 2005/36/CE din 7 septembrie 2005 privind recunoașterea calificarilor profesionale, publicată în Jurnalul Oficial al Comunităților Europene (JOCE) nr. L 255 din 30 septembrie 2005.
Titlul XV - Răspunderea civilă a personalului medical și a furnizorului de produse și servicii medicale, sanitare și farmaceutice
Capitolul I - Răspunderea civilă a personalului medical
Art. 642 - (1) În sensul prezentului titlu, următorii termeni se definesc astfel:
a) personalul medical este medicul, medicul dentist, farmacistul, asistentul medical și moasa care acorda servicii medicale;
b) malpraxisul este eroarea profesională săvârșită în exercitarea actului medical sau medico-farmaceutic, generatoare de prejudicii asupra pacientului, implicând răspunderea civilă a personalului medical și a furnizorului de produse și servicii medicale, sanitare și farmaceutice.
(2) Personalul medical răspunde civil pentru prejudiciile produse din eroare, care includ și neglijența, imprudenta sau cunoștințe medicale insuficiente în exercitarea profesiunii, prin acte individuale în cadrul procedurilor de preventie, diagnostic sau tratament.
(3) Personalul medical răspunde civil și pentru prejudiciile ce decurg din nerespectarea reglementărilor prezentului titlu privind confidențialitatea, consimțământul informat și obligativitatea acordării asistenței medicale.
(4) Personalul medical răspunde civil pentru prejudiciile produse în exercitarea profesiei și atunci când își depășește limitele competentei, cu excepția cazurilor de urgenta în care nu este disponibil personal medical ce are competența necesară.
(5) Răspunderea civilă reglementată prin prezenta lege nu inlatura angajarea răspunderii penale, dacă fapta care a cauzat prejudiciul constituie infracțiune conform legii.
Art. 643 - (1) Toate persoanele implicate în actul medical vor răspunde proporțional cu gradul de vinovăție al fiecăruia.
(2) Personalul medical nu este răspunzător pentru daunele și prejudiciile produse în exercitarea profesiunii:
a) când acestea se datorează condițiilor de lucru, dotării insuficiente cu echipament de diagnostic și tratament, infectiilor nosocomiale, efectelor adverse, complicatiilor și riscurilor în general acceptate ale metodelor de investigatie și tratament, viciilor ascunse ale materialelor sanitare, echipamentelor și dispozitivelor medicale, substanțelor medicale și sanitare folosite;
b) când acționează cu buna-credința în situații de urgenta, cu respectarea competentei acordate.
Capitolul II - Răspunderea civilă a furnizorilor de servicii medicale, materiale sanitare, aparatura, dispozitive medicale și medicamente
Art. 644 - (1) Unitățile sanitare publice sau private, în calitate de furnizori de servicii medicale, răspund civil, potrivit dreptului comun, pentru prejudiciile produse în activitatea de preventie, diagnostic sau tratament, în situația în care acestea sunt consecința:
a) infectiilor nosocomiale, cu excepția cazului când se dovedește o cauza externa ce nu a putut fi controlată de către instituție;
b) defectelor cunoscute ale dispozitivelor și aparaturii medicale folosite în mod abuziv, fără a fi reparate;
c) folosirii materialelor sanitare, dispozitivelor medicale, substanțelor medicamentoase și sanitare, după expirarea perioadei de garanție sau a termenului de valabilitate a acestora, după caz;
d) acceptării de echipamente și dispozitive medicale, materiale sanitare, substanțe medicamentoase și sanitare de la furnizori, fără asigurarea prevăzută de lege, precum și subcontractarea de servicii medicale sau nemedicale de la furnizori fără asigurare de răspundere civilă în domeniul medical.
(2) Unitățile prevăzute la alin. (1) răspund în condițiile legii civile pentru prejudiciile produse de personalul medical angajat, în solidar cu acesta.
Art. 645 - Unitățile sanitare publice sau private, furnizoare de servicii medicale, răspund civil și pentru prejudiciile cauzate, în mod direct sau indirect, pacientilor, generate de nerespectarea reglementărilor interne ale unității sanitare.
Art. 646 - Unitățile sanitare publice sau private, furnizoare de servicii medicale, și producătorii de echipamente și dispozitive medicale, substanțe medicamentoase și materiale sanitare răspund potrivit legii civile pentru prejudiciile produse pacientilor în activitatea de preventie, diagnostic și tratament, generate în mod direct sau indirect de viciile ascunse ale echipamentelor și dispozitivelor medicale, substanțelor medicamentoase și materiale sanitare, în perioada de garanție/valabilitate, conform legislației în vigoare.
Art. 647 - Prevederile art. 646 se aplică în mod corespunzător și furnizorilor de servicii medicale sau nemedicale, subcontractate de către unitățile sanitare publice sau private furnizoare de servicii medicale, în cazul prejudiciilor aduse pacientilor în mod direct sau indirect, ca urmare a serviciilor prestate.
Art. 648 - Furnizorii de utilități către unitățile sanitare publice sau private furnizoare de servicii medicale răspund civil pentru prejudiciile cauzate pacientilor, generate de furnizarea necorespunzătoare a utilităților.
Capitolul III - Acordul pacientului informat
Art. 649 - (1) Pentru a fi supus la metode de preventie, diagnostic și tratament, cu potențial de risc pentru pacient, după explicarea lor de către medic, medic dentist, asistent medical/moasa, conform prevederilor alin. (2) și (3), pacientului i se solicita acordul scris.
(2) În obținerea acordului scris al pacientului, medicul, medicul dentist, asistentul medical/moasa sunt datori să prezinte pacientului informații la un nivel științific rezonabil pentru puterea de înțelegere a acestuia.
(3) Informațiile trebuie să conțină: diagnosticul, natura și scopul tratamentului, riscurile și consecințele tratamentului propus, alternativele viabile de tratament, riscurile și consecințele lor, prognosticul bolii fără aplicarea tratamentului.
Art. 650 - Vârsta legală pentru exprimarea consimțământului informat este de 18 ani. Minorii își pot exprima consimțământul în absenta părinților sau reprezentantului legal, în următoarele cazuri:
a) situații de urgenta, când părinții sau reprezentantul legal nu pot fi contactati, iar minorul are discernamantul necesar pentru a înțelege situația medicală în care se afla;
b) situații medicale legate de diagnosticul și/sau tratamentul problemelor sexuale și reproductive, la solicitarea expresă a minorului în vârsta de peste 16 ani.
Art. 651 - (1) Medicul curant, asistentul medical/moasa răspund atunci când nu obțin consimțământul informat al pacientului sau al reprezentanților legali ai acestuia, cu excepția cazurilor în care pacientul este lipsit de discernământ, iar reprezentantul legal sau ruda cea mai apropiată nu poate fi contactat, datorită situației de urgenta.
(2) Atunci când reprezentantul legal sau ruda cea mai apropiată nu poate fi contactat, medicul, asistentul medical/moasa pot solicita autorizarea efectuării actului medical autorității tutelare sau pot acționa fără acordul acesteia în situații de urgenta, când intervalul de timp până la exprimarea acordului ar pune în pericol, în mod ireversibil, sănătatea și viața pacientului.
Capitolul IV - Obligativitatea asigurării asistenței medicale
Art. 652 - (1) Medicul, medicul dentist, asistentul medical/moasa au obligația de a acorda asistența medicală/îngrijiri de sănătate unei persoane doar dacă au acceptat-o în prealabil ca pacient, criteriile de acceptare urmând a fi stabilite prin normele metodologice de aplicare a prezentei legi.
(2) Medicul, medicul dentist, asistentul medical/moasa nu pot refuza sa acorde asistența medicală/îngrijiri de sănătate pe criterii etnice, religioase și orientare sexuală sau pe alte criterii de discriminare interzise prin lege.
(3) Medicul, medicul dentist, asistentul medical/moasa au obligația de a accepta pacientul în situații de urgenta, când lipsa asistenței medicale poate pune în pericol, în mod grav și ireversibil, sănătatea sau viața pacientului.
Art. 653 - (1) Atunci când medicul, medicul dentist, asistentul medical/moasa au acceptat pacientul, relația poate fi întreruptă:
a) odată cu vindecarea bolii;
b) de către pacient;
c) de către medic, în următoarele situații:
(i) atunci când pacientul este trimis altui medic, furnizand toate datele medicale obținute, care justifica asistența altui medic cu competente sporite;
(îi) pacientul manifesta o atitudine ostila și/sau ireverentioasa față de medic.
(2) Medicul va notifica pacientului, în situația prevăzută la alin. (1) lit. c) pct. (îi), dorința terminării relatiei, înainte cu minimum 5 zile, pentru ca acesta sa găsească o alternativa, doar în măsura în care acest fapt nu pune în pericol starea sănătății pacientului.
Art. 654 - (1) Medicul, asistentul medical/moasa, angajați ai unei instituții furnizoare de servicii medicale, au obligația acordării asistenței medicale/ingrijirilor de sănătate pacientului care are dreptul de a primi îngrijiri medicale/de sănătate în cadrul instituției, potrivit reglementărilor legale.
(2) Medicul poate refuza asigurarea asistenței medicale în situațiile menționate la art. 653 alin. (1) lit. c).
Art. 655 - (1) În acordarea asistenței medicale/ ingrijirilor de sănătate, personalul medical are obligația aplicării standardelor terapeutice, stabilite prin ghiduri de practica în specialitatea respectiva, aprobate la nivel național, sau, în lipsa acestora, standardelor recunoscute de comunitatea medicală a specialitatii respective.
(2) Colegiul Medicilor din România va elabora și va supune spre aprobare Ministerului Sănătății Publice standardele terapeutice, stabilite prin ghiduri de practica la nivel național, până la intrarea în vigoare a prezentului titlu.
Capitolul V - Asigurarea obligatorie de răspundere civilă profesională pentru medici, farmacisti și alte persoane din domeniul asistenței medicale
Art. 656 - (1) Personalul medical definit la art. 642 alin. (1) lit. a) care acorda asistența medicală, în sistemul public și/sau în cel privat, într-o locatie cu destinație specială pentru asistența medicală, precum și atunci când aceasta se acordă în afară acestei locatii, ca urmare a unei cereri exprese din partea persoanei sau a persoanelor care necesita aceasta asistența ori a unui terț care solicită aceasta asistența pentru o persoană sau mai multe persoane care, din motive independente de voința lor, nu pot apela ele însele la aceasta asistența, va încheia o asigurare de malpraxis pentru cazurile de răspundere civilă profesională pentru prejudicii cauzate prin actul medical.
(2) O copie după asigurare va fi prezentată înainte de încheierea contractului de muncă, fiind o condiție obligatorie pentru angajare.
Art. 657 - (1) Asiguratorul acorda despăgubiri pentru prejudiciile de care asigurații răspund, în baza legii, față de terțe persoane care se constată că au fost supuse unui act de malpraxis medical, precum și pentru cheltuielile de judecată ale persoanei prejudiciate prin actul medical.
(2) Despăgubirile se acordă indiferent de locul în care a fost acordată asistența medicală.
(3) Asigurarea obligatorie face parte din categoria B clasa 13 de asigurări de răspundere civilă și va cuprinde toate tipurile de tratamente medicale ce se efectuează în specialitatea și competența profesională a asiguratului și în gama de servicii medicale oferite de unitățile de profil.
Art. 658 - (1) Despăgubirile se acordă pentru sumele pe care asiguratul este obligat să le plătească cu titlu de dezdăunare și cheltuieli de judecată persoanei sau persoanelor pagubite prin aplicarea unei asistente medicale neadecvate, care poate avea drept efect inclusiv vătămarea corporală ori decesul.
(2) În caz de deces, despăgubirile se acordă succesorilor în drepturi ai pacientului care au solicitat acestea.
(3) Despăgubirile se acordă și atunci când asistența medicală nu s-a acordat, deși starea persoanei sau persoanelor care au solicitat sau pentru care s-a solicitat asistența medicală impunea aceasta intervenție.
(4) Despăgubirile vor include și eventualele cheltuieli ocazionate de un proces în care asiguratul este obligat la plata acestora; cheltuielile de judecată sunt incluse în limita răspunderii stabilită prin polița de asigurare.
Art. 659 - Despăgubirile se plătesc și atunci când persoanele vătămate sau decedate nu au domiciliul sau reședința în România, cu excepția cetățenilor din Statele Unite ale Americii, Canada și Australia.
Art. 660 - (1) În cazul în care pentru același asigurat exista mai multe asigurări valabile, despăgubirea se suporta în mod proporțional cu suma asigurata de fiecare asigurator.
(2) Asiguratul are obligația de a informa asiguratorul despre încheierea unor astfel de asigurări cu alți asiguratori, atât la încheierea poliției, cat și pe parcursul executării acesteia.
Art. 661 - (1) Limitele maxime ale despăgubirilor de asigurare se stabilesc de către CNAS, după consultarea asociațiilor profesionale din domeniul asigurărilor și CMR, CFR, CMDR, OAMMR și OBBC.
(2) Nivelul primelor, termenele de plată și celelalte elemente privind acest tip de asigurări se stabilesc prin negociere între asigurați și asiguratori.
Art. 662 - (1) Despăgubirile se pot stabili pe cale amiabila, în cazurile în care rezultă cu certitudine răspunderea civilă a asiguratului.
(2) În cazul în care părțile – asigurat, asigurator și persoana prejudiciata – cad de acord sau nu, este certa culpa asiguratului, despăgubirile se vor plati numai în baza hotărârii definitive a instanței judecătorești competente.
Art. 663 - Despăgubirile se plătesc de către asigurator nemijlocit persoanelor fizice, în măsura în care acestea nu au fost despagubite de asigurat.
Art. 664 - Despăgubirile pot fi solicitate și se plătesc și către persoanele care nu au plătit contribuția datorată la sistemul public de sănătate.
Art. 665 - (1) Drepturile persoanelor vătămate sau decedate prin aplicarea unei asistente medicale neadecvate se pot exercita împotriva celor implicați direct sau indirect în asistența medicală.
(2) Aceste drepturi se pot exercita și împotriva persoanelor juridice care furnizează echipamente, instrumental medical și medicamente care sunt folosite în limitele instrucțiunilor de folosire sau prescripțiilor în asistența medicală calificată, conform obligației acestora, asumată prin contractele de furnizare a acestora.
Art. 666 - (1) Despăgubirile nu se recuperează de la persoana răspunzătoare de producerea pagubei când asistența medicală s-a făcut în interesul părții vătămate sau a decedatului, în lipsa unei investigații complete ori a necunoasterii datelor anamnezice ale acestuia, datorită situației de urgenta, iar partea vătămată sau decedatul nu a fost capabil, datorită circumstanțelor, sa coopereze când i s-a acordat asistența.
(2) Recuperarea prejudiciilor de la persoana răspunzătoare de producerea pagubei se poate realiza în următoarele cazuri:
a) vătămarea sau decesul este urmare a încălcării intenționate a standardelor de asistența medicală;
b) vătămarea sau decesul se datorează unor vicii ascunse ale echipamentului sau a instrumentarului medical sau a unor efecte secundare necunoscute ale medicamentelor administrate;
c) atunci când vătămarea sau decesul se datorează atât persoanei responsabile, cat și unor deficiente administrative de care se face vinovata unitatea medicală în care s-a acordat asistența medicală sau ca urmare a neacordarii tratamentului adecvat stabilit prin standarde medicale recunoscute sau alte acte normative în vigoare, persoana indreptatita poate să recupereze sumele plătite drept despăgubiri de la cei vinovați, alții decât persoana responsabilă, proporțional cu partea de vina ce revine acestora;
d) asistența medicală a părții vătămate sau a decedatului s-a făcut fără consimțământul acestuia, dar în alte împrejurări decât cele prevăzute la alin. (1).
Art. 667 - Asigurații sau reprezentanții acestora sunt obligați sa înștiințeze în scris asiguratorul sau, dacă este cazul, asiguratorii despre existenta unei acțiuni în despăgubire, în termen de 3 zile lucrătoare de la data la care au luat la cunoștința despre aceasta acțiune.
Capitolul VI - Procedura de stabilire a cazurilor de răspundere civilă profesională pentru medici, farmacisti și alte persoane din domeniul asistenței medicale
Art. 668 - (1) La nivelul autorităților de sănătate publică județene și a municipiului București se constituie Comisia de monitorizare și competența profesională pentru cazurile de malpraxis, numita în continuare Comisia.
(2) Comisia are în componenta reprezentanți ai autorităților de sănătate publică județene și, respectiv, ai municipiului București, casei județene de asigurări de sănătate, colegiului județean al medicilor, colegiului județean al medicilor dentisti, colegiului județean al farmacistilor, ordinului județean al asistentilor și moașelor din România, un expert medico-legal, sub conducerea unui director adjunct al autorității de sănătate publică județene, respectiv a municipiului București.
(3) Regulamentul de organizare și funcționare a Comisiei se elaborează de Ministerul Sănătății Publice, se aproba prin ordin al ministrului sănătății publice și se publică în Monitorul Oficial al României, Partea I.
Art. 669 - (1) Ministerul Sănătății Publice aproba, la propunerea Colegiului Medicilor din România, pentru fiecare județ și municipiul București, o lista naționala de experți medicali, în fiecare specialitate, care vor fi consultați conform regulamentului de organizare și funcționare a Comisiei.
(2) Pe lista de experți se poate înscrie orice medic, medic dentist, farmacist, asistent medical/moasa cu o vechime de cel puțin 8 ani în specialitate, cu avizul Colegiului Medicilor din România, Colegiului Medicilor Dentisti, Colegiului Farmacistilor și, respectiv, al Ordinului Asistentilor Medicali și Moașelor din România.
(3) Modalitatea de remunerare a experților medicali din lista naționala se stabilește prin ordin al ministrului sănătății publice.
(4) Onorariile pentru serviciile prestate de către experții medicali, desemnați potrivit art. 671, se stabilesc în raport cu complexitatea cazului expertizat, sunt aprobate prin ordin al ministrului sănătății publice și vor fi suportate de partea interesată.
Art. 670 - Comisia poate fi sesizată de:
a) persoana sau, după caz, reprezentantul legal al acesteia, care se considera victima unui act de malpraxis săvârșit în exercitarea unei activități de preventie, diagnostic și tratament;
b) succesorii persoanei decedate ca urmare a unui act de malpraxis imputabil unei activități de preventie, diagnostic și tratament.
Art. 671 - (1) Comisia desemnează, prin tragere la sorți, din lista judeteana a experților un grup de experți sau un expert, în funcție de complexitatea cazului, însărcinat cu efectuarea unui raport asupra cazului.
(2) Experții prevăzuți la alin. (1) au acces la toate documentele medicale aferente cazului, a căror cercetare o considera necesară, și au dreptul de a audia și inregistra depozitiile tuturor persoanelor implicate.
(3) Experții întocmesc în termen de 30 de zile un raport asupra cazului pe care îl înaintează Comisiei. Comisia adopta o decizie asupra cazului, în maximum 3 luni de la data sesizării.
(4) Fiecare parte interesată are dreptul sa primească o copie a raportului experților și a documentelor medicale care au stat la baza acestuia.
Art. 672 - Comisia stabilește, prin decizie, dacă în cauza a fost sau nu o situație de malpraxis. Decizia se comunică tuturor persoanelor implicate, inclusiv asiguratorului, în termen de 5 zile calendaristice.
Art. 673 - (1) În cazul în care asiguratorul sau oricare dintre părțile implicate nu este de acord cu decizia Comisiei, o poate contesta la instanța de judecată competența, în termen de 15 zile de la data comunicării deciziei.
(2) Procedura stabilirii cazurilor de malpraxis nu împiedica liberul acces la justiție potrivit dreptului comun.
Art. 674 - (1) Întreaga procedura de stabilire a cazurilor de malpraxis, până în momentul sesizării instanței, este confidențială.
(2) Încălcarea confidențialității de către persoana care a făcut sesizarea duce la pierderea dreptului de a beneficia de procedura de conciliere.
(3) Încălcarea confidențialității de către membrii Comisiei sau experții desemnați de aceasta atrage sancțiuni profesionale și administrative, conform regulamentelor aprobate.
Capitolul VII - Dispoziții finale
Art. 675 - (1) Comisia întocmește un raport anual detaliat pe care îl prezintă Ministerului Sănătății Publice.
(2) Pe baza datelor astfel obținute, Ministerul Sănătății Publice elaborează un raport anual național asupra malpraxisului medical, pe care îl prezintă Parlamentului, Guvernului și opiniei publice.
Art. 676 - Instanța competența să soluționeze litigiile prevăzute în prezenta lege este judecătoria în a carei circumscripție teritorială a avut loc actul de malpraxis reclamat.
Art. 677 - Actele de malpraxis în cadrul activității medicale de preventie, diagnostic și tratament se prescriu în termen de 3 ani de la producerea prejudiciului, cu excepția faptelor ce reprezintă infracțiuni.
Art. 678 - (1) Omisiunea încheierii asigurării de malpraxis medical sau asigurarea sub limita legală de către persoanele fizice și juridice prevăzute de prezenta lege constituie abatere disciplinară și se sancționează cu suspendarea dreptului de practica sau, după caz, suspendarea autorizației de funcționare.
(2) Aceasta sancțiune nu se aplică dacă asiguratul se conformează în termen de 30 de zile obligației legale.
Art. 679 - Prevederile prezentului titlu nu se aplică activității de cercetare biomedicala.
Art. 680 - În termen de 60 de zile de la intrarea în vigoare a prezentului titlu, Ministerul Sănătății Publice și Comisia de Supraveghere a Asigurărilor vor elabora împreună, prin ordin comun sau separat, după caz, normele metodologice de aplicare a acestuia.
Art. 681 - La data intrării în vigoare a prezentului titlu orice dispoziție contrară se abroga.
Titlul XVI - Înființarea, organizarea și funcționarea Școlii Naționale de Sănătate Publică și Management Sanitar
Art. 682 - Se înființează Școala Naționala de Sănătate Publică și Management Sanitar, denumita în continuare SNSPMS, instituție publică, persoana juridică română cu sediul în municipiul București, Str. Vaselor nr. 31, sectorul 2, coordonata de Ministerul Sănătății Publice, prin reorganizarea Institutului Național de Cercetare-Dezvoltare în Sănătate București, care se desființează.
Art. 683 - (1) SNSPMS are următoarele obiecte de activitate:
a) organizarea și desfășurarea de cursuri în domeniul administrației și managementului sanitar, pentru pregătirea și perfecționarea personalului cu studii superioare, precum și a celui cu studii medii și postliceale cu precădere din domeniul sanitar;
b) desfășurarea de activități de cercetare-dezvoltare în domeniul sănătății publice și private și al managementului în sănătate;
c) acordarea asistenței tehnice în domeniul sănătății publice și private și al managementului serviciilor de sănătate;
d) alte activități specifice din domeniul sănătății publice și managementului sanitar, precum promovarea sănătății, efectuarea de studii și aplicații pentru evaluarea și eficientizarea performantelor sistemului de sănătate sau alte documentari, analize și proiecte pentru sprijinirea procesului de reforma în contextul integrării europene.
(2) SNSPMS va organiza și va desfășura cursuri de atestat, cursuri de scurta durata și alte tipuri de cursuri specifice în domeniul managementului sanitar, cu precădere pentru personalul ce lucrează în domeniul sanitar, inclusiv în administrația publică sanitară, având dreptul de a elibera certificate de absolvire și diplome, fiind responsabil național pentru atestatele de pregătire complementara în managementul serviciilor de sănătate, economie sanitară și management financiar și în managementul cabinetului medical și promovarea sănătății.
(3) SNSPMS va organiza și va desfășura cursuri universitare de masterat, inclusiv în parteneriat cu instituții de profil naționale și internaționale, cu respectarea prevederilor legale în vigoare.
(4) SNSPMS este instituție specializată care asigura formarea și perfecționarea funcționarilor publici din sistemul sanitar și al asigurărilor de sănătate, conform obligației prevăzute în legislația aplicabilă funcționarilor publici, fiind abilitata și recunoscută în acest sens.
(5) Certificatele și diplomele eliberate de SNSPMS sunt recunoscute de Ministerul Sănătății Publice și Ministerul Educației și Cercetării și sunt opozabile terților.
(6) Eliberarea certificatelor și diplomelor se va realiza în baza unui ordin comun al ministrului sănătății publice și al ministrului educației și cercetării.
(7) Organizarea și desfășurarea programelor de pregătire teoretică și practica prevăzute la alin. (1) lit. a) și alin. (2) și eliberarea certificatelor și diplomelor se vor face cu respectarea prevederilor legale în vigoare.
(8) Consiliul de administrație al SNSPMS poate aproba intrarea în consortii universitare, potrivit legii.
Art. 684 - (1) Conducerea SNSPMS este asigurata de Consiliul de administrație, care are în componenta șapte membri: doi reprezentanți ai Ministerului Sănătății Publice, doi reprezentanți ai Ministerului Educației și Cercetării, doi reprezentanți ai Casei Naționale de Asigurări de Sănătate și directorul general.
(2) Președintele Consiliului de administrație este ales prin vot secret de către membrii Consiliului de administrație.
(3) Membrii Consiliului de administrație al SNSPMS sunt numiți prin ordin comun al ministrului sănătății publice, ministrului educației și cercetării și al președintelui Casei Naționale de Asigurări de Sănătate pentru un mandat de trei ani; mandatul încetează prin revocarea celor care i-au numit, expirare a mandatului, demisie, deces.
(4) Pentru activitatea desfășurată în calitate de membri ai Consiliului de administrație, aceștia au dreptul la o indemnizație lunară, stabilită de Consiliul de administrație, care nu poate fi mai mare de 20% din salariul de baza al directorului general al SNSPMS.
(5) Directorul general este numit prin ordin comun al ministrului sănătății publice, ministrului educației și cercetării și al președintelui Casei Naționale de Asigurări de Sănătate pentru o perioadă de trei ani, prin concurs organizat de Consiliul de administrație, potrivit condițiilor stabilite în regulamentul de organizare și funcționare.
(6) Conducerea executivă a SNSPMS este asigurata de directorul general, care este ordonator de credite și membru în Consiliul de administrație.
(7) Salariul de baza al directorului general se stabilește prin ordin al ministrului sănătății publice, potrivit reglementărilor legale.
Art. 685 - În structura SNSPMS va funcționa un Consiliu științific și pedagogic care coordonează activitățile de învățământ și cercetare-dezvoltare desfășurate de SNSPMS. Președintele Consiliului științific și pedagogic este unul dintre reprezentanții Ministerului Educației și Cercetării din Consiliul de administrație. Numărul membrilor și condițiile necesare pentru a face parte din Consiliul științific și pedagogic vor fi prevăzute în statutul aprobat de Consiliul de administrație, care va aproba și componenta nominală a Consiliului științific și pedagogic.
Art. 686 - Regulamentul de organizare și funcționare, statutul, organigrama, statul de funcții și structura de personal ale SNSPMS vor fi aprobate prin ordin comun al ministrului sănătății publice, ministrului educației și cercetării și al președintelui Casei Naționale de Asigurări de Sănătate, la propunerea Consiliului de administrație al SNSPMS, în 60 de zile de la data intrării în vigoare a prezentului titlu.
Art. 687 - SNSPMS are următoarele principale structuri functionale:
a) Centrul de formare postuniversitară în domeniul sănătății publice, administrației și managementului serviciilor de sănătate;
b) Centrul de management al serviciilor de sănătate;
c) Centrul de cercetare și evaluare a serviciilor de sănătate;
d) Centrul național de promovare a sănătății;
e) Departamentul de sănătate publică și management al serviciilor de sănătate pentru persoane cu studii medii și postliceale din domeniul sănătății publice și private.
Art. 688 - (1) SNSPMS are normate zece posturi de personal didactic sau cu grad științific echivalent, pentru primii doi ani de la intrarea în vigoare a prezentului titlu, iar ulterior, în funcție de necesitați, numărul acestor posturi se va stabili cu aprobarea Ministerului Educației și Cercetării. Posturile de personal didactic vor fi ocupate conform legislației în vigoare. Personalul Institutului Național de Cercetare-Dezvoltare în Sănătate este preluat de SNSPMS cu toate drepturile salariale avute la data intrării în vigoare a prezentului titlu.
(2) Pentru nevoile de formare interdisciplinare se va putea recurge la resurse umane existente în cadrul instituțiilor universitare și organizațiilor interne și internaționale cu activitate în domeniu.
(3) Salariile individuale ale personalului se stabilesc prin negociere, conform contractului colectiv de muncă, în baza Legii nr. 53/2003 – Codul muncii, cu modificările și completările ulterioare, și a celorlalte prevederi legale în vigoare, în limita fondului total destinat plății salariilor prevăzut în bugetul de venituri și cheltuieli.
Art. 689 - Ministerul Sănătății Publice și Ministerul Educației și Cercetării împreună cu ministerele de profil vor lua măsurile corespunzătoare pentru asigurarea sediilor și a bazei materiale necesare SNSPMS.
Art. 690 - (1) Patrimoniul Institutului Național de Cercetare-Dezvoltare în Sănătate București se transfera la SNSPMS și se va prelua pe bază de protocol de predare-preluare, pe baza datelor din bilanțul contabil întocmit la 31 decembrie 2005, actualizat potrivit prevederilor legale, în termen de 30 de zile de la data intrării în vigoare a prezentului titlu.
(2) Imobilul compus din construcțiile, anexele și terenul aferent, situate în municipiul București, Str. Vaselor nr. 31, sectorul 2, în care a funcționat Institutul Național de Cercetare-Dezvoltare în Sănătate București, trec în administrarea SNSPMS.
(3) Activul și pasivul Institutului Național de Cercetare-Dezvoltare în Sănătate București se preiau pe bază de protocol de predare-preluare de către SNSPMS, în termen de 30 de zile de la data intrării în vigoare a prezentului titlu.
(4) SNSPMS preia toate drepturile și este ținuta de toate obligațiile Institutului Național de Cercetare-Dezvoltare în Sănătate București, potrivit reglementărilor legale și contractuale.
Art. 691 - (1) Înființarea SNSPMS ca instituție de învățământ superior organizatoare de studii universitare de masterat se va face cu respectarea prevederilor legale în vigoare, inclusiv cu parcurgerea etapei de evaluare academica și de acreditare.
(2) SNSPMS este autorizata provizoriu pe o perioadă de 5 ani, perioada în care se vor face demersurile necesare acreditării, conform normelor Consiliului Național de Evaluare Academica și Acreditare.
Art. 692 - (1) Finanțarea SNSPMS se realizează din venituri proprii, precum și din donații, sponsorizări și din alte surse, în condițiile legii.
(2) SNSPMS poate desfășura activități aferente programelor naționale de sănătate, finanțate de la bugetul Ministerului Sănătății Publice, și activități de analiza, evaluare și monitorizare a serviciilor de sănătate decontate din Fondul național unic de asigurări sociale de sănătate.
(3) Activitățile prevăzute la alin. (2) se realizează prin negociere directa, pe bază de contracte încheiate cu Ministerul Sănătății Publice și, respectiv, cu Casa Naționala de Asigurări de Sănătate.
Art. 693 - Pe data intrării în vigoare a prezentului titlu se abroga Hotărârea Guvernului nr. 1.329/2002 privind înființarea, organizarea și funcționarea Institutului Național de Cercetare-Dezvoltare în Sănătate București, publicată în Monitorul Oficial al României, Partea I, nr. 876 din 4 decembrie 2002.
Art. 694 - Orice alte dispoziții contrare prezentului titlu se abroga.
Titlul XVII - Medicamentul
Capitolul I - Delimitari conceptuale
Art. 695 - În înțelesul prezentului titlu, termenii și notiunile folosite au următoarele semnificatii:
1. medicament:
a) orice substanța sau combinație de substanțe prezentată ca având proprietăți pentru tratarea sau prevenirea bolilor la om; sau
b) orice substanța sau combinație de substanțe care poate fi folosită sau administrată la om, fie pentru restabilirea, corectarea sau modificarea funcțiilor fiziologice prin exercitarea unei acțiuni farmacologice, imunologice sau metabolice, fie pentru stabilirea unui diagnostic medical;
2. substanța – orice materie, indiferent de origine, care poate fi:
– umană, precum: sânge uman și produse derivate din sangele uman;
– animala, precum: microorganisme, animale întregi, părți de organe, secretii animale, toxine, extracte, produse derivate din sânge;
– vegetala, precum: microorganisme, plante, părți de plante, secretii vegetale, extracte;
– chimica, precum: elemente, substanțe chimice naturale și produși chimici obținuți prin transformare chimica sau sinteza;
3. medicament imunologic – orice medicament care consta în vaccinuri, toxine, seruri sau produse alergene:
a) vaccinurile, toxinele sau serurile se referă în special la:
(i) agenți folosiți pentru producerea imunitatii active, precum vaccinul holeric, BCG, vaccinul poliomielitic, vaccinul variolic;
(îi) agenți folosiți pentru diagnosticarea stării de imunitate, incluzând în special tuberculina și tuberculina PPD, toxine folosite pentru testele Schick și Dick, brucelina;
(iii) agenți folosiți pentru producerea imunitatii pasive, precum antitoxina difterica, globulina antivariolica, globulina antilimfocitica;
b) produsele alergene sunt medicamentele destinate identificarii sau inducerii unei modificări specifice și dobândite a răspunsului imun la un agent alergizant;
4. medicament homeopat – orice medicament obținut din substanțe numite suse homeopate în acord cu un procedeu de fabricație homeopat descris de Farmacopeea Europeană sau, în absența acesteia, de farmacopeele utilizate în prezent în România și în statele membre ale Uniuniii Europene; un medicament homeopat poate conține mai multe principii active;
5. medicament radiofarmaceutic – orice medicament care, atunci când este gata de folosire, conține încorporați, în scopuri medicale, unul sau mai mulți radionuclizi (izotopi radioactivi);
6. generator de radionuclizi – orice sistem care incorporeaza un radionuclid-părinte fixat, care servește la producerea unui radionuclid-fiica obținut prin elutie sau prin orice alta metoda și care este folosit într-un medicament radiofarmaceutic;
7. kit (trusa) – orice preparat care urmează să fie reconstituit sau combinat cu radionuclizi în medicamentul radiofarmaceutic final, în mod obișnuit înaintea administrării lui;
8. precursor radionuclidic – orice alt radionuclid produs pentru radiomarcarea altei substanțe înaintea administrării;
9. medicament derivat din sânge uman sau plasma umană – medicament pe bază de constituenti din sânge, preparati industrial de unități publice sau private; asemenea medicamente includ în special albumina, factori de coagulare și imunoglobuline de origine umană;
10. reactie adversa – un răspuns nociv și nedorit, care apare la utilizarea unui medicament în doze, întrebuințat în mod normal la om pentru profilaxia, diagnosticarea sau tratamentul bolii ori pentru restabilirea, corectarea sau modificarea unor funcții fiziologice;
11. reactie adversa grava – o reactie adversa care cauzează moartea, pune în pericol viața, necesita spitalizarea sau prelungirea spitalizarii, provoacă un handicap ori o incapacitate durabila sau importanța ori provoacă anomalii/malformatii congenitale;
12. reactie adversa neasteptata – o reactie adversa a carei natura, severitate sau evoluție nu corespunde informațiilor din rezumatul caracteristicilor produsului;
13. rapoarte periodice actualizate referitoare la siguranța (RPAS) – rapoartele periodice conținând informațiile înregistrate conform art. 816;
14. studiu de siguranță postautorizare – un studiu farmaco-epidemiologic sau un studiu clinic realizat în concordanta cu prevederile autorizației de punere pe piața, desfășurat în scopul identificarii sau cuantificării unui risc din punctul de vedere al siguranței pentru un medicament autorizat;
15. abuz de medicamente – utilizarea intenționată excesiva, permanenta sau sporadica, a medicamentelor, care este însoțită de efecte nocive la nivel fizic sau psihic;
16. distribuție angro a medicamentelor – totalitatea activităților de procurare, deținere, livrare sau export de medicamente, cu excepția activității de eliberare a acestora către public; asemenea activități sunt efectuate de fabricanti ori depozitele lor, importatori și alți distribuitori angro sau de farmacisti ori alte persoane autorizate sa furnizeze medicamente către public în România;
17. obligație de serviciu public – obligația distribuitorilor angro de a asigura permanent o gama adecvată de medicamente care să răspundă necesităților unui spațiu geografic determinat și de a livra pe întreg spațiul respectiv cantitățile solicitate în cel mai scurt termen de la primirea comenzii;
18. reprezentant al deținătorului autorizației de punere pe piața – persoana cunoscută în mod obișnuit sub denumirea de reprezentant local, desemnată de către deținătorul autorizației de punere pe piața sa îl reprezinte în România;
19. prescripție medicală – orice prescripție de medicamente emisă de o persoană calificată în acest sens;
20. denumirea medicamentului – denumirea atribuită unui medicament, ce poate să fie o denumire inventata care să nu conducă la confuzii cu denumirea comuna ori cu o denumire comuna sau științifică, însoțită de marca ori numele deținătorului autorizației de punere pe piața;
21. denumire comuna – denumirea comuna internationala recomandată de către Organizația Mondială a Sănătății (OMS) sau, dacă o astfel de denumire nu exista, denumirea comuna uzuală;
22. concentrația medicamentului – conținutul în substanțe active, exprimat în cantitate pe unitatea dozata, pe unitatea de volum sau de greutate, în funcție de forma farmaceutica;
23. ambalaj primar – recipientul sau orice alta forma de ambalaj aflată în contact direct cu medicamentul;
24. ambalaj secundar – ambalajul în care este introdus ambalajul primar;
25. etichetare – informațiile de pe ambalajul primar sau secundar;
26. prospect – document cuprinzând informațiile pentru utilizator, care însoțește medicamentul;
27. autoritate competentă – Agenția Naționala a Medicamentului (ANM), înființată prin Ordonanța Guvernului nr. 125/1998 privind înființarea, organizarea și funcționarea Agenției Naționale a Medicamentului, aprobată cu modificări și completări prin Legea nr. 594/2002, cu modificările și completările ulterioare;
28. riscuri legate de utilizarea medicamentului :
– orice risc pentru sănătatea pacientului sau pentru sănătatea publică, legat de calitatea, siguranța ori eficacitatea medicamentului;
– orice risc de efecte indezirabile asupra mediului;
29. raport risc- beneficiu – o evaluare a efectelor terapeutice pozitive ale medicamentului, comparativ cu riscurile definite la pct. 28 prima liniuța;
30. medicament din plante medicinale cu utilizare tradiționala – orice medicament din plante care îndeplinește condițiile prevăzute la art. 714 alin (1);
31. medicament din plante – orice medicament conținând ca substanțe active exclusiv una sau mai multe substanțe vegetale sau preparate din plante ori o combinație între una sau mai multe astfel de substanțe vegetale ori preparate din plante;
32. substante vegetale – plante, părți din plante, alge, fungi, licheni întregi, fragmentati sau taiati, într-o formă neprocesata, de obicei uscati, dar uneori proaspeți; anumite exudate ce nu au fost supuse unui tratament specific sunt, de asemenea, considerate a fi substanțe vegetale; substantele vegetale sunt definite precis prin partea din planta care este utilizata și prin denumirea botanica în sistemul binominal (gen, specie, varietate și autor);
33. preparate din plante – preparate obținute prin supunerea substanțelor din plante la tratamente precum extractia, distilarea, presarea, fractionarea, purificarea, concentrarea sau fermentarea; acestea includ substanțe din plante concasate sau pulverizate, tincturi, extracte, uleiuri esențiale, sucuri obținute prin presare sau exudate procesate;
34. procedura centralizata – procedura de autorizare de punere pe piața prevăzută în Regulamentul Consiliului și Parlamentului European nr. 726/2004, care stabilește procedurile comunitare pentru autorizarea și supravegherea medicamentelor de uz uman și veterinar și care constituie Agenția Europeană a Medicamentelor;
35. tari terțe – alte tari decât România și statele membre ale Uniunii Europene.
Capitolul II - Domeniu de aplicare
Art. 696 - (1) Prevederile prezentului titlu se aplică medicamentelor de uz uman, destinate punerii pe piața în România, fabricate industrial sau produse printr-o metoda implicând un proces industrial.
(2) În cazul în care, luând în considerare toate caracteristicile unui produs, acesta poate fi încadrat atât în definitia de „medicament”, cat și în definitia unui produs reglementat de alta lege naționala, se aplică prevederile prezentului titlu.
(3) Fără a aduce atingere prevederilor alin. (1) și ale art. 697 lit. d), cap. IV al prezentului titlu se aplică medicamentelor destinate exclusiv exportului și produselor intermediare.
Art. 697 - Prevederile prezentului titlu nu se aplică:
a) medicamentelor preparate în farmacie conform unei prescripții medicale pentru un anumit pacient (numite formule magistrale);
b) medicamentelor preparate în farmacie conform indicațiilor unei farmacopei și destinate eliberării directe către pacientii farmaciei respective (numite formule oficinale);
c) medicamentelor destinate studiilor de cercetare și dezvoltare, dar fără a aduce atingere prevederilor legale referitoare la implementarea bunei practici în desfășurarea studiilor clinice efectuate cu medicamente de uz uman;
d) produselor intermediare destinate a fi procesate de către un fabricant autorizat;
e) radionuclizilor utilizați sub forma de surse închise;
f) sângelui total, plasmei sau celulelor sangvine de origine umană, exceptând plasma preparata printr-o metoda care presupune un proces industrial.
Art. 698 - (1) Prezentul titlu nu deroga de la prevederile legislației naționale compatibilizate cu normele comunitare referitoare la protecția radiologica a persoanelor supuse examinarilor sau tratamentelor medicale ori la regulile de siguranță pentru protecția sănătății populației și a lucrătorilor împotriva pericolelor datorate radiatiilor ionizante.
(2) Prezentul titlu nu aduce atingere legislației naționale compatibilizate cu normele comunitare referitoare la schimbul de substanțe terapeutice de origine umană.
(3) Prezentul titlu nu aduce atingere competentelor Ministerului Sănătății Publice privind stabilirea prețurilor medicamentelor sau includerea medicamentelor în domeniul de aplicare a schemelor naționale de asigurări de sănătate, pe baza condițiilor de sănătate, economice și sociale.
Art. 699 - (1) Pentru rezolvarea unor nevoi speciale se pot exclude de la aplicarea prevederilor prezentului titlu medicamentele furnizate pentru a răspunde comenzilor nesolicitate, dar făcute cu buna-credința, conform specificatiilor unei persoane calificate autorizate, și destinate pacientilor aflați sub responsabilitatea sa directa. Condițiile de excludere se stabilesc prin ordin al ministrului sănătății publice.
(2) Ministerul Sănătății Publice autorizeaza temporar distribuția unui medicament neautorizat în situația unei suspiciuni de epidemie sau în cazul unei epidemii confirmate cu agenți patogeni, toxine, precum și în cazul unei suspiciuni de răspândire ori răspândire confirmată de agenți chimici sau radiatii nucleare care ar putea pune în pericol sănătatea populației ori în alte cazuri de necesitate neacoperite de medicamentele autorizate.
(3) Răspunderea civilă și administrativă a deținătorilor autorizațiilor de punere pe piața, fabricantilor și persoanelor calificate din sănătate, cu respectarea prevederilor alin. (1), nu este angajata pentru consecințele rezultând din:
a) utilizarea unui medicament altfel decât pentru indicațiile autorizate;
b) utilizarea unui medicament neautorizat, în cazul în care o asemenea utilizare este recomandată sau solicitată de o autoritate naționala competența ca răspuns la o suspiciune de răspândire sau la o răspândire confirmată a agenților patogeni, toxinelor, agenților chimici sau radiatiilor nucleare, susceptibilă sa producă daune.
(4) Prevederile alin. (3) se aplică indiferent dacă a fost sau nu eliberata o autorizație naționala ori comunitara de punere pe piața și nu aduc atingere dispozițiilor Legii nr. 240/2004 privind răspunderea producătorilor pentru pagubele generate de produsele cu defecte.
Capitolul III - Punerea pe piața
Secţiunea 1 - Autorizarea de punere pe piața
Art. 700 - (1) Nici un medicament nu poate fi pus pe piața în România fără o autorizație de punere pe piața emisă de către Agenția Naționala a Medicamentului, în conformitate cu prevederile prezentului titlu, sau fără o autorizație eliberata conform procedurii centralizate.
(2) Nici un medicament nu poate fi pus pe piața în România fără o autorizație de punere pe piața emisă de către Agenția Naționala a Medicamentului, în conformitate cu prevederile prezentului titlu.
(3) După ce un medicament a primit o autorizație inițială de punere pe piața, conform alin. (1), respectiv alin. (2), orice concentratii, forme farmaceutice, cai de administrare și forme de prezentare suplimentare, precum și orice variatii sau extensii trebuie autorizate separat conform alin. (1), respectiv alin. (2), sau incluse în autorizația inițială de punere pe piața; toate aceste autorizații de punere pe piața sunt considerate ca aparținând aceleiași autorizații globale, mai ales în scopul aplicării prevederilor art. 704 alin. (1) și ale art. 852.
(4) Deținătorul autorizației de punere pe piața este responsabil de punerea pe piața a medicamentului; desemnarea unui reprezentant nu exonereaza deținătorul autorizației de punere pe piața de răspundere juridică.
(5) Autorizația prevăzută la alin. (1), respectiv alin. (2), este necesară și pentru generatorii de radionuclizi, kiturile (truse), precursorii radionuclidici și medicamentele radiofarmaceutice fabricate industrial.
Art. 701 - Autorizația de punere pe piața nu este necesară pentru medicamentele radiofarmaceutice preparate la momentul utilizării de către o persoană sau instituție care, conform legislației naționale, este autorizata sa utilizeze aceste medicamente potrivit instrucțiunilor fabricantului, într-un centru sanitar acreditat și pornind exclusiv de la generatori de radionuclizi, kituri (truse) sau precursori radionuclidici autorizați.
Art. 702 - (1) În vederea obținerii unei autorizații de punere pe piața pentru un medicament trebuie depusa o cerere la Agenția Naționala a Medicamentului.
(2) Sunt exceptate de la prevederile alin. (1) medicamentele care trebuie să fie autorizate de Agenția Europeană a Medicamentelor prin procedura centralizata.
(3) O autorizație de punere pe piața nu poate fi eliberata decât unui solicitant stabilit în România sau într-un stat membru al Uniunii Europene.
(4) Cererea de autorizare de punere pe piața trebuie să fie însoțită de următoarele informații și documente, care trebuie să fie transmise în conformitate cu normele și protocoalele analitice, farmacotoxicologice și clinice referitoare la testarea medicamentelor, aprobate prin ordin al ministrului sănătății publice:
a) numele sau denumirea și domiciliul sau sediul social ale solicitantului și, unde este cazul, ale fabricantului;
b) denumirea medicamentului;
c) caracteristicile calitative și cantitative ale tuturor constituentilor medicamentului, inclusiv denumirea comuna internationala (DCI) recomandată de Organizația Mondială a Sănătății, dacă exista o asemenea denumire sau o referire la denumirea chimica relevanta;
d) evaluarea riscurilor pe care medicamentul le-ar putea prezenta pentru mediu; acest impact este evaluat și, de la caz la caz, se iau măsuri specifice pentru limitarea sa;
e) descrierea metodei de fabricație;
f) indicațiile terapeutice, contraindicatiile și reactiile adverse;
g) posologia, forma farmaceutica, modul și calea de administrare, precum și perioada de valabilitate prezumată;
h) explicațiile privind măsurile de precautie și siguranța care trebuie luate pentru depozitarea medicamentului, administrarea sa la pacienti și eliminarea reziduurilor, precum și indicarea riscurilor potențiale pe care medicamentul le prezintă pentru mediu;
i) descrierea metodelor de control utilizate de fabricant;
j) rezultatele:
– testelor farmaceutice (fizico-chimice, biologice sau microbiologice);
– testelor preclinice (toxicologice și farmacologice);
– studiilor clinice;
k) descrierea detaliată a sistemului de farmacovigilenta și, acolo unde este cazul, a sistemului de management al riscurilor pe care solicitantul îl va pune în aplicare;
l) o declarație privind faptul ca studiile clinice derulate în afară României și Uniunii Europene îndeplinesc criteriile etice din Normele referitoare la implementarea regulilor de buna practica în desfășurarea studiilor clinice efectuate cu medicamente de uz uman aprobate prin ordin al ministrului sănătății publice;
m) un rezumat al caracteristicilor produsului, conform art. 708, o macheta a ambalajului secundar, conținând detaliile prevăzute la art. 763, și ale ambalajului primar al medicamentului, conținând detaliile prevăzute la art. 764, precum și prospectul, conform art. 769;
n) un document care să ateste faptul ca fabricantul este autorizat sa producă medicamente în țara sa;
o) – câte o copie de pe fiecare autorizație de punere pe piața a medicamentului obținută într-un alt stat, însoțită de lista statelor membre ale Uniunii Europene în care cererea de autorizare depusa în conformitate cu Directiva 2001/83/CEinstituind codul comunitar al medicamentelor de uz uman, publicată în Jurnalul Oficial al Comunităților Europene (JOCE) nr. L311 din 28 noiembrie 2001, cu modificările și completările ulterioare, este în curs de examinare;
– o copie de pe rezumatul caracteristicilor produsului, propus de către solicitant, potrivit art. 708, sau aprobat de autoritatea competentă a statului membru al Uniunii Europene în acord cu art. 21 din Directiva 2001/83/CE ;
– o copie a prospectului propus conform art. 769 sau aprobat de autoritatea competentă a statului membru al Uniunii Europene conform art. 61 din Directiva 2001/83/CE ;
– detalii ale oricărei decizii de refuz al autorizării pronunțate într-un alt stat, precum și motivele acestei decizii.
Aceasta informație trebuie actualizată periodic;
p) o copie a oricărei desemnari a medicamentului ca medicament orfan în conformitate cu Regulamentul nr. 141/2000/CEprivind medicamentele orfane, publicat în Jurnalul Oficial al Comunităților Europene (JOCE) nr. L 018 din 22 ianuarie 2000, însoțită de o copie a opiniei relevante a Agenției Europene a Medicamentelor;
q) dovada ca solicitantul beneficiază de serviciile unei persoane calificate, responsabilă cu activitatea de farmacovigilenta, și ca dispune de mijloacele necesare pentru notificarea oricărei reactii adverse suspectate a aparea în România sau într-un alt stat.
(5) Documentele și informațiile privind rezultatele testelor farmaceutice și preclinice și ale studiilor clinice prevăzute la alin. (4) lit. j) sunt însoțite de rezumate conform prevederilor art. 709.
Art. 703 - O cererea de autorizare de punere pe piața pentru un generator de radionuclizi trebuie să conțină, pe lângă elementele prevăzute la art. 702 și la art. 704 alin. (1), următoarele informații și documente;
a) o descriere generală a sistemului, precum și o descriere detaliată a componentelor sistemului, care pot afecta compozitia sau calitatea preparării radionuclidului-fiica;
b) caracteristicile calitative și cantitative ale eluatului sau ale sublimatului.
Art. 704 - (1) Prin derogare de la prevederile art. 702 alin. (4) lit. j) și fără a aduce atingere legislației privind protecția proprietății industriale și comerciale, solicitantul nu trebuie să furnizeze rezultatele testelor preclinice și ale studiilor clinice, dacă poate demonstra ca medicamentul este un generic al unui medicament de referința care este sau a fost autorizat de cel puțin 8 ani în România, într-un stat membru al Uniunii Europene sau în Uniunea Europeană prin procedura centralizata.
Un medicament generic autorizat potrivit prezentei prevederi nu va fi comercializat înainte de trecerea a 10 ani de la autorizarea inițială a medicamentului de referința.
Prima teza se aplică și în cazul în care medicamentul de referința nu a fost autorizat în România, iar cererea pentru medicamentul generic a fost depusa în aceasta țara. În acest caz, solicitantul trebuie să indice în documentația depusa numele statului membru al Uniunii Europene în care medicamentul de referința este sau a fost autorizat. Agenția Naționala a Medicamentului solicita autorității competente din statul membru al Uniunii Europene indicat de solicitant confirmarea faptului ca medicamentul de referința este sau a fost autorizat, compozitia completa a medicamentului de referința și, dacă este cazul, alta documentație relevanta. La solicitări de acest tip ale autorităților competente din statele membre ale Uniunii Europene, Agenția Naționala a Medicamentului răspunde în cel mult o luna.
Perioada de 10 ani la care se face referire în teza a doua poate fi prelungită cu maximum un an dacă, în timpul primilor 8 ani din acei 10 ani, deținătorul autorizației de punere pe piața obține o autorizație pentru una sau mai multe indicații terapeutice noi care, potrivit evaluării științifice realizate în vederea autorizării, se considera ca aduc un beneficiu clinic semnificativ în comparatie cu terapiile existente.
(2) În înțelesul prezentului articol, termenii și notiunile folosite au următoarele semnificatii:
a) medicament de referința – un medicament autorizat în conformitate cu art. 700 și 702 ale prezentului titlu sau un medicament autorizat în unul dintre statele membre ale Uniunii Europene sau în Uniunea Europeană prin procedura centralizata;
b) medicament generic – un medicament care are aceeași compoziție calitativă și cantitativă în ceea ce privește substantele active și aceeași forma farmaceutica ca medicamentul de referința și a cărui bioechivalenta cu medicamentul de referința a fost demonstrata prin studii de biodisponibilitate corespunzătoare. Diferitele saruri, esteri, eteri, izomeri, amestecuri de izomeri, complecsi sau derivati, ai unei substanțe active sunt considerați aceeași substanța activa, dacă nu prezintă proprietăți semnificativ diferite în ceea ce privește siguranța și/sau eficacitatea. În acest caz, solicitantul trebuie să furnizeze informații suplimentare care să dovedească siguranța și/sau eficacitatea diferitelor saruri, esteri sau derivati ai unei substanțe active autorizate. Diferitele forme farmaceutice orale cu eliberare imediata sunt considerate a fi aceeași forma farmaceutica. Solicitantul nu trebuie să furnizeze studii de biodisponibilitate, dacă el poate demonstra ca medicamentul generic îndeplinește criteriile relevante asa cum sunt ele definite în ghidurile detaliate corespunzătoare.
(3) Dacă medicamentul nu se încadrează în definitia unui medicament generic conform alin. (2) lit. b) sau dacă bioechivalenta nu poate fi demonstrata prin studii de biodisponibilitate ori în cazul schimbărilor în substanța/substantele activa/active, indicațiile terapeutice, concentrația, forma farmaceutica sau calea de administrare, față de medicamentul de referința, este necesară furnizarea rezultatelor testelor preclinice și a studiilor clinice corespunzătoare.
(4) Când un medicament biologic, similar cu un medicament biologic de referința, nu îndeplinește condițiile pentru a se încadra în definitia medicamentelor generice, datorită în special diferențelor legate de materiile prime sau diferențelor dintre procesul de fabricație al medicamentului biologic și al medicamentului biologic de referința, trebuie furnizate rezultatele testelor preclinice și ale studiilor clinice corespunzătoare în legătură cu aceste condiții. Tipul și cantitatea datelor suplimentare de furnizat trebuie să respecte criteriile relevante prevăzute în Normele și protocoalele analitice, farmacotoxicologice și clinice referitoare la testarea medicamentelor, aprobate prin ordin al ministrului sănătății publice, precum și în ghidurile detaliate referitoare la acestea. Nu trebuie furnizate rezultatele altor teste și studii din dosarul medicamentului de referința.
(5) În cazul în care se depune o cerere pentru o noua indicație a unei substanțe cu utilizare bine stabilită, suplimentar față de prevederile alin. (1), se acordă o perioadă de exclusivitate a datelor noncumulativa de un an, dacă au fost efectuate teste preclinice și studii clinice semnificative referitoare la noua indicație.
(6) Desfășurarea testelor și studiilor necesare în scopul aplicării prevederilor alin. (1), (2), (3) și (4) și cerințele practice care rezultă nu sunt considerate ca fiind contrarii drepturilor privind brevetele și certificatele de protecție suplimentară pentru medicamente.
Art. 705 - Prin derogare de la prevederile art. 702 alin. (4) lit. j) și fără a aduce atingere legislației privind protecția proprietății industriale și comerciale, solicitantul nu trebuie să furnizeze rezultatele testelor preclinice și studiilor clinice dacă poate demonstra ca substantele active ale medicamentului au utilizare medicală bine stabilită în Uniunea Europeană de cel puțin 10 ani, au o eficacitate recunoscută și un nivel de siguranță acceptabil în condițiile stabilite în Normele și protocoalele analitice, farmacotoxicologice și clinice referitoare la testarea medicamentelor, aprobate prin ordin al ministrului sănătății publice; în acest caz, rezultatele testelor și studiilor vor fi înlocuite de literatura științifică corespunzătoare.
Art. 706 - În cazul medicamentelor ce conțin substanțe active care intră în compozitia unor medicamente autorizate, dar care nu au fost încă utilizate într-o combinație în scop terapeutic, trebuie furnizate rezultatele unor noi teste preclinice și studii clinice în legătură cu acea combinație, conform prevederilor art. 702 alin. (4) lit. j), dar nu este necesară furnizarea referințelor științifice privind fiecare substanța activa.
Art. 707 - După eliberarea autorizației de punere pe piața, deținătorul autorizației poate permite utilizarea documentației farmaceutice, preclinice și clinice din dosarul medicamentului, în vederea examinării solicitărilor ulterioare în legătură cu alte medicamente având aceeași compoziție calitativă și cantitativă de substanțe active și aceeași forma farmaceutica.
Art. 708 - Rezumatul caracteristicilor produsului conține, în ordinea indicată mai jos, următoarele informații:
1. denumirea medicamentului urmată de concentrație și de forma farmaceutica;
2. compozitia calitativă și cantitativă în ceea ce privește substantele active și acei excipienti a căror cunoaștere este necesară pentru corecta administrare a medicamentului; se folosesc denumirile comune uzuale sau denumirile chimice;
3. forma farmaceutica;
4. date clinice:
4.1. indicații terapeutice;
4.2. doze și mod de administrare pentru adulti și, dacă este cazul, pentru copii;
4.3. contraindicatii;
4.4. atenționari și precautii speciale pentru utilizare și, în cazul medicamentelor imunologice, orice precautii speciale ce trebuie luate de persoanele care manipuleaza astfel de produse și le administrează pacientilor, împreună cu precautiile care trebuie luate de pacient;
4.5. interactiuni cu alte medicamente și alte forme de interactiune;
4.6. utilizare în timpul sarcinii și alaptarii;
4.7. efecte asupra capacității de a conduce vehicule și de a folosi utilaje;
4.8. reactii adverse;
4.9. supradozaj (simptome, proceduri de urgenta, antidoturi);
5. proprietăți farmacologice:
5.1. proprietăți farmacodinamice;
5.2. proprietăți farmacocinetice;
5.3. date preclinice de siguranță;
6. informații farmaceutice:
6.1. lista excipientilor;
6.2. incompatibilități majore;
6.3. perioada de valabilitate, inclusiv după reconstituirea medicamentului sau după ce ambalajul primar a fost deschis pentru prima data, unde este cazul;
6.4. precautii speciale pentru păstrare;
6.5. natura și conținutul ambalajului;
6.6. precautii speciale privind eliminarea medicamentelor nefolosite sau a reziduurilor rezultate din aceste medicamente, dacă este cazul;
7. deținătorul autorizației de punere pe piața;
8. numărul (numerele) autorizației de punere pe piața;
9. data primei autorizari sau a reînnoirii autorizației;
10. data revizuirii textului;
11. pentru medicamentele radiofarmaceutice, detaliile complete privind dozimetria radiatiilor interne;
12. pentru medicamentele radiofarmaceutice, instrucțiuni suplimentare detaliate pentru prepararea extemporanee și controlul calității unui astfel de preparat și, unde este cazul, durata maxima de păstrare în timpul căreia orice preparat intermediar, cum ar fi o elutie sau medicamentul gata de utilizare, corespunde specificatiilor; în cazul autorizarilor conform prevederilor art. 704, acele părți ale rezumatului caracteristicilor medicamentului de referința referitoare la indicații sau forme farmaceutice încă protejate de brevet la momentul în care un medicament generic este pus pe piața nu trebuie incluse.
Art. 709 - (1) Înaintea depunerii la Agenția Naționala a Medicamentului a rezumatelor detaliate prevăzute la art. 702 alin. (5), solicitantul trebuie să se asigure ca acestea au fost elaborate și semnate de experți cu calificarile tehnice și profesionale necesare, care trebuie să fie prezentate într-un scurt curriculum vitae.
(2) Persoanele având calificarile tehnice și profesionale prevăzute la alin. (1) trebuie să justifice orice utilizare a literaturii științifice prevăzute la art. 705 în conformitate cu condițiile stabilite în Normele și protocoalele analitice, farmacotoxicologice și clinice referitoare la testarea medicamentelor, aprobate prin ordin al ministrului sănătății publice.
(3) Rapoartele detaliate ale experților fac parte din dosarul pe care solicitantul îl prezintă la Agenția Naționala a Medicamentului.
Secţiunea a 2-a - Dispozițiile speciale aplicabile medicamentelor homeopate
Art. 710 - (1) Medicamentele homeopate fabricate și puse pe piața în România trebuie să fie autorizate conform art. 711, 712 și 713.
(2) Agenția Naționala a Medicamentului trebuie să elaboreze o procedură de autorizare simplificata pentru medicamentele la care se face referire la art. 711, care să fie aprobată prin ordin al ministrului sănătății publice.
Art. 711 - (1) Pot face obiectul unei proceduri speciale de autorizare simplificata numai medicamentele homeopate care satisfac toate condițiile următoare:
– cale de administrare orala sau externa;
– absenta unor indicații terapeutice specifice pe eticheta produsului sau în orice informație legată de produsul respectiv;
– existenta unui grad sufucient de dilutie pentru a garanta siguranța medicamentului; în particular, medicamentul nu poate conține nici mai mult de o parte la 10.000 din tinctura-mama, nici mai mult de 1% din cea mai mica doza folosită în alopatie pentru substantele active a căror prezenta într-un medicament alopat necesita prezentarea unei prescripții medicale.
La momentul autorizării, Agenția Naționala a Medicamentului stabilește clasificarea privind modul de eliberare a medicamentului.
(2) Criteriile și regulile procedurale prevăzute la art. 722 alin. (1), art. 727-732, 824, 828 și 842 sunt aplicabile prin analogie la procedura specială de autorizare simplificata pentru medicamentele homeopate, cu excepția dovedirii eficacitatii terapeutice.
Art. 712 - (1) O cerere pentru autorizare simplificata poate să se refere la o serie de medicamente derivate din aceeași susa homeopata.
(2) Pentru a demonstra în special calitatea farmaceutica și omogenitatea de la o serie de fabricație la alta a acestor medicamente, cererea trebuie să fie însoțită de următoarele documente:
– denumirea științifică sau alta denumire dintr-o farmacopee a susei/suselor homeopate, împreună cu declararea diverselor cai de administrare, forme farmaceutice și grade de dilutie care urmează să fie autorizate;
– un dosar care să descrie modul de obținere și control al suselor homeopate și justificarea utilizării homeopate a acestora, pe baza unei bibliografii adecvate;
– dosarul de fabricație și control al fiecărei forme farmaceutice și o descriere a metodei de diluare și dinamizare;
– autorizația de fabricație a medicamentelor respective;
– copii ale eventualelor autorizații sau certificate de înregistrare obținute pentru aceste medicamente în statele membre ale Uniunii Europene;
– una sau mai multe machete ori mostre ale ambalajelor primare și secundare ale medicamentelor ce urmează să fie autorizate;
– date privind stabilitatea medicamentului.
Art. 713 - (1) Medicamentele homeopate, altele decât cele prevăzute la art. 711 alin. (1), sunt autorizate și etichetate conform prevederilor art. 702 și 704-708.
(2) Dispozițiile cap. X sunt aplicabile medicamentelor homeopate, cu excepția celor prevăzute la art. 711 alin. (1).
Secţiunea a 3-a - Prevederi speciale aplicabile medicamentelor din plante medicinale cu utilizare tradiționala
Art. 714 - (1) Se stabilește o procedură simplificata de autorizare, denumita în continuare autorizare pentru utilizare tradiționala, pentru medicamente din plante medicinale cu utilizare tradiționala ce îndeplinesc în mod cumulativ următoarele criterii:
a) au indicații adecvate exclusiv medicamentelor din plante medicinale cu utilizare tradiționala care, datorită compoziției și scopului lor, sunt concepute și destinate a fi utilizate fără supravegherea unui medic în ceea ce privește stabilirea diagnosticului, prescrierea și monitorizarea tratamentului;
b) se administrează exclusiv în conformitate cu o concentrație și o posologie specificate;
c) sunt preparate de uz oral, extern și/sau pentru inhalatii;
d) perioada de utilizare tradiționala prevăzută la art. 716 alin. (1) lit. c) s-a încheiat;
e) informațiile referitoare la utilizarea tradiționala a medicamentului sunt suficiente; în mod deosebit, informațiile trebuie să dovedească faptul ca medicamentul nu este daunator în condițiile de utilizare specificate sau ca efectele farmacologice și eficacitatea medicamentului sunt plauzibile pe baza utilizării indelungate și experienței.
(2) Prin derogare de la prevederile art. 695 pct. 31, prezenta în medicamentele din plante a vitaminelor sau mineralelor, pentru siguranța cărora exista dovezi bine documentate, nu împiedica produsul de a fi eligibil pentru autorizare în conformitate cu prevederile alin. (1), cu condiția ca acțiunea vitaminelor și mineralelor să fie auxiliara față de aceea a ingredientelor active din plante, raportat la indicația/indicațiile revendicata/revendicate.
(3) Totuși, în cazul în care Agenția Naționala a Medicamentului considera ca un medicament din plante îndeplinește criteriile pentru autorizare conform art. 700 sau 711, prevederile prezentei secțiuni nu se aplică.
Art. 715 - (1) Solicitantul și deținătorul autorizației de punere pe piața trebuie să fie stabiliți în România sau într-un stat membru al Uniunii Europene.
(2) Pentru a obține o autorizare pentru utilizare tradiționala, solicitantul depune o cerere la Agenția Naționala a Medicamentului.
Art. 716 - (1) Cererea trebuie să fie însoțită de:
a) informațiile și documentele următoare:
(i) cele prevăzute la art. 702 alin. (4) lit. a)-i), m) și n);
(îi) rezultatele testelor farmaceutice la care se face referire la art. 702 alin. (4) lit. j) prima liniuța;
(iii) rezumatul caracteristicilor produsului fără datele specificate la art. 708 pct. 4;
(iv) în cazul combinatiilor prevăzute la art. 695 pct. 31 sau art. 714 alin. (2), informațiile la care face referire art. 714 alin. (1) lit. e) referitoare la combinatii ca atare; dacă ingredientele active individuale nu sunt suficient cunoscute, datele se referă și la acestea;
b) orice autorizație de punere pe piața obținută de solicitant într-un alt stat și informațiile privind orice decizie de a refuza autorizarea de punere pe piața în Uniunea Europeană sau într-o țara terta, precum și motivele pentru o asemenea decizie;
c) dovezile bibliografice sau opinia unui expert privind faptul ca medicamentul respectiv sau un medicament corespondent a fost utilizat timp de cel puțin 30 de ani înainte de data depunerii cererii, dintre care cel puțin 15 ani în Uniunea Europeană; Agenția Naționala a Medicamentului poate cere Comitetului pentru medicamente pe bază de plante din structura Agenției Europene a Medicamentelor sa elaboreze o opinie privind corectitudinea dovezilor referitoare la utilizarea îndelungată a produsului în discuție sau a unui produs corespondent. În acest scop, Agenția Naționala a Medicamentului trimite documentația relevanta pentru dosarul transmis Comitetului;
d) un studiu al datelor bibliografice privind siguranța, împreună cu un raport al expertului și, atunci când se solicita de Agenția Naționala a Medicamentului, date necesare pentru evaluarea siguranței medicamentului. Normele și protocoalele analitice, farmacotoxicologice și clinice referitoare la testarea medicamentelor, aprobate prin ordin al ministrului sănătății publice, se aplică prin analogie informațiilor și documentelor prevăzute la lit. a).
(2) Produsul corespondent, în sensul alin. (1) lit. c), este un produs care conține aceleași ingrediente active indiferent de excipientii utilizați și este identic sau similar în ceea ce privește indicația, concentrația, posologia și calea de administrare cu medicamentul pentru care s-a depus cererea.
(3) Cerința de a demonstra utilizarea medicală pe o perioadă de 30 de ani, la care se face referire în alin. (1) lit. c), este îndeplinită chiar și atunci când comercializarea produsului nu s-a bazat pe o autorizație specifică; este, de asemenea, îndeplinită cerința respectiva dacă numărul sau cantitatea ingredientelor medicamentului s-a redus în această perioadă.
(4) Dacă produsul a fost folosit în România sau în Uniunea Europeană mai puțin de 15 ani, dar sub celelalte aspecte este eligibil pentru autorizare simplificata, Agenția Naționala a Medicamentului, primind o cerere pentru o asemenea autorizare, se adresează Comitetului pentru medicamente pe bază de plante care funcționează în cadrul Agenției Europene a Medicamentelor. În acest scop, Agenția Naționala a Medicamentului trimite documentația relevanta pentru susținerea procedurii de arbitraj. Dacă Comitetul elaborează o monografie comunitara, aceasta trebuie să fie luată în considerare de către Agenția Naționala a Medicamentului atunci când ia decizia sa finala.
Art. 717 - (1) Fără a contraveni prevederilor art. 721 alin. (1), secțiunea a 5-a a cap. III se aplică prin analogie autorizațiilor eliberate în conformitate cu art. 714, cu condiția ca:
a) sa fi fost elaborata o monografie comunitara pentru planta respectiva în conformitate cu prevederile art. 721 alin. (3); sau
b) medicamentul din plante să fie constituit din substanțe vegetale, preparate pe bază de plante sau combinatii ale acestora, conținute în lista la care se face referire la art. 719.
(2) Pentru alte medicamente din plante la care se face referire la art. 714, atunci când Agenția Naționala a Medicamentului evalueaza o cerere de autorizare pentru utilizare tradiționala trebuie să țină seama de autorizațiile sau certificatele de înregistrare eliberate de un stat membru al Uniunii Europene în concordanta cu prevederile cap. 2a al Directivei 2001/83/CE.
Art. 718 - (1) Autorizarea pentru utilizare tradiționala este refuzată dacă cererea nu este conformă cu prevederile art. 714, 715 sau 716 ori dacă cel puțin una dintre următoarele condiții este îndeplinită:
a) compozitia calitativă și cantitativă nu este conformă cu cea declarata;
b) indicațiile nu sunt conforme cu condițiile prevăzute la art. 714;
c) produsul poate fi daunator în condiții normale de utilizare;
d) datele referitoare la utilizarea tradiționala sunt insuficiente, în special dacă efectele farmacologice sau eficacitatea nu sunt plauzibile ținând cont de vechimea utilizării și de experienta;
e) calitatea farmaceutica nu este demonstrata satisfăcător.
(2) Agenția Naționala a Medicamentului trebuie să anunțe solicitantul, Comisia Europeană și orice autoritate competentă care solicită aceasta despre orice decizie de a respinge autorizarea pentru utilizare tradiționala și motivele deciziei.
Art. 719 - (1) Agenția Naționala a Medicamentului preia lista substanțelor vegetale, preparatelor și combinatiilor din acestea, care se folosesc în medicamente din plante cu utilizare tradiționala, elaborata de Comisia Europeană. Lista conține, pentru fiecare substanța vegetala, indicația, concentrația specificată și modul de administrare, calea de administrare și orice alta informație necesară pentru utilizarea în siguranța a substanțelor vegetale ca medicamente cu utilizare tradiționala.
(2) Până la momentul aderării sunt aplicabile reglementările Agenției Naționale a Medicamentului referitoare la medicamentele din plante cu utilizare tradiționala, precum și lista substanțelor vegetale, preparatelor și combinatiilor din acestea care se folosesc în medicamente din plante cu utilizare tradiționala, inclusă în aceste reglementări.
(3) Dacă o cerere de autorizare pentru utilizare tradiționala este în legătură cu o substanța vegetala, un preparat pe bază de plante sau o combinație a acestora prevăzută în lista la care se face referire la alin. (1), respectiv alin. (2), informațiile prevăzute la art. 716 alin. (1) lit. b), c) și d) nu trebuie să fie furnizate; prevederile art. 718 alin. (1) lit. c) și d) nu se aplică.
(4) Dacă o substanța vegetala, un preparat pe bază de plante sau o combinație a acestora nu mai este inclusă în lista la care se face referire la alin. (1), respectiv alin. (2), autorizațiile eliberate în conformitate cu prevederile alin. (3) pentru medicamente din plante conținând aceasta substanța, preparat pe bază de plante sau combinație a acestora se retrag, dacă informațiile și documentele la care se face referire la art. 716 alin. (1) nu sunt trimise în interval de 3 luni.
Art. 720 - (1) Art. 697 lit. a) și b), art. 700 alin. (1), art. 709, art. 722 alin. (1), art. 724, 725, 728, 730, 731, 748-761, 780-796, 812-820, art. 823 alin. (1) și (3), art. 824, 828-830, 839, 840, 842, art. 843 alin. (2) și art. 846 ale prezentului titlu, precum și Principiile și ghidurile de buna practica de fabricație pentru medicamentele de uz uman și medicamentele investigationale de uz uman, aprobate prin ordin al ministrului sănătății publice, se aplică prin analogie autorizațiilor pentru utilizare tradiționala eliberate în baza prevederilor prezentei secțiuni.
(2) În plus față de cerințele prevăzute la art. 763-775, orice etichetare și prospect trebuie să conțină o precizare referitoare la faptul ca:
a) produsul este un medicament din plante medicinale cu utilizare tradiționala care se folosește pentru indicația specificată, exclusiv pe baza utilizării indelungate; și
b) utilizatorul trebuie să consulte un medic sau alt profesionist din domeniul sănătății dacă simptomele persista în timpul utilizării medicamentului sau dacă apar reactii adverse care nu sunt menționate în prospect.
(3) În plus față de prevederile art. 797-810, orice material publicitar pentru un medicament autorizat în conformitate cu prevederile prezentei secțiuni trebuie să conțină următoarea atenționare: „Acest medicament din plante medicinale cu utilizare tradiționala se folosește pentru indicația/indicațiile specificată/specificate, exclusiv pe baza utilizării indelungate”.
Art. 721 - (1) Agenția Naționala a Medicamentului desemnează, pentru un mandat de 3 ani ce poate fi reînnoit, un membru și un înlocuitor în Comitetul pentru medicamente din plante. Înlocuitorii îi reprezintă pe membri și votează în locul acestora atunci când ei lipsesc. Membrii și înlocuitorii acestora sunt aleși în funcție pentru rolul și experienta lor în evaluarea medicamentelor din plante și reprezintă Agenția Naționala a Medicamentului.
(2) Până la momentul aderării României la Uniunea Europeană, reprezentanții Agenției Naționale a Medicamentului participa la activitățile Comitetului pentru medicamente din plante în calitate de observatori activi.
(3) La examinarea unei cereri de autorizare de punere pe piața, Agenția Naționala a Medicamentului trebuie să ia în considerare monografiile comunitare pentru plante, elaborate și publicate de Comitetul pentru medicamente din plante al Agenției Europene a Medicamentelor. În cazul în care nu a fost încă elaborata nici o asemenea monografie comunitara pentru plante, se poate face referire la alte monografii, publicații sau informații adecvate.
Când sunt elaborate noi monografii comunitare de plante, deținătorul autorizației de punere pe piața apreciază dacă este necesară modificarea documentației de autorizare în conformitate cu monografia respectiva. Deținătorul autorizației de punere pe piața informează Agenția Naționala a Medicamentului în legătură cu modificarea respectiva.
Secţiunea a 4-a - Proceduri privind autorizarea de punere pe piața
Art. 722 - (1) Agenția Naționala a Medicamentului ia toate măsurile pentru a se asigura ca procedura de eliberare a autorizației de punere pe piața este finalizată în maximum 210 zile de la depunerea unei cereri valide; cererile pentru autorizare de punere pe piața în România în încă în unul sau mai multe state membre ale Uniunii Europene privind același medicament se depun în concordanta cu prevederile art. 735-747.
(2) Dacă Agenția Naționala a Medicamentului constata ca o alta cerere de autorizare de punere pe piața pentru același medicament este examinata în alt stat membru al Uniunii Europene, Agenția Naționala a Medicamentului refuza evaluarea cererii și îi comunică solicitantului ca în acest caz se aplică prevederile art. 735-747.
Art. 723 - Când Agenția Naționala a Medicamentului este informată, în conformitate cu prevederile art. 702 alin. (4) lit. o), ca un alt stat membru al Uniunii Europene a autorizat un medicament pentru care se solicita autorizarea în România, Agenția Naționala a Medicamentului respinge solicitarea, dacă aceasta nu a fost depusa în conformitate cu prevederile art. 735-747.
Art. 724 - Pentru a examina cererea depusa în conformitate cu prevederile art. 702 și 704-707, Agenția Naționala a Medicamentului:
a) trebuie să verifice dacă dosarul prezentat în susținerea cererii este în concordanta cu art. 702 și 704-707 și sa examineze dacă toate condițiile pentru eliberarea unei autorizații de punere pe piața a medicamentelor sunt respectate;
b) poate supune medicamentul, materiile prime și, dacă este necesar, produsii intermediari sau alte componente, testarii în laboratoarele de control proprii sau în laboratoare autorizate/recunoscute de Agenția Naționala a Medicamentului în acest scop și se asigura ca metodele de control utilizate de fabricant și descrise în specificățiile ce însoțesc cererea, conform art. 702 alin. (4) lit. i), sunt corespunzătoare;
c) poate cere, dacă este cazul, ca solicitantul sa completeze dosarul ce însoțește cererea cu elementele prevăzute la art. 702 alin. (4) și la art. 704-707; dacă Agenția Naționala a Medicamentului se prevalează de aceasta opțiune, intervalul de timp prevăzut la art. 722 alin. (1) se suspenda până când informațiile suplimentare cerute sunt furnizate; intervalul de timp se suspenda și în situația în care se permite solicitantului sa furnizeze explicații orale sau scrise, până la furnizarea acestora;
d) poate efectua inspecții în anumite situații, atunci când considera ca exista motive pentru a suspecta nerespectarea principiilor și ghidurilor de buna practica de fabricație menționate la art. 756.
Art. 725 - Ministerul Sănătății Publice ia toate măsurile necesare pentru a se asigura ca:
a) Agenția Naționala a Medicamentului verifica faptul ca fabricantii și importatorii de medicamente provenind din tari terțe pot desfășura producția conform specificatiilor furnizate în aplicarea art. 702 alin. (4) lit. e) și/sau să efectueze controale în conformitate cu metodele descrise în dosarul care însoțește cererea facuta potrivit prevederilor art. 702 alin. (4) lit. i);
b) Agenția Naționala a Medicamentului autorizeaza fabricantii și importatorii de medicamente provenind din tari terțe, în cazuri justificate, sa delege efectuarea anumitor faze ale producției și/sau controalelor prevăzute la lit. a) unor terți; în acest caz, verificările Agenției Naționale a Medicamentului se realizează și în localurile terților desemnați.
Art. 726 - (1) La emiterea autorizației de punere pe piața deținătorul este informat de către Agenția Naționala a Medicamentului privind rezumatul caracteristicilor produsului, asa cum a fost el aprobat.
(2) Agenția Naționala a Medicamentului ia toate măsurile necesare pentru a se asigura ca informațiile conținute în rezumatul caracteristicilor produsului sunt în conformitate cu cele acceptate la emiterea autorizației de punere pe piața sau ulterior.
(3) Agenția Naționala a Medicamentului face publică fără întârziere autorizația de punere pe piața împreună cu rezumatul caracteristicilor produsului, pentru fiecare medicament autorizat.
(4) Agenția Naționala a Medicamentului întocmește un raport de evaluare și comentarii asupra documentației în ceea ce privește rezultatele testelor farmaceutice și preclinice și ale studiilor clinice ale medicamentului în cauza; raportul de evaluare este actualizat ori de câte ori devin disponibile informații noi, importante pentru evaluarea calității, siguranței și eficacitatii medicamentului în cauza. Agenția Naționala a Medicamentului pune fără întârziere la dispoziție publicului raportul de evaluare și motivele care au stat la baza deciziei sale, cu excepția informațiilor comerciale confidențiale. Motivele sunt furnizate separat pentru fiecare indicație terapeutică solicitată.
(5) În termen de 5 zile de la validarea autorizației de punere pe piața de către Ministerul Sănătății Publice, conform Ordonanței Guvernului nr. 125/1998, aprobată cu modificări și completări prin Legea nr. 594/2002, cu modificările și completările ulterioare, Agenția Naționala a Medicamentului publică pe pagina de Internet informația privind autorizarea pentru fiecare medicament autorizat.
Art. 727 - (1) În situații excepționale și ca urmare a consultării cu solicitantul, autorizația poate fi acordată sub rezerva asumării de către acesta a obligației de a îndeplini anumite condiții privind mai ales siguranța medicamentului, informarea Agenției Naționale a Medicamentului asupra oricărui incident legat de utilizarea acestuia și măsurile care se impun.
(2) Aceasta autorizație poate fi acordată numai pentru motive obiective, verificabile și trebuie să se bazeze pe una dintre premisele prevăzute în Normele și protocoalele analitice, farmacotoxicologice și clinice referitoare la testarea medicamentelor, aprobate prin ordin al ministrului sănătății publice; menținerea autorizației se face în baza reevaluarii anuale a acestor condiții.
(3) Lista acestor condiții trebuie să fie facuta publică fără întârziere, împreună cu termenele limita și cu datele de îndeplinire.
Art. 728 - (1) După emiterea unei autorizații de punere pe piața, deținătorul autorizației trebuie, în ceea ce privește metodele de fabricație și control prevăzute la art. 702 alin. (4) lit. e) și i), sa țină seama de progresul științific și tehnic și sa introducă orice schimbare necesară pentru a permite fabricarea și verificarea medicamentului prin mijloace științifice general acceptate; aceste schimbări trebuie aprobate de către Agenția Naționala a Medicamentului.
(2) Deținătorul autorizației de punere pe piața trebuie să furnizeze imediat Agenției Naționale a Medicamentului orice informație noua care ar atrage modificarea informațiilor sau documentelor prevăzute la art. 702 alin. (4), art. 704-706 și 708 sau 740 ori în Normele și protocoalele analitice, farmacotoxicologice și clinice referitoare la testarea medicamentelor, aprobate prin ordin al ministrului sănătății publice.
(3) Deținătorul autorizației de punere pe piața trebuie să informeze Agenția Naționala a Medicamentului în special privind orice interdicție sau restrictie impusa de autoritățile competente din orice țara unde medicamentul este pus pe piața și orice informație ce poate influența evaluarea riscurilor și beneficiilor medicamentului de uz uman în cauza.
(4) Pentru ca raportul risc-beneficiu să fie evaluat în mod continuu, Agenția Naționala a Medicamentului poate solicita în orice moment deținătorului autorizației de punere pe piața sa furnizeze date ce demonstreaza ca raportul risc-beneficiu rămâne favorabil.
Art. 729 - (1) După acordarea unei autorizații de punere pe piața, deținătorul trebuie să informeze Agenția Naționala a Medicamentului asupra datei de punere efectivă pe piața a medicamentului de uz uman în România, luând în considerare diferitele forme de prezentare autorizate.
(2) Deținătorul trebuie, de asemenea, sa anunțe Agenția Naționala a Medicamentului dacă produsul încetează să fie pus pe piața fie temporar, fie permanent; o astfel de notificare trebuie să fie facuta cu cel puțin două luni înainte de întreruperea punerii pe piața a medicamentului, cu excepția situațiilor excepționale.
(3) Pe baza solicitării Ministerului Sănătății Publice, în special în contextul farmacovigilentei, deținătorul autorizației de punere pe piața trebuie să furnizeze Ministerului Sănătății Publice toate datele privind volumul de vânzări al medicamentului și orice date aflate în posesia acestuia privind volumul de prescrieri.
Art. 730 - (1) Fără a aduce atingere prevederilor alin. (5) și (6), o autorizație de punere pe piața este valabilă 5 ani.
(2) Autorizația de punere pe piața poate fi reînnoită după 5 ani pe baza unei reevaluari a raportului risc-beneficiu de către Agenția Naționala a Medicamentului, dacă aceasta autoritate a eliberat autorizația; în acest scop, cu cel puțin 6 luni înainte de expirarea autorizației de punere pe piața, în conformitate cu prevederile alin. (1), deținătorul acesteia trebuie să depună la Agenția Naționala a Medicamentului o versiune consolidata a dosarului cu privire la calitate, siguranța și eficacitate, inclusiv orice variatie survenită de la acordarea autorizației.
(3) Valabilitatea autorizației de punere pe piața reînnoite conform alin. (2) este de 5 ani.
(4) Medicamentele pentru care s-au depus cereri de reinnoire a autorizației de punere pe piața pot fi menținute în circuitul terapeutic până la soluționarea cererii de reinnoire a autorizației.
(5) O dată reînnoită, autorizația de punere pe piața este valabilă pe o perioadă nelimitată, cu excepția situației în care Agenția Naționala a Medicamentului decide, pe baza unor motive justificate privind farmacovigilenta, sa procedeze la o alta reinnoire a autorizației după 5 ani, în conformitate cu prevederile alin. (2).
(6) Orice autorizație de punere pe piața, care în primii 3 ani de la emitere nu a fost urmată de punerea efectivă a medicamentului pe piața în România, își încetează valabilitatea.
(7) Dacă un medicament autorizat, pus pe piața anterior, nu mai este prezent timp de 3 ani consecutivi în România, autorizația își încetează valabilitatea.
(8) Agenția Naționala a Medicamentului poate, în situații excepționale și ținând cont de interesul sănătății publice, sa acorde derogări de la prevederile alin. (6) și (7); astfel de excepții trebuie riguros justificate.
(9) Dacă pentru un medicament nu se solicita reînnoirea autorizației de punere pe piața în termenul prevăzut la alin. (2), medicamentul poate fi menținut în circuitul terapeutic până la epuizarea cantităților distribuite în rețeaua farmaceutica, dar nu mai mult de un an de la expirarea autorizației de punere pe piața.
(10) Procedura de autorizare de punere pe piața a unui medicament poate fi întreruptă ca urmare a retragerii cererii solicitantului.
Art. 731 - Autorizarea de punere pe piața nu inlatura răspunderea civilă și penală a fabricantului și, după caz, a deținătorului autorizației de punere pe piața.
Art. 732 - (1) Autorizarea de punere pe piața este refuzată dacă, după verificarea specificatiilor și documentelor prevăzute la art. 702 și 704-707, se constată că:
a) raportul risc-beneficiu nu este considerat a fi favorabil; sau
b) eficacitatea terapeutică este insuficient fundamentată de către solicitant; sau
c) compozitia calitativă și cantitativă nu este conformă cu declarația.
(2) Autorizarea este refuzată, de asemenea, dacă orice informație sau document depus în susținerea cererii nu este conform cu prevederile art. 702 și 704-707.
(3) Solicitantul sau deținătorul autorizației de punere pe piața este responsabil de acuratetea documentelor și datelor depuse.
Art. 733 - Medicamentele autorizate în vederea punerii pe piața în Uniunea Europeană, prin procedura centralizata, recunoaștere mutuala sau descentralizata, se autorizeaza în România conform unor proceduri simplificate prezentate în reglementările Agenției Naționale a Medicamentului.
Art. 734 - Medicamentele realizate în România prin cooperare sunt supuse procedurii de autorizare de punere pe piața în funcție de natura cooperării, conform reglementărilor Agenției Naționale a Medicamentului.
Secţiunea a 5-a - Procedura de recunoaștere mutuala și procedura descentralizata
Art. 735 - (1) Agenția Naționala a Medicamentului desemnează pentru un mandat de 3 ani, ce se poate reînnoi, un reprezentant în Grupul de coordonare a procedurilor descrise în prezenta secțiune; reprezentantul Agenției Naționale a Medicamentului în Grupul de coordonare poate fi însoțit de experți.
(2) Până la momentul aderării României la Uniunea Europeană, reprezentantul Agenției Naționale a Medicamentului participa la activitățile Grupului de coordonare în calitate de observator activ.
Art. 736 - (1) În scopul obținerii autorizației de punere pe piața în România și în încă unul sau mai multe state membre ale Uniunii Europene, un solicitant depune cereri însoțite de dosare identice la Agenția Naționala a Medicamentului și la autoritățile competente din aceste state. Dosarul conține informațiile și documentele prevăzute la art. 702 și 704-708. Documentele depuse trebuie să includă o lista a statelor membre ale Uniunii Europene unde a fost depusa cererea.
Solicitantul cere ca România sau alt stat membru al Uniunii Europene sa acționeze ca „stat membru de referința” și sa elaboreze un raport de evaluare a medicamentului în acord cu prevederile alin. (2) sau (3).
(2) Dacă medicamentul a primit deja o autorizație de punere pe piața la momentul depunerii cererii, România acționează ca stat membru interesat și Agenția Naționala a Medicamentului recunoaște autorizația de punere pe piața acordată de statul membru de referința. În acest scop, deținătorul autorizației de punere pe piața cere statului membru de referința fie sa elaboreze un raport de evaluare privind medicamentul, fie, dacă este cazul, sa actualizeze raportul de evaluare existent. În cazul în care România este statul membru de referința, Agenția Naționala a Medicamentului trebuie să elaboreze/actualizeze raportul de evaluare în cel mult 90 de zile de la primirea unei cereri valide.
Raportul de evaluare împreună cu rezumatul caracteristicilor produsului, etichetarea și prospectul aprobate sunt trimise statelor membre interesate și solicitantului.
(3) Dacă medicamentul nu a primit autorizație de punere pe piața la momentul depunerii cererii la Agenția Naționala a Medicamentului, în cazul în care România este statul membru de referința, solicitantul îi cere Agenției Naționale a Medicamentului sa pregătească un proiect de raport de evaluare, un proiect al rezumatului caracteristicilor produsului și un proiect al etichetarii și prospectului; Agenția Naționala a Medicamentului pregătește aceste proiecte în maximum 120 de zile după primirea unei cereri valide și le trimite statelor membre interesate și solicitantului. La înregistrarea acordului tuturor părților, Agenția Naționala a Medicamentului închide procedura și îl informează pe solicitant în consecința.
(4) În cazul în care România acționează ca stat membru interesat, în termen de 90 de zile de la primirea documentelor la care se face referire în alin. (2) și (3), Agenția Naționala a Medicamentului aproba raportul de evaluare, rezumatul caracteristicilor produsului, etichetarea și prospectul și informează statul membru de referința în consecința.
(5) Dacă a fost depusa o cerere potrivit prevederilor alin. (1), Agenția Naționala a Medicamentului adopta o decizie în conformitate cu raportul de evaluare, rezumatul caracteristicilor produsului, etichetarea și prospectul, asa cum au fost aprobate, în termen de 30 de zile de la înștiințarea privind acordul.
Art. 737 - (1) Dacă, în perioada prevăzută la art. 736 alin. (4), Agenția Naționala a Medicamentului nu poate aproba raportul de evaluare, rezumatul caracteristicilor produsului, etichetarea și prospectul, datorită unui risc potențial grav pentru sănătatea publică, trebuie să expuna detaliat motivele și să le comunice statului membru de referința, celorlalte state membre interesate și solicitantului; punctele de dezacord sunt transmise imediat Grupului de coordonare.
(2) Agenția Naționala a Medicamentului aplica prevederile ghidurilor adoptate de Comisia Europeană, care definesc riscul potențial grav pentru sănătatea publică.
(3) În cadrul Grupului de coordonare, România, prin intermediul reprezentanților desemnați de Agenția Naționala a Medicamentului, împreună cu reprezentanții celorlalte state membre menționate la alin. (1), trebuie să depună toate eforturile pentru ajungerea la un acord privind măsurile ce trebuie luate. Ei trebuie să acorde solicitantului posibilitatea de a-și susține punctul de vedere oral sau în scris. Dacă în 60 de zile de la comunicarea punctelor de dezacord se ajunge la un acord, România, dacă este stat de referința, înregistrează acordul, închide procedura și îl informează pe solicitant în consecința; în acest caz se aplică prevederile art. 736 alin. (5).
(4) Dacă nu se ajunge la un acord în perioada de 60 de zile prevăzută la alin (3), Agenția Europeană a Medicamentelor este informată imediat, în vederea aplicării procedurii prevăzute la art. 32, 33 și 34 din Directiva 2001/83/CE. Informațiile transmise trebuie să definească detaliat obiectul dezacordului dintre statele membre și motivele acestuia. O copie a informării este trimisa solicitantului.
(5) Imediat ce solicitantul este informat ca problema a fost transmisă Agenției Europene a Medicamentelor, el trebuie să transmită acesteia o copie a informațiilor și documentelor prevăzute la art. 736 alin. (1).
(6) În situațiile prevăzute la alin. (3), dacă Agenția Naționala a Medicamentului a aprobat raportul de evaluare, proiectul rezumatului caracteristicilor produsului, etichetarea și prospectul statului membru de referința, poate, la cererea solicitantului, sa autorizeze medicamentul fără a aștepta rezultatul procedurii prevăzute la art. 32 din Directiva 2001/83/CE ; în aceasta situație, autorizația este acordată fără a prejudicia rezultatul acelei proceduri.
Art. 738 - (1) În cazul în care au fost depuse doua sau mai multe solicitări potrivit prevederilor art. 702 și 704-708 pentru autorizarea de punere pe piața a unui anume medicament și dacă Agenția Naționala a Medicamentului și alte autorități competente ale statelor membre au adoptat decizii divergențe privind autorizarea medicamentului sau suspendarea ori retragerea acestuia, Agenția Naționala a Medicamentului sau autoritatea competentă a altui stat membru al Uniunii Europene, Comisia Europeană ori solicitantul sau deținătorul autorizației de punere pe piața se poate adresa Comitetului pentru Medicamente de Uz Uman al Agenției Europene a Medicamentelor, denumit în continuare Comitetul, pentru aplicarea procedurii prevăzute la art. 32, 33 și 34 din Directiva 2001/83/CE.
(2) Pentru a promova armonizarea autorizațiilor de punere pe piața a medicamentelor în Uniunea Europeană, Agenția Naționala a Medicamentului transmite anual Grupului de coordonare o lista de medicamente pentru care trebuie alcătuit un rezumat armonizat al caracteristicilor produsului.
Art. 739 - (1) Înainte să fie luată o decizie privind o cerere de autorizare de punere pe piața sau de suspendare ori de retragere a unei autorizații sau de modificare a termenilor unei autorizații de punere pe piața considerate necesară, în cazuri speciale, unde sunt implicate interesele Uniunii Europene, în special când este vorba de informațiile colectate conform cap. X din prezentul titlu, Agenția Naționala a Medicamentului, statele membre ale Uniunii Europene sau Comisia Europeană ori solicitantul sau deținătorul autorizației de punere pe piața se adresează Comitetului pentru aplicarea procedurii prevăzute la art. 32, 33 și 34 din Directiva 2001/83/CE.
Agenția Naționala a Medicamentului, autoritatea competentă a altui stat membru interesat sau Comisia Europeană trebuie să identifice clar problema care este adresată Comitetului spre evaluare și sa informeze solicitantul sau deținătorul autorizației de punere pe piața.
Agenția Naționala a Medicamentului și solicitantul sau deținătorul autorizației de punere pe piața trebuie să furnizeze Comitetului toate informațiile disponibile despre problema în discuție.
(2) În cazul în care solicitarea de arbitraj adresată Comitetului se referă la o gama de medicamente sau la o clasa terapeutică, procedura poate fi limitată la anumite părți ale autorizației; în acest caz, acelor medicamente li se aplică prevederile art. 743 numai dacă au fost folosite procedurile de autorizare prevăzute în prezenta secțiune.
Art. 740 - Agenția Naționala a Medicamentului, precum și solicitantul sau deținătorul autorizației de punere pe piața primesc de la Agenția Europeană a Medicamentelor, în 15 zile de la adoptare, opinia finala a Comitetului împreună cu un raport care prezintă evaluarea medicamentului și indica motivele pentru concluziile rezultate.
În cazul unei opinii favorabile acordării sau menținerii unei autorizații de punere pe piața a medicamentului în cauza, sunt anexate opiniei următoarele documente:
a) un proiect al rezumatului caracteristicilor produsului, conform prevederilor art. 708;
b) orice condiții ce afectează autorizația, în înțelesul art. 32 alin. (4) lit. c) din Directiva 2001/83/CE;
c) detalii ale condițiilor recomandate sau restrictiilor privind siguranța și utilizarea efectivă a medicamentului;
d) textul propus pentru etichetare și prospect.
Art. 741 - Agenția Naționala a Medicamentului, precum și solicitantul sau deținătorul autorizației de punere pe piața primesc un proiect de decizie însoțit de documentele prevăzute la art. 740 în cazul în care decizia Comisiei Europene este de a elibera autorizația de punere pe piața; în cazul în care, în mod excepțional, decizia Comisiei Europene nu este în concordanta cu opinia Agenției Europene a Medicamentelor, proiectul de decizie trebuie să fie însoțit și de o explicație detaliată a motivelor pentru concluziile rezultate.
Art. 742 - (1) Agenția Naționala a Medicamentului trebuie să formuleze observațiile scrise privind proiectul de decizie în termen de 22 de zile de la primirea acestuia și să le transmită la Comisia Europeană. În cazul în care trebuie luată urgent o decizie de către Comisia Europeană, răspunsul trebuie trimis într-un termen mai scurt, stabilit în funcție de gradul de urgenta identificat.
(2) Agenția Naționala a Medicamentului are posibilitatea să depună o cerere în scris pentru ca proiectul de decizie să fie discutat într-o intalnire plenara a Comitetului permanent al Comisiei Europene.
(3) Agenția Naționala a Medicamentului acorda sau retrage autorizația de punere pe piața ori modifica termenii acesteia după cum este necesar pentru a fi în acord cu decizia Comisiei Europene, în termen de 30 de zile după notificare, făcând referire la aceasta decizie. Agenția Naționala a Medicamentului informează Comisia Europeană și Agenția Europeană a Medicamentelor în consecința.
Art. 743 - Orice cerere din partea deținătorului autorizației de punere pe piața pentru modificarea unei autorizații de punere pe piața care a fost acordată conform prevederilor prezentei secțiuni trebuie să fie depusa la Agenția Naționala a Medicamentului și la toate statele membre ale Uniunii Europene care au autorizat anterior medicamentul în cauza.
Art. 744 - (1) Dacă Agenția Naționala a Medicamentului considera ca, pentru protecția sănătății publice, este necesară modificarea, suspendarea sau retragerea unei autorizații de punere pe piața care a fost acordată conform prevederilor prezentei secțiuni, Agenția Naționala a Medicamentului transmite propunerea către Agenția Europeană a Medicamentelor pentru aplicarea procedurilor prevăzute la art. 32, 33 și 34 din Directiva 2001/83/CE.
(2) Fără a contraveni prevederilor art. 739, în cazuri excepționale, unde actionarea de urgenta este esențială pentru protecția sănătății publice, până la adoptarea unei decizii definitive, Agenția Naționala a Medicamentului poate suspenda punerea pe piața și utilizarea medicamentului în cauza pe teritoriul României.
Agenția Naționala a Medicamentului informează Comisia Europeană și celelalte state membre ale Uniunii Europene nu mai târziu de următoarea zi lucrătoare asupra motivelor pentru acțiunea sa.
Art. 745 - Agenția Naționala a Medicamentului transmite Agenției Europene a Medicamentelor informațiile necesare pentru elaborarea și publicarea unui raport anual privind utilizarea procedurilor prevăzute în prezenta secțiune.
Art. 746 - Agenția Naționala a Medicamentului transmite Comisiei Europene informațiile necesare elaborării unui raport privind experienta acumulată pe baza procedurilor descrise în prezenta secțiune.
Art. 747 - (1) Prevederile art. 737 alin. (4)-(6) și ale art. 738-742 nu se aplică medicamentelor homeopate prevăzute la art. 711.
(2) Prevederile art. 736-742 nu se aplică medicamentelor homeopate prevăzute la art. 713 alin. (2).
Capitolul IV - Fabricație și import
Art. 748 - (1) Agenția Naționala a Medicamentului ia toate măsurile necesare pentru a se asigura ca fabricatia medicamentelor pe teritoriul României se efectuează numai de către deținătorii unei autorizații de fabricație; aceasta autorizație este necesară chiar dacă medicamentele fabricate sunt destinate exclusiv exportului.
(2) Autorizația prevăzută la alin. (1) este necesară atât pentru fabricatia parțială, cat și totală și pentru diferite procese de divizare, ambalare sau schimbare a formei de prezentare; cu toate acestea, o astfel de autorizație nu este necesară pentru preparare, divizare, schimbare a formei de ambalare sau prezentare atunci când aceste procese sunt efectuate în scopul livrării cu amănuntul, de către farmaciștii din farmacii sau de persoane legal autorizate în România să efectueze astfel de procese.
(3) Autorizația prevăzută la alin. (1) este necesară și pentru importuri provenite din tari terțe în România; prevederile prezentului capitol și ale art. 830 se aplică în același mod pentru astfel de importuri, ca și pentru fabricație.
(4) Agenția Naționala a Medicamentului înaintează la Agenția Europeană a Medicamentelor o copie a autorizației prevăzute la alin. (1), care este introdusă în baza de date a Uniunii Europene prevăzută la art. 823 alin. (6).
Art. 749 - (1) Pentru obținerea autorizației de fabricație, solicitantul trebuie să îndeplinească cel puțin următoarele cerințe cumulative:
a) sa specifice medicamentele și formele farmaceutice care sunt fabricate sau importate și, de asemenea, locul unde ele sunt fabricate și/sau controlate;
b) să aibă la dispoziție, pentru fabricatia sau importul medicamentelor prevăzute la lit. a), spații adecvate și suficiente, echipament tehnic și posibilități de control în acord cu cerințele legale ale României în ceea ce privește atât fabricarea și controlul, cat și depozitarea medicamentelor, conform prevederilor art. 725;
c) pentru testări speciale, controlul calității medicamentului poate fi realizat pe bază de contract încheiat între unitatea de producție și unitatea de control, în afară locului de producție, în unități de control autorizate/recunoscute de Agenția Naționala a Medicamentului, în baza reglementărilor emise de aceasta și aprobate prin ordin al ministrului sănătății publice;
d) să aibă la dispoziție serviciile cel puțin ale unei persoane calificate în sensul prevederilor art. 757.
(2) Solicitantul trebuie să furnizeze în cererea sa precizări în susținerea celor declarate potrivit alin. (1).
Art. 750 - (1) Agenția Naționala a Medicamentului emite autorizația de fabricație, care este valabilă 3 ani, numai după ce s-a asigurat de acuratetea informațiilor furnizate conform prevederilor art. 749 printr-o inspecție efectuată de inspectorii săi.
(2) Pentru a se asigura ca cerințele prevăzute la art. 749 sunt respectate, autorizația poate fi condiționată de îndeplinirea anumitor obligații impuse, fie când este acordată autorizația, fie la o dată ulterioară.
(3) Autorizația se eliberează numai pentru spațiile, medicamentele și formele farmaceutice specificate în cerere.
Art. 751 - Agenția Naționala a Medicamentului ia măsuri adecvate pentru a se asigura ca timpul necesar pentru procedura de acordare a autorizației de fabricație nu depășește 90 de zile de la data la care Agenția Naționala a Medicamentului a primit solicitarea.
Art. 752 - Dacă deținătorul autorizației de fabricație cere o schimbare în oricare dintre informațiile prevăzute la art. 749 alin. (1) lit. a) și b), timpul necesar pentru procedura în legătură cu aceasta cerere nu trebuie să depășească 30 de zile; în situații excepționale, această perioadă se poate extinde până la 90 de zile.
Art. 753 - Agenția Naționala a Medicamentului poate cere solicitantului informații suplimentare în legătură cu datele furnizate conform art. 749 și privind persoana calificată prevăzută la art. 757; dacă Agenția Naționala a Medicamentului exercita acest drept, aplicarea termenelor limita prevăzute la art. 751 și 752 este suspendată până când informațiile cerute suplimentar sunt furnizate.
Art. 754 - Deținătorul unei autorizații de fabricație este obligat cel puțin:
a) să aibă la dispoziție serviciile unui personal care să corespundă cerințelor legale existente în România atât în ceea ce privește fabricatia, cat și controlul;
b) sa elimine medicamentele autorizate numai în acord cu legislația din România;
c) sa anunțe în prealabil Agenția Naționala a Medicamentului despre orice schimbări dorește să facă în datele furnizate conform art. 749; în orice situație, Agenția Naționala a Medicamentului va fi imediat informată dacă persoana calificată prevăzută la art. 757 este înlocuită neasteptat;
d) să permită inspectorilor Agenției Naționale a Medicamentului accesul în orice moment în unitățile sale;
e) să permită persoanei calificate prevăzute la art. 757 să își exercite sarcinile sale, de exemplu prin punerea la dispoziția sa a mijloacelor necesare;
f) să respecte principiile și ghidurile de buna practica de fabricație pentru medicamente și sa folosească ca materii prime numai substanțe active care au fost fabricate conform ghidurilor detaliate de buna practica de fabricație pentru materiile prime; Agenția Naționala a Medicamentului aplica aceste prevederi și anumitor excipienti, a căror lista, împreună cu condițiile de aplicare, se transpune prin ordin al ministrului sănătății publice după adoptarea unei directive europene.
Art. 755 - (1) În înțelesul prezentului titlu, fabricarea substanțelor active utilizate ca materii prime include atât fabricarea parțială și totală sau importul substanțelor active folosite ca materii prime conform părții I pct. 3.2.1.1 lit. b) din Normele și protocoalele analitice, farmacotoxicologice și clinice referitoare la testarea medicamentelor, aprobate prin ordin al ministrului sănătății publice, cat și diferitele procese de divizare, ambalare sau prezentare ce preced încorporarea într-un medicament, inclusiv reambalarea sau reetichetarea, asa cum sunt efectuate de un distribuitor de materii prime.
(2) Agenția Naționala a Medicamentului preia orice amendamente necesare pentru a adapta alin. (1) la noile dezvoltări științifice și tehnice identificate și comunicate de Comitetul permanent al Comisiei Europene.
Art. 756 - Agenția Naționala a Medicamentului aplica prevederile ghidurilor publicate de Comisia Europeană privind forma și conținutul autorizației prevăzute la art. 748 alin. (1), ale rapoartelor prevăzute la art. 823 alin. (3), forma și conținutul certificatului de buna practica de fabricație prevăzut la art. 823 alin. (5).
Art. 757 - (1) Agenția Naționala a Medicamentului ia toate măsurile necesare pentru a se asigura ca deținătorul autorizației de fabricație are permanent și continuu la indemana serviciile cel puțin ale unei persoane calificate conform condițiilor prevăzute la art. 758, responsabilă în particular de îndeplinirea sarcinilor prevăzute la art. 760.
(2) Dacă deținătorul autorizației de fabricație îndeplinește personal condițiile prevăzute la art. 758, acesta poate să își asume responsabilitatea prevăzută la alin. (1).
Art. 758 - (1) Agenția Naționala a Medicamentului se asigura ca persoana calificată prevăzută la art. 757 îndeplinește condițiile de calificare prevăzute la alin. (2)-(8).
(2) O persoana calificată trebuie să dețină o diploma, certificat sau alta dovada de calificare oficială dobandita la terminarea unor studii universitare ori a unui curs recunoscut ca echivalent de către România, pe o perioadă de cel puțin 4 ani de studii teoretice și practice în una dintre următoarele discipline științifice: farmacie, medicina, medicina veterinara, chimie, chimie și tehnologie farmaceutica, biologie.
(3) Prin excepție de la prevederile alin. (2), durata minima a cursurilor universitare poate fi de 3 ani și jumătate acolo unde cursul este urmat de o perioadă de formare teoretică și practica de cel puțin un an și incluzând o perioadă de practica într-o farmacie de circuit deschis de cel puțin 6 luni, coroborate cu un examen de nivel universitar.
(4) Dacă doua cursuri universitare sau doua cursuri recunoscute de România ca fiind echivalente coexista în România și dacă unul dintre acestea se extinde pe mai mult de 4 ani, iar celălalt peste 3 ani, cursul de 3 ani finalizat cu o diploma, certificat sau alte dovezi de calificare oficiale dobândite la terminarea unui curs universitar ori a unui curs echivalent recunoscut se considera ca îndeplinește condiția de durata prevăzută la alin. (3), în condițiile în care diplomele, certificatele sau alte dovezi de calificare oficiale dobândite la completarea ambelor cursuri sunt recunoscute ca și cursuri echivalente de către România.
(5) Cursul trebuie să includă studii teoretice și practice în cel puțin următoarele domenii de baza:
a) fizica experimentala;
b) chimie generală și anorganica;
c) chimie organică;
d) chimie analitica;
e) chimie farmaceutica, inclusiv analiza medicamentelor;
f) biochimie generală și aplicată (medicală);
g) fiziologie;
h) microbiologie;
i) farmacologie;
j) tehnologie farmaceutica;
k) toxicologie;
l) farmacognozie (studiul compoziției și efectelor substanțelor active naturale de origine vegetala și animala).
Studiile în aceste domenii trebuie să fie echilibrate și să permită persoanei în cauza sa îndeplinească obligațiile specificate la art. 760.
(6) În ceea ce privește anumite diplome, certificate sau alte dovezi de calificare oficială prevăzute la alin. (2), care nu îndeplinesc criteriile prevăzute la alin. (2)-(5), Agenția Naționala a Medicamentului se asigura ca persoana în cauza produce dovezi de cunoștințe adecvate ale subiectelor în discuție.
(7) Persoana calificată trebuie să aibă experienta practica timp de cel puțin 2 ani în una sau mai multe unități autorizate pentru fabricarea medicamentelor, în activități de analiza calitativă a medicamentelor și de analiza cantitativă a substanțelor active, precum și alte teste și verificări necesare pentru asigurarea calității medicamentelor.
(8) Durata experienței practice poate fi redusă cu un an dacă studiile universitare durează cel puțin 5 ani, și cu un an și jumătate dacă studiile universitare durează cel puțin 6 ani.
Art. 759 - (1) O persoana angajata în activitățile persoanei la care se face referire în art. 757 de la momentul aplicării Directivei 75/319/CEE privind armonizarea prevederilor legale, reglementărilor și măsurilor administrative cu privire la medicamentele brevetate, într-un stat membru al Uniunii Europene, fără a îndeplini prevederile art. 758 poate continua acele activități în cadrul Uniunii Europene.
(2) Deținătorul unei diplome, certificat sau alta dovada de calificare oficială acordată la terminarea unui curs universitar ori a unui curs recunoscut ca echivalent de România într-o disciplina științifică care îi permite să se angajeze în activitățile persoanei la care se face referire în art. 757, conform legilor statului respectiv poate, dacă a început cursul înainte de 21 mai 1975, să fie considerat ca și calificat să efectueze în acel stat sarcinile persoanei la care se face referire în art. 757, cu condiția ca aceasta sa fi fost anterior angajata în activitățile următoare, cu cel puțin 2 ani înainte de 21 mai 1985, în una sau mai multe unități autorizate pentru fabricație: supravegherea producției și/sau analiza calitativă și cantitativă a substanțelor active și teste sau verificări necesare pentru asigurarea calității medicamentelor sub directa autoritate a persoanei la care se face referire în art. 757.
(3) Dacă persoana în cauza a dobândit experienta practica menționată la alin. (2) înainte de 21 mai 1965, încă un an de experienta practica conform condițiilor prevăzute la alin. (2) trebuie să fie completat imediat înainte de a se angaja în astfel de activități.
Art. 760 - (1) Agenția Naționala a Medicamentului ia toate măsurile necesare pentru a se asigura ca persoana calificată la care se face referire în art. 757, fără a prejudicia relația cu deținătorul autorizației de fabricație, este responsabilă, în contextul procedurilor prevăzute la art. 761, pentru următoarele:
a) în cazul medicamentelor fabricate în România, ca fiecare serie de medicament a fost fabricata și verificata în acord cu legile în vigoare în România și în acord cu cerințele autorizației de punere pe piața;
b) în cazul medicamentelor provenind din tari terțe, indiferent dacă medicamentul a fost fabricat în Uniunea Europeană, ca fiecare serie de produs a fost supusă într-un stat membru unei analize calitative complete, unei analize cantitative cel puțin a tuturor substanțelor active și a oricăror alte teste sau verificări necesare pentru asigurarea calității medicamentelor conform cerințelor autorizației de punere pe piața.
Seriile de medicamente care au fost supuse unor astfel de controale într-un stat membru vor fi exceptate de la controale dacă sunt puse pe piața în România, însoțite de rapoartele de control semnate de persoana calificată.
(2) În cazul medicamentelor importate dintr-o țara terta, dacă au fost făcute aranjamente adecvate de către Uniunea Europeană cu țara exportatoare pentru asigurarea ca fabricantul medicamentului aplica standarde de buna practica de fabricație cel puțin echivalente cu cele stabilite de Uniunea Europeană și controalele menționate la alin. (1) lit. b) au fost efectuate în țara exportatoare, persoana calificată poate fi absolvită de responsabilitatea de a efectua aceste controale.
(3) În toate cazurile și în special dacă medicamentele sunt puse pe piața, persoana calificată trebuie să certifice într-un registru sau într-un document echivalent destinat acestui scop ca fiecare serie de produs satisface prevederile prezentului articol; registrul sau documentul echivalent trebuie actualizat permanent cu operațiunile efectuate, trebuie să fie la dispoziția inspectorilor Agenției Naționale a Medicamentului și trebuie să fie păstrat o perioadă de cel puțin 5 ani.
Art. 761 - (1) Agenția Naționala a Medicamentului asigura, prin mijloace administrative adecvate, respectarea de către persoanele calificate la care se face referire în art. 757 a obligațiilor ce le revin.
(2) Agenția Naționala a Medicamentului dispune suspendarea temporară a unei astfel de persoane la începerea procedurilor administrative sau disciplinare împotriva sa pentru neîndeplinirea obligațiilor sale.
Art. 762 - Prevederile prezentului capitol se aplică și medicamentelor homeopate.
Capitolul V - Etichetare și prospect
Art. 763 - Pe ambalajul secundar al medicamentului sau, în cazul în care nu exista ambalaj secundar, pe ambalajul primar trebuie să apară următoarele informații:
a) denumirea medicamentului urmată de concentrație și de forma farmaceutica și, dacă este cazul, precizarea dacă este destinat sugarilor, copiilor ori adulților; dacă produsul conține până la 3 substanțe active, va fi inclusă denumirea comuna internationala (DCI) sau, dacă nu exista, denumirea comuna;
b) substantele active exprimate calitativ și cantitativ pe unitate de doza sau în funcție de forma de administrare pentru un volum sau o greutate dat/data, folosind denumirile lor comune;
c) forma farmaceutica și conținutul pe masa, volum sau pe numărul de doze al medicamentului;
d) o lista cu excipientii cunoscuți ca având activitate sau efect propriu și incluși în ghidul detaliat publicat ca urmare a prevederilor art. 775; în cazul medicamentelor injectabile, topice sau de uz oftalmic, toți excipientii trebuie declarați;
e) modul de administrare și, dacă este cazul, calea de administrare; se lasă spațiu pentru indicarea dozei prescrise;
f) o atenționare specială privind faptul ca medicamentul nu trebuie păstrat la indemana și vederea copiilor;
g) o atenționare specială, dacă este necesară, pentru medicament, alta decât cea menționată la lit. f);
h) data de expirare în termeni clari (luna/an);
i) condiții speciale de păstrare, dacă este cazul;
j) precautii speciale privind eliminarea medicamentelor neutilizate sau a reziduurilor provenite din medicamente, dacă este cazul, precum și referințe la orice sistem adecvat de colectare existent;
k) numele și adresa deținătorului autorizației de punere pe piața și, unde este cazul, numele reprezentantului desemnat de deținător sa îl reprezinte;
l) numărul autorizației de punere pe piața a medicamentului;
m) numărul seriei de fabricație;
n) în cazul medicamentelor care se eliberează fără prescripție medicală, instrucțiunile de utilizare.
Art. 764 - (1) Informațiile prevăzute la art. 763, cu excepția celor prevăzute la alin. (2) și (3) ale prezentului articol, trebuie să fie înscrise pe ambalajele primare.
(2) Cel puțin următoarele informații trebuie să apară pe blisterele introduse într-un ambalaj secundar care corespunde cerințelor prevăzute la art. 763 și 772:
– denumirea medicamentului conform art. 763 lit. a);
– numele deținătorului autorizației de punere pe piața;
– data de expirare;
– numărul seriei de fabricație.
(3) Cel puțin următoarele informații trebuie să apară pe ambalajele primare de mici dimensiuni, pe care informațiile prevăzute la art. 763 și 772 nu pot fi prezentate:
– denumirea medicamentului conform art. 763 lit. a) și, dacă este necesar, calea de administrare;
– modul de administrare;
– data de expirare;
– numărul seriei de fabricație;
– conținutul raportat la masa, volum sau la unitatea de doza.
Art. 765 - Informațiile prevăzute la art. 763, 764 și 772 trebuie astfel inscriptionate încât să fie ușor de citit, clare și sa nu poată fi șterse.
Art. 766 - (1) Denumirea medicamentului, conform art. 763 lit. a), trebuie inscripționată pe ambalaj și în format Braille.
(2) Deținătorul autorizației de punere pe piața trebuie să se asigure ca informațiile din prospect sunt disponibile, la cererea organizațiilor pacientilor, în formate adecvate pentru nevăzători și pentru cei cu deficit de vedere.
Art. 767 - (1) Cu respectarea prevederilor art. 770, Agenția Naționala a Medicamentului cere utilizarea unor forme de etichetare a medicamentului care permit indicarea:
– statutului legal pentru eliberare către pacient, conform prevederilor cap. VI;
– elementelor de identificare și autentificare.
(2) Pentru medicamentele autorizate prin procedura centralizata, în vederea aplicării prevederilor prezentului articol, Agenția Naționala a Medicamentului trebuie să aplice ghidul detaliat la care se face referire în art. 775.
Art. 768 - Includerea în ambalajul tuturor medicamentelor a unui prospect este obligatorie, cu excepția cazului în care toate informațiile prevăzute la art. 769 și 772 sunt direct inscriptionate pe ambalajul secundar sau primar.
Art. 769 - (1) Prospectul este întocmit în acord cu rezumatul caracteristicilor produsului și include o serie de informații, în următoarea ordine:
a) pentru identificarea medicamentului:
(i) denumirea medicamentului urmată de concentrația și forma farmaceutica și, dacă este cazul, mențiunea dacă este destinat sugarilor, copiilor sau adulților; denumirea comuna este inclusă dacă medicamentul conține o singura substanța activa și dacă denumirea este inventata;
(îi) grupa farmacoterapeutica sau tipul de activitate farmacoterapeutica în termeni ușor de înțeles pentru pacient;
b) indicațiile terapeutice;
c) o enumerare a informațiilor care sunt necesare înainte de administrarea medicamentului:
(i) contraindicatii;
(îi) precautii privind administrarea produsului;
(iii) interactiuni cu alte medicamente sau alte forme de interactiuni (de exemplu: alcool, tutun, alimente) care pot influența acțiunea medicamentului;
(iv) atenționari speciale;
d) instrucțiuni necesare și uzuale pentru utilizarea corecta a medicamentului, în special:
(i) doza recomandată;
(îi) modul și, dacă este cazul, calea de administrare;
(iii) frecventa administrării, specificându-se, dacă este cazul, momentul potrivit la care medicamentul poate sau trebuie să fie administrat;
și, dacă este cazul, în funcție de natura medicamentului:
(iv) durata tratamentului, dacă aceasta trebuie să fie limitată;
(v) măsurile care trebuie luate în cazul unei supradoze (precum evaluarea simptomelor, proceduri de urgenta);
(vi) măsurile care trebuie luate în cazul în care una sau mai multe doze nu au fost administrate;
(vii) precautii, dacă este cazul, privind riscurile întreruperii tratamentului;
(viii) o recomandare specială de a consulta medicul sau farmacistul, după caz, pentru orice clarificare a utilizării medicamentului;
e) o descriere a reacțiilor adverse care pot să apară în timpul utilizării normale a medicamentului și, dacă este cazul, măsurile care trebuie luate; pacientul este invitat în mod expres sa comunice medicului sau farmacistului orice reactie adversa aparuta, care nu este menționată în prospect;
f) o referire la data de expirare înscrisă pe ambalaj, cu:
(i) o atenționare privind utilizarea medicamentului numai până la data de expirare;
(îi) precautii speciale de păstrare, dacă este cazul;
(iii) o atenționare referitoare la modificările care pot fi constatate de utilizator în situația deteriorării vizibile a produsului, dacă este cazul;
(iv) compozitia calitativă completa (substanțe active și excipienti) și compozitia cantitativă în substanțe active, folosindu-se denumiri comune, pentru fiecare forma de prezentare a medicamentului;
(v) pentru fiecare forma de prezentare a produsului, forma farmaceutica și conținutul în masa, volum sau unități de doza;
(vi) numele și adresa deținătorului autorizației de punere pe piața și, unde este cazul, numele reprezentanților desemnați în România;
(vii) numele și adresa fabricantului;
g) în cazul în care medicamentul este autorizat conform art. 736-747 sub denumiri diferite în statele membre interesate, o lista a denumirilor autorizate în fiecare stat membru al Uniunii Europene;
h) data ultimei revizuiri a prospectului.
(2) Enumerarea stabilită la alin. (1) lit. c):
a) trebuie să ia în considerare situația particulară a anumitor categorii de utilizatori (copii, femei gravide sau lauze, bătrâni, persoane cu condiții patologice specifice);
b) trebuie să menționeze, dacă este cazul, posibile efecte asupra capacității de a conduce vehicule sau de a folosi utilaje;
c) trebuie să prevadă acei excipienti a căror cunoaștere este necesară pentru utilizarea eficienta și în siguranța a medicamentului și care sunt incluși în ghidul detaliat publicat conform prevederilor art. 775.
(3) Prospectul reflecta rezultatele consultărilor cu grupuri-ținta de pacienti pentru a se asigura ca este lizibil, clar și ușor de folosit.
Art. 770 - Agenția Naționala a Medicamentului nu poate interzice sau împiedica punerea pe piața a medicamentelor pe teritoriul României pe motive legate de etichetare ori prospect, dacă acestea corespund prevederilor prezentului capitol.
Art. 771 - (1) Odată cu depunerea cererii pentru autorizarea de punere pe piața trebuie depuse la Agenția Naționala a Medicamentului una sau mai multe machete ale ambalajului secundar și ale ambalajului primar ale medicamentului, împreună cu proiectul prospectului; rezultatele evaluărilor efectuate în cooperare cu grupul de pacienti-ținta sunt, de asemenea, furnizate Agenției Naționale a Medicamentului.
(2) Agenția Naționala a Medicamentului refuza autorizarea de punere pe piața dacă etichetarea sau prospectul nu corespunde prevederilor prezentului capitol sau nu corespunde informațiilor enumerate în rezumatul caracteristicilor produsului.
(3) Toate propunerile de modificare a etichetarii sau a prospectului prevăzute în prezentul capitol, care nu au legătură cu rezumatul caracteristicilor produsului, sunt depuse la Agenția Naționala a Medicamentului; dacă Agenția Naționala a Medicamentului nu s-a opus unei propuneri de modificare în termen de 90 de zile de la depunerea cererii, solicitantul poate opera modificarea.
(4) Faptul ca Agenția Naționala a Medicamentului nu refuza o autorizare de punere pe piața în situația descrisă la alin. (2) sau o modificare a etichetarii conform alin. (3) nu diminuează responsabilitatea generală a fabricantului și a deținătorului autorizației de punere pe piața.
Art. 772 - Ambalajul secundar și ambalajul primar pot include simboluri sau pictograme concepute pentru a clarifica anumite informații menționate la art. 763 și la art. 769 alin. (1) și alte informații compatibile cu rezumatul caracteristicilor produsului care sunt utile pentru pacient, cu excluderea oricărui element de natura publicitara.
Art. 773 - (1) Informațiile conținute în etichetare, prevăzute la art. 763, 769 și 772, trebuie să fie în limba română, ceea ce nu împiedica inscriptionarea acestor informații în mai multe limbi, cu condiția ca în toate limbile folosite să apară aceleași informații.
În cazul anumitor medicamente orfane, informațiile enumerate la art. 763 pot, la o cerere justificată, să apară numai în una dintre limbile oficiale ale Uniunii Europene.
(2) Prospectul trebuie să fie scris și conceput spre a fi clar și ușor de înțeles, permitand utilizatorilor sa acționeze corespunzător, când este cazul, cu ajutorul profesionistilor din domeniul sănătății; prospectul trebuie să fie clar lizibil în limba română.
Prevederile primei teze nu împiedica prospectul să fie inscripționat în mai multe limbi, cu condiția ca în toate limbile folosite să apară aceleași informații.
(3) Dacă medicamentul nu este destinat eliberării directe către pacient, Agenția Naționala a Medicamentului poate acorda exceptarea de la obligația prezentei anumitor informații pe eticheta și în prospect și de la obligația ca prospectul să fie în limba română.
Art. 774 - Dacă prevederile prezentului capitol nu sunt respectate de deținătorul autorizației de punere pe piața și notificarea adresată de către Agenția Naționala a Medicamentului acestuia a rămas fără efect, Agenția Naționala a Medicamentului poate suspenda autorizația de punere pe piața până când etichetarea și prospectul medicamentului în cauza se conformează cerințelor prezentului capitol.
Art. 775 - Agenția Naționala a Medicamentului participa la consultări organizate de Comisia Europeană cu statele membre ale Uniunii Europene și cu părțile interesate, în vederea întocmirii unui ghid detaliat, privind în special:
a) formularea unor atenționari speciale pentru anumite categorii de medicamente;
b) informații speciale pentru medicamentele care se eliberează fără prescripție medicală;
c) lizibilitatea informațiilor de pe eticheta și prospect;
d) metodele de identificare și autentificare a medicamentelor;
e) lista excipientilor care trebuie să apară pe eticheta medicamentului și modul în care acești excipienti trebuie să fie indicați;
f) prevederile armonizate pentru implementarea art. 57 din Directiva 2001/83/CE.
Agenția Naționala a Medicamentului aplica prevederile acestui ghid detaliat.
Art. 776 - (1) Ambalajul secundar de carton și recipientul medicamentelor conținând radionuclizi trebuie să fie etichetate conform reglementărilor pentru transportul în siguranța al materialelor radioactive stabilite de Agenția Internationala pentru Energie Atomica; în plus, eticheta trebuie să corespundă și prevederilor alin. (2) și (3).
(2) Eticheta de pe ecranul protector trebuie să includă informațiile menționate la art. 763; în plus, eticheta de pe ecranul protector trebuie să explice în amănunt codificarile utilizate pe flacon și sa indice, unde este cazul, pentru un moment și o dată anume, cantitatea de radioactivitate pe doza sau pe flacon și numărul de capsule sau, pentru lichide, numărul de mililitri din recipient.
(3) Flaconul este etichetat cu următoarele informații:
– numele sau codul medicamentului, inclusiv numele sau simbolul chimic al radionuclidului;
– numărul de identificare al seriei și data de expirare;
– simbolul internațional pentru radioactivitate;
– numele și adresa fabricantului;
– cantitatea de radioactivitate conform prevederilor alin. (2).
Art. 777 - (1) Agenția Naționala a Medicamentului trebuie să se asigure ca în ambalajul medicamentelor radiofarmaceutice, generatorilor de radionuclizi, kiturilor (truselor) sau precursorilor radionuclidici este introdus un prospect amănunțit incluzând instrucțiunile de utilizare.
(2) Textul prospectului menționat la alin. (1) trebuie să fie elaborat conform prevederilor art. 769; în plus, prospectul trebuie să includă orice alte precautii care trebuie luate de utilizator în timpul preparării și administrării medicamentului și precautii speciale pentru eliminarea ambalajului și a conținutului neutilizat.
Art. 778 - Fără a contraveni prevederilor art. 779, medicamentele homeopate trebuie să fie etichetate în acord cu prevederile prezentului capitol și sa conțină o mențiune pe eticheta asupra naturii lor homeopate, într-o formă clara și lizibila.
Art. 779 - În plus față de mențiunea clara a cuvintelor „medicament homeopat”, eticheta și, unde este cazul, prospectul pentru medicamentele prevăzute la art. 711 alin. (1) poarta exclusiv următoarele informații:
– denumirea științifică a susei sau a suselor urmată de gradul de dilutie, folosindu-se simbolurile farmacopeii utilizate conform art. 695 pct. 4; dacă medicamentul homeopat este alcătuit din două sau mai multe suse, denumirea științifică a suselor pe eticheta poate fi suplimentata cu o denumire inventata;
– numele și adresa deținătorului autorizației de punere pe piața și, după caz, numele fabricantului;
– modul de administrare și, dacă este cazul, calea de administrare;
– data de expirare, în termeni clari (luna, an);
– forma farmaceutica;
– conținutul formei de prezentare destinate vânzării;
– precautii speciale de păstrare, dacă exista;
– o atenționare specială, dacă este necesară;
– numărul seriei de fabricație;
– numărul autorizației de punere pe piața;
– „medicament homeopat fără indicații terapeutice aprobate”;
– o atenționare care îl sfatuieste pe utilizator sa consulte un medic dacă simptomele persista.
Capitolul VI - Clasificarea medicamentelor
Art. 780 - (1) La eliberarea autorizațiilor de punere pe piața, Agenția Naționala a Medicamentului specifică clasificarea medicamentelor în:
– medicamente care se eliberează cu prescripție medicală;
– medicamente care se eliberează fără prescripție medicală.
În acest scop, se aplică criteriile prevăzute la art. 781 alin. (1).
(2) Agenția Naționala a Medicamentului stabilește subcategorii pentru medicamentele eliberate numai cu prescripție medicală, după cum urmează:
a) medicamente care se eliberează cu prescripție medicală care se retine în farmacie (nu se reînnoiește) sau care nu se retine în farmacie (se poate reînnoi);
b) medicamente care se eliberează cu prescripție medicală specială;
c) medicamente care se eliberează cu prescripție medicală restrictiva, rezervate pentru utilizarea în anumite domenii specializate.
Art. 781 - (1) Medicamentele se eliberează cu prescripție medicală dacă:
– prezintă un pericol direct ori indirect, chiar în cazul utilizării corecte, dacă sunt folosite fără supraveghere medicală; sau
– sunt utilizate frecvent și în mare măsura incorect și ca atare pot prezenta un pericol direct ori indirect pentru sănătatea umană; sau
– conțin substanțe ori preparate ale acestora ale căror activitate și/sau reactii adverse necesita investigații aprofundate; sau
– sunt prescrise în mod normal de medic pentru a fi administrate parenteral.
(2) La stabilirea subcategoriilor se iau în considerare următorii factori:
– medicamentul conține, într-o cantitate care nu este exceptată, o substanța clasificata ca stupefiant sau psihotrop în înțelesul convențiilor internaționale în vigoare, precum convențiile Națiunilor Unite din 1961 și 1974; sau
– medicamentul poate, dacă este utilizat incorect, să prezinte un risc de abuz medicamentos, sa conducă la dependenta ori să fie utilizat în scopuri ilegale; sau
– medicamentul conține o substanța care, prin noutate sau prin proprietățile specifice, ca măsura de precautie, poate fi considerată ca aparține grupului prevăzut la punctul anterior.
(3) La stabilirea subcategoriilor pentru medicamentele supuse prescrierii restrictive se iau în considerare următorii factori:
– medicamentul, datorită caracteristicilor sale farmaceutice sau noutatii sale ori intereselor pentru sănătatea publică, poate fi utilizat numai în spital;
– medicamentul este utilizat în tratamentul bolilor care trebuie să fie diagnosticate în spital sau în instituții care dețin echipamente de diagnosticare adecvate, chiar dacă administrarea și continuarea tratamentului pot fi efectuate în altă parte; sau
– medicamentul este destinat utilizării în ambulatoriu, dar utilizarea sa poate provoca reactii adverse grave necesitand o prescripție medicală întocmită de un specialist și o supraveghere specială de-a lungul tratamentului.
(4) Agenția Naționala a Medicamentului poate renunța la aplicarea alin. (1), (2) și (3) ținând cont de:
a) doza unica maxima, doza maxima zilnica, concentrația, forma farmaceutica, anumite tipuri de ambalaje; și/sau
b) alte circumstanțe de utilizare specificate.
(5) Dacă Agenția Naționala a Medicamentului nu desemnează medicamente în subcategoriile menționate la art. 780 alin. (2), trebuie să ia în considerare criteriile prevăzute la alin. (2) și (3) pentru a stabili dacă un medicament este clasificat ca medicament eliberat numai cu prescripție medicală.
Art. 782 - Medicamentele care se eliberează fără prescripție medicală sunt acelea care nu se încadrează în criteriile stabilite la art. 781.
Art. 783 - (1) Agenția Naționala a Medicamentului întocmește o lista a medicamentelor care se eliberează cu prescripție medicală pe teritoriul României specificand, dacă este cazul, categoria clasificarii; aceasta lista se actualizează anual.
(2) Agenția Naționala a Medicamentului elaborează anual Nomenclatorul cuprinzând medicamentele autorizate de punere pe piața în România, precizând pentru fiecare medicament clasificarea pentru eliberare.
Art. 784 - Agenția Naționala a Medicamentului analizează orice aspecte noi care îi sunt aduse la cunoștința și, după caz, modifica clasificarea unui medicament prin aplicarea criteriilor enumerate la art. 781.
Art. 785 - Dacă a fost autorizata o schimbare a clasificarii unui medicament pe baza unor teste preclinice sau studii clinice semnificative, Agenția Naționala a Medicamentului nu trebuie să se refere la rezultatele acestor teste sau studii în cazul evaluării unei cereri depuse de către alt solicitant sau deținător al autorizației de punere pe piața pentru schimbarea clasificarii aceleiași substanțe, timp de un an de la autorizarea modificării inițiale.
Art. 786 - Anual, Agenția Naționala a Medicamentului comunică Comisiei Europene și celorlalte state membre ale Uniunii Europene schimbările ce au fost făcute în lista la care se face referire în art. 783.
Capitolul VII - Distribuția angro a medicamentelor
Art. 787 - (1) Cu respectarea prevederilor art. 700, Ministerul Sănătății Publice ia toate măsurile corespunzătoare pentru a se asigura ca numai medicamentele pentru care a fost acordată o autorizație de punere pe piața conform prevederilor prezentului titlu sunt distribuite pe teritoriul României.
(2) Cu respectarea prevederilor art. 700, Ministerul Sănătății Publice ia toate măsurile corespunzătoare pentru a se asigura ca numai medicamentele pentru care a fost acordată o autorizație de punere pe piața conform prevederilor prezentului titlu și prin procedura centralizata sunt distribuite pe teritoriul României.
(3) Distribuția angro și depozitarea medicamentelor se efectuează numai pentru medicamente care au autorizații de punere pe piața eliberate:
a) de Comisia Europeană, conform procedurii centralizate; sau
b) de Agenția Naționala a Medicamentului, conform prevederilor prezentului titlu.
(4) Orice distribuitor care nu este deținătorul autorizației de punere pe piața și care importa un medicament dintr-un stat membru al Uniunii Europene trebuie să notifice intenția sa deținătorului autorizației de punere pe piața și Agenției Naționale a Medicamentului; pentru medicamentele care nu au fost autorizate prin procedura centralizata, notificarea Agenției Naționale a Medicamentului se face fără a contraveni procedurilor suplimentare prevăzute în legislația din România.
Art. 788 - (1) Ministerul Sănătății Publice ia toate măsurile necesare pentru a se asigura ca distribuția angro de medicamente se face de către posesorii unei autorizații pentru desfășurarea activității de distribuitor angro de medicamente, care precizează sediul pentru care este valabilă.
(2) Dacă persoanele autorizate sa elibereze medicamentele către populație pot, conform legislației naționale, să se angajeze și în distribuție angro, aceste persoane trebuie să fie autorizate conform alin. (1).
(3) Deținerea unei autorizații de fabricație include și autorizarea pentru distribuția angro a medicamentelor acoperite de acea autorizație; deținerea unei autorizații pentru desfășurarea activității de distribuție angro de medicamente nu exceptează deținătorul de la obligația de a deține o autorizație de fabricație și de a se supune condițiilor stabilite în acest sens, chiar dacă activitatea de fabricație sau de import este secundară.
(4) La cererea Comisiei Europene sau a unui stat membru al Uniunii Europene, Ministerul Sănătății Publice trebuie să furnizeze toate informațiile adecvate privind autorizațiile individuale pe care le-a eliberat conform alin. (1).
(5) Verificările persoanelor autorizate pentru desfășurarea activității de distribuție angro de medicamente și inspecția spațiilor lor se efectuează sub responsabilitatea Ministerului Sănătății Publice.
(6) Ministerul Sănătății Publice suspenda sau retrage autorizația prevăzută la alin. (1) dacă nu mai sunt îndeplinite condițiile de autorizare; Ministerul Sănătății Publice informează despre aceasta statele membre ale Uniunii Europene și Comisia Europeană.
(7) Dacă Ministerul Sănătății Publice considera ca deținătorul unei autorizații acordate de un stat membru al Uniunii Europene conform prevederilor art. 77 alin. (1) din Directiva 2001/83/CE nu mai îndeplinește condițiile de autorizare, informează despre aceasta Comisia Europeană și statul membru implicat; acesta din urma ia toate măsurile necesare și informează Comisia Europeană și Ministerul Sănătății Publice asupra deciziilor luate și a motivelor care stau la baza acestor decizii.
(8) Ministerul Sănătății Publice, prin inspectorii direcției de specialitate, inspecteaza și unitățile de distribuție en detail.
(9) Inspectorii direcției de specialitate din Ministerul Sănătății Publice și inspectorii Agenției Naționale a Medicamentului pot preleva probe de la unitățile de distribuție în vederea efectuării de analize de laborator.
(10) Contravaloarea probelor prelevate și costul analizelor efectuate se suporta conform art. 823 alin. (1) lit. b).
Art. 789 - (1) Ministerul Sănătății Publice se asigura ca timpul necesar pentru desfășurarea procedurii de examinare a cererilor pentru autorizarea de distribuție nu depășește 90 de zile de la data primirii cererii de către acesta.
(2) Ministerul Sănătății Publice poate cere solicitantului, dacă este necesar, sa furnizeze toate informațiile privind condițiile de autorizare.
(3) Dacă Ministerul Sănătății Publice constata că nu sunt furnizate toate informațiile conform alin. (2), perioada prevăzută la alin. (1) este suspendată până când datele cerute vor fi furnizate.
Art. 790 - Pentru a obține o autorizație de distribuție, solicitanții trebuie să îndeplinească următoarele cerințe minime:
a) trebuie să aibă spații, instalații și echipamente potrivite și adecvate pentru asigurarea conservării și distribuției medicamentelor;
b) trebuie să aibă personal și, în particular, o persoană calificată desemnată ca responsabil, indeplinind condițiile prevăzute în legislația din România;
c) trebuie să poată îndeplini obligațiile prevăzute la art. 791.
Art. 791 - Deținătorii autorizației de distribuție trebuie să îndeplinească următoarele cerințe minime:
a) să permită accesul la spațiile, instalațiile și echipamentele prevăzute la art. 790 lit. a) persoanelor responsabile cu inspecția acestora;
b) să își constituie stocurile de medicamente numai de la persoane care, la rândul lor, dețin o autorizație de distribuție sau sunt exceptate de la obținerea unei astfel de autorizații conform prevederilor art. 788 alin. (3);
c) sa furnizeze medicamentele numai persoanelor care, la rândul lor, dețin o autorizație de distribuție angro sau sunt autorizate de Ministerul Sănătății Publice sa furnizeze medicamente către populație în România;
d) să aibă un plan de urgenta care să asigure implementarea efectivă a oricărei retrageri de pe piața ordonată de Agenția Naționala a Medicamentului sau efectuată în cooperare cu fabricantul ori cu deținătorul autorizației de punere pe piața pentru medicamentul în cauza;
e) sa păstreze evidenta fie în forma facturilor de vânzare/cumpărare, fie pe calculator, fie în orice formă, consemnand pentru orice tranzacție următoarele informații:
– data operațiunii efectuate;
– denumirea medicamentului, numele și țara de origine ale fabricantului;
– modul de prezentare, forma farmaceutica, concentrația substanțelor active, mărimea ambalajului;
– seria și data expirării;
– certificatul de calitate și/sau buletinul de analiza, după caz;
– cantitatea primită sau furnizată;
– numele și adresa furnizorului sau ale destinatarului, după caz;
f) sa țină la dispoziția Ministerului Sănătății Publice evidenta prevăzută la lit. e), în scopul inspecțiilor, pentru o perioadă de 5 ani;
g) să respecte principiile și ghidurile de buna practica de distribuție pentru medicamente, conform prevederilor art. 795.
Art. 792 - (1) În ceea ce privește furnizarea de medicamente către farmacisti și persoanele autorizate sa elibereze medicamente către populație, Ministerul Sănătății Publice nu trebuie să aplice unui deținător de autorizație de distribuție acordată de alt stat membru al Uniunii Europene nici o obligație, în special obligații de serviciu public, mai restrictiva decât cele aplicate persoanelor autorizate să efectueze activități echivalente în România.
(2) Deținătorul unei autorizații de punere pe piața pentru un medicament și distribuitorii acelui medicament pus efectiv pe piața în România asigura, în limitele responsabilităților lor, stocuri adecvate și continue din acel medicament către farmacii și persoanele autorizate sa furnizeze medicamente, astfel încât nevoile pacientilor din România să fie acoperite.
(3) Măsurile pentru implementarea prevederilor prezentului articol trebuie să fie justificate prin protecția sănătății publice și să fie proporționale cu obiectivele acestei protecții, conform regulilor Tratatului Uniunii Europene, în special cele privind libera circulație a mărfurilor și concurenta.
Art. 793 - (1) Pentru toate furnizarile de medicamente către o persoană autorizata sa furnizeze medicamente către populație în România, distribuitorul angro autorizat trebuie să emita un document însoțitor care indica:
– data;
– numele și forma farmaceutica ale medicamentului;
– cantitatea furnizată;
– numele și adresa furnizorului și destinatarului.
(2) Ministerul Sănătății Publice ia toate măsurile necesare pentru a se asigura ca persoanele autorizate sa furnizeze medicamente către populație pot furniza informațiile necesare pentru trasabilitatea caii de distribuție a fiecărui medicament.
Art. 794 - Prevederile prezentului capitol nu împiedica aplicarea unor cerințe mai restrictive în legătură cu distribuția angro de:
– substanțe stupefiante și psihotrope pe teritoriul României;
– medicamente derivate din sânge;
– medicamente imunologice;
– medicamente radiofarmaceutice.
Art. 795 - Ministerul Sănătății Publice are obligația de a urmări aplicarea ghidurilor de buna practica de distribuție publicate de Comisia Europeană.
Art. 796 - Prezentul capitol se aplică și pentru medicamentele homeopate.
Capitolul VIII - Publicitatea
Art. 797 - (1) În înțelesul prezentului capitol, publicitatea pentru medicamente include orice mod de informare prin contact direct (sistemul „door-to-door”), precum și orice formă de promovare destinată sa stimuleze prescrierea, distribuirea, vânzarea sau consumul de medicamente; publicitatea pentru medicamente va include în special:
– publicitatea pentru medicamente destinată publicului larg;
– publicitatea pentru medicamente destinată persoanelor calificate sa prescrie sau sa distribuie medicamente;
– vizite ale reprezentanților medicali la persoane calificate sa prescrie medicamente;
– furnizarea de mostre;
– stimularea prescrierii sau distribuirii medicamentelor prin oferirea, promiterea ori acordarea unor avantaje în bani sau în natura, cu excepția cazurilor în care acestea au o valoare simbolica;
– sponsorizarea intalnirilor promotionale la care participa persoane calificate sa prescrie sau sa distribuie medicamente;
– sponsorizarea congreselor științifice la care participa persoane calificate sa prescrie sau sa distribuie medicamente și, în special, plata cheltuielilor de transport și cazare ocazionate de acestea.
(2) Nu fac obiectul prezentului capitol următoarele:
– etichetarea și prospectul, care fac obiectul cap. V;
– corespondenta, posibil însoțită de materiale de natura nonpromotionala, necesare pentru a răspunde unei întrebări specifice în legătură cu un anumit medicament;
– anunțuri cu caracter informativ și materiale referitoare, de exemplu, la modificări ale ambalajului, atenționari despre reactii adverse care fac parte din precautiile generale de administrare a medicamentului, cataloage comerciale și liste de prețuri, cu condiția ca acestea sa nu includă nici un fel de afirmații cu caracter promotional;
– informații privind sănătatea umană sau boli, cu condiția sa nu existe referințe, chiar indirecte, la medicamente.
Art. 798 - (1) Agenția Naționala a Medicamentului interzice publicitatea pentru un medicament care nu are autorizație de punere pe piața valabilă în România.
(2) Toate informațiile conținute în materialul publicitar pentru un medicament trebuie să corespundă cu informațiile enumerate în rezumatul caracteristicilor produsului.
(3) Publicitatea pentru un medicament:
– trebuie să încurajeze utilizarea rațională a medicamentului, prin prezentarea lui obiectivă și fără a-i exagera proprietățile;
– nu trebuie să fie inselatoare.
Art. 799 - (1) Este interzisă publicitatea destinată publicului larg pentru medicamente care:
a) se eliberează numai cu prescripție, medicală, conform cap. VI;
b) conțin substanțe definite ca stupefiante sau psihotrope de convenții internaționale, precum convențiile Națiunilor Unite din 1961 și 1971, și legislația naționala.
(2) Este permisă publicitatea destinată publicului larg doar pentru acele medicamente care, prin compoziție și scop, sunt destinate a fi utilizate fără intervenția unui medic, în scopul stabilirii diagnosticului, prescrierii acestora sau pentru monitorizarea tratamentului, fiind suficiente, la nevoie, sfaturile farmacistilor.
(3) Este interzisă pe teritoriul României publicitatea destinată publicului larg pentru medicamentele prescrise și eliberate în sistemul asigurărilor de sănătate.
(4) Interdicția prevăzută la alin. (1) nu se aplică campaniilor de vaccinare efectuate de industria farmaceutica și aprobate de Ministerul Sănătății Publice.
(5) Interdicția la care se face referire la alin. (1) se aplică fără a contraveni prevederilor din legislația naționala, Legii nr. 148/2000 privind publicitatea, cu modificările și completările ulterioare, care transpun art. 14 al Directivei 89/552/CEE privind coordonarea anumitor prevederi stabilite prin legi, regulamente sau acțiuni administrative în statele membre în cauza, referitoare la îndeletnicirea cu activități de transmitere TV.
(6) Este interzisă distribuția directa a medicamentelor către populație de către fabricanti în scopuri promotionale.
Capitolul IX - Informarea publicului
Art. 800 - (1) Cu respectarea prevederilor art. 799, orice material publicitar destinat publicului larg:
a) trebuie să fie conceput astfel încât să fie clar ca mesajul este de natura publicitara și ca produsul este clar identificat ca medicament;
b) trebuie să includă cel puțin următoarele informații:
– denumirea medicamentului, precum și denumirea comuna dacă medicamentul conține o singura substanța activa;
– informațiile necesare pentru utilizarea corecta a medicamentului;
– o invitație expresă, lizibila, de a citi cu atenție instrucțiunile din prospect sau de pe ambalaj, formulată după cum urmează: „Acest medicament se poate elibera fără prescripție medicală. Se recomanda citirea cu atenție a prospectului sau a informațiilor de pe ambalaj. Dacă apar manifestări neplacute, adresati-va medicului sau farmacistului.”
(2) În cazul în care este vorba despre o reclama prescurtata (reminder) se accepta ca publicitatea pentru medicamente destinată publicului larg, prin excepție de la prevederile alin. (1), sa includă numai denumirea medicamentului sau denumirea comuna internationala, dacă aceasta exista, ori marca medicamentului.
Art. 801 - Publicitatea pentru medicamente destinată publicului larg nu trebuie să conțină nici un material care:
a) sa dea impresia ca o consultatie medicală sau o intervenție chirurgicala nu este necesară, în special prin oferirea unor sugestii de diagnostic sau de tratament la distanta;
b) sa sugereze ca efectul tratamentului cu medicamentul respectiv este garantat, nu este însoțit de reactii adverse sau ca efectul este mai bun ori echivalent cu cel al altui tratament sau medicament;
c) sa sugereze ca starea de sănătate a subiectului poate fi îmbunătățită prin utilizarea medicamentului respectiv;
d) sa sugereze ca starea de sănătate a subiectului poate fi afectată dacă nu se utilizează medicamentul; aceasta interdicție nu se aplică campaniilor de vaccinare prevăzute la art. 799 alin. (4);
e) să se adreseze exclusiv sau în special copiilor;
f) să facă referire la o recomandare a oamenilor de știința, profesionistilor din domeniul sănătății sau persoanelor care nu fac parte din aceste categorii, dar a căror celebritate poate incuraja consumul de medicamente;
g) sa sugereze ca medicamentul este un aliment, produs cosmetic sau alt produs de consum;
h) sa sugereze ca siguranța sau eficacitatea medicamentului este datorată faptului ca acesta este natural;
i) să poată, printr-o descriere sau reprezentare detaliată a unui caz, sa ducă la o autodiagnosticare eronată;
j) să ofere, în termeni inadecvati, alarmanti sau inselatori, asigurări privind vindecarea;
k) sa folosească, în termeni inadecvati, alarmanti sau inselatori, reprezentari vizuale ale schimbărilor în organismul uman cauzate de boli sau leziuni ori de acțiuni ale medicamentelor asupra organismului uman sau a unei părți a acestuia.
Art. 802 - (1) Orice material publicitar pentru un medicament destinat persoanelor calificate sa prescrie sau sa elibereze astfel de produse trebuie să includă:
– informații esențiale compatibile cu rezumatul caracteristicilor produsului;
– clasificarea pentru eliberare a medicamentului.
(2) În cazul în care este vorba despre o reclama prescurtata (reminder), publicitatea pentru un medicament destinată persoanelor calificate sa prescrie sau sa elibereze astfel de produse poate, prin excepție de la prevederile alin. (1), sa includă numai denumirea medicamentului sau denumirea comuna internationala, dacă aceasta exista, ori marca.
Art. 803 - (1) Orice documentație referitoare la un medicament care este transmisă ca parte a promovării acelui produs persoanelor calificate sa îl prescrie sau sa îl elibereze include cel puțin informațiile prevăzute la art. 802 alin. (1) și precizează data la care a fost întocmit sau revizuit ultima data.
(2) Toate informațiile conținute în documentația menționată la alin. (1) trebuie să fie corecte, actualizate, verificabile și suficient de complete pentru a permite beneficiarului să își formeze propria opinie asupra valorii terapeutice a medicamentului în cauza.
(3) Citatele, precum și tabelele și alte materiale ilustrative extrase din publicațiile medicale sau alte lucrări științifice care sunt utilizate în documentația prevăzută la alin. (1) trebuie să fie reproduse fidel, cu indicarea precisa a sursei.
Art. 804 - (1) Reprezentanții medicali trebuie să fie instruiti corespunzător de către firma la care sunt angajați și trebuie să posede suficiente cunoștințe științifice pentru a putea furniza informații cat mai precise și complete despre medicamentele pe care le promovează.
(2) În timpul fiecărei vizite, reprezentanții medicali oferă persoanelor vizitate sau pun la dispoziția acestora rezumatul caracteristicilor produsului pentru fiecare medicament pe care îl prezintă, împreună cu detalii despre prețul și condițiile de rambursare.
(3) Reprezentanții medicali transmit serviciului științific la care se face referire la art. 809 alin. (1) toate informațiile despre utilizarea medicamentelor pe care le promovează, cu referire în special la reactiile adverse raportate de către persoanele pe care le viziteaza.
Art. 805 - (1) Când publicitatea pentru medicamente se adresează persoanelor calificate sa prescrie sau sa elibereze astfel de produse, nu trebuie să li se ofere, sa li se acorde sau sa li se promita cadouri, avantaje în bani sau natura, cu excepția acelora care nu sunt costisitoare și care sunt relevante pentru practica medicală sau farmaceutica.
(2) La evenimentele de promovare comercială, ospitalitatea se limitează strict la scopul ei principal și nu este extinsă la alte persoane decât profesioniștii din domeniul sănătății.
(3) Persoanele calificate sa prescrie sau sa distribuie astfel de medicamente nu trebuie să solicite ori sa accepte nici un stimulent interzis conform alin. (1) sau contrar prevederilor alin. (2).
(4) Prevederile alin. (1)-(3) nu se aplică măsurilor existente și practicilor comerciale din România privind prețurile, adaosurile comerciale și rabaturile.
Art. 806 - Prevederile art. 805 alin. (1) nu împiedica oferirea directa sau indirecta a ospitalitatii la evenimente profesionale și științifice; astfel de ospitalitate trebuie să fie întotdeauna strict limitată la scopul principal al evenimentului; ea nu trebuie să fie extinsă asupra altor persoane decât profesioniștii din domeniul sănătății.
Art. 807 - Mostrele gratuite se oferă, în mod excepțional, numai persoanelor calificate sa prescrie sau sa distribuie astfel de produse și în următoarele condiții:
a) numărul de mostre acordate anual pentru fiecare medicament eliberat pe prescripție medicală este limitat;
b) orice furnizare de mostre se face ca urmare a unei solicitări în scris, semnată și datată de medic;
c) cei care furnizează mostrele mențin un sistem adecvat de control și evidenta;
d) fiecare mostra nu trebuie să fie mai mare decât cea mai mica forma de prezentare de pe piața;
e) fiecare mostra este marcată cu mențiunea „mostra medicală gratuita – nu este destinată vânzării” sau prezintă o mențiune cu același înțeles;
f) fiecare mostra este însoțită de o copie a rezumatului caracteristicilor produsului;
g) nu se furnizează mostre de medicamente conținând substanțe stupefiante și psihotrope în înțelesul convențiilor internaționale, precum convențiile Națiunilor Unite din 1961 și 1971.
Art. 808 - (1) Agenția Naționala a Medicamentului ia măsuri adecvate și eficiente pentru monitorizarea publicității la medicamente, după cum urmează:
a) în cazul medicamentelor care se eliberează fără prescripție medicală, materialele publicitare destinate publicului larg se supun aprobării prealabile a Agenției Naționale a Medicamentului;
b) în cazul medicamentelor care se eliberează cu sau fără prescripție medicală, materialele publicitare destinate persoanelor calificate sa prescrie sau sa distribuie medicamente sunt analizate de Agenția Naționala a Medicamentului ulterior diseminarii, prin sondaj sau ca urmare a unor sesizări.
(2) Persoanele fizice sau juridice care au un interes legitim în interzicerea oricărei publicitati care contravine prevederilor prezentului capitol pot sesiza Agenția Naționala a Medicamentului în acest sens; Agenția Naționala a Medicamentului răspunde sesizarilor în termen de 60 de zile.
(3) Când constata ca materialul publicitar încalcă prevederile prezentului capitol, Agenția Naționala a Medicamentului ia măsurile necesare, ținând seama de toate interesele implicate și, în special, de interesul public:
a) dacă materialul publicitar a fost deja publicat, dispune încetarea publicității inselatoare; sau
b) dacă materialul publicitar inselator nu a fost încă publicat, dar publicarea este iminenta, dispune interzicerea acestei publicitati, chiar fără dovada pierderilor efective, prejudiciului de orice fel sau a intentiei ori culpei celui care face publicitatea.
(4) Măsura menționată la alin. (3) lit. b) este luată printr-o procedură accelerata și poate avea caracter temporar sau definitiv.
(5) În scopul eliminării efectelor publicității inselatoare, a carei încetare a fost dispusă de Agenția Naționala a Medicamentului, aceasta poate să ceara:
a) publicarea deciziei finale complet sau parțial în forma considerată adecvată;
b) publicarea unei declarații corective.
(6) Prevederile prezentului articol nu exclud controlul voluntar al publicității pentru medicamente ori organisme de autoreglementare și recurgerea la astfel de organisme.
Art. 809 - (1) Deținătorul autorizației de punere pe piața stabilește, în cadrul structurilor sale, un serviciu științific responsabil de informațiile despre medicamentele pe care le pune pe piața.
(2) Deținătorul autorizației de punere pe piața:
a) păstrează disponibile sau comunică Agenției Naționale a Medicamentului o mostra a tuturor materialelor publicitare elaborate din inițiativa sa împreună cu o declarație indicând persoanele cărora li se adresează, metoda de aducere la cunoștința și data primei aduceri la cunoștința;
b) asigura ca materialele publicitare elaborate pentru medicamentele sale sunt conforme cu prevederile prezentului capitol;
c) verifica faptul ca reprezentanții săi medicali au fost instruiti adecvat și își îndeplinesc obligațiile prevăzute la art. 804 alin. (2) și (3);
d) furnizează Agenției Naționale a Medicamentului informațiile și asistența necesare pentru îndeplinirea responsabilităților ei;
e) se asigura ca deciziile luate de Agenția Naționala a Medicamentului sunt respectate imediat și complet.
(3) Copromovarea unui medicament de către deținătorul autorizației de punere pe piața și de una sau mai multe companii desemnate de acesta este permisă.
Art. 810 - Agenția Naționala a Medicamentului ia măsuri adecvate pentru a asigura aplicarea prevederilor prezentului capitol și aplica, în cazul încălcării acestora, sancțiunile prevăzute în prezentul titlu.
Art. 811 - (1) Publicitatea pentru medicamentele homeopate la care se face referire la art. 711 alin. (1) face obiectul prevederilor prezentului capitol; în cazul acestor produse nu se aplică prevederile art. 798 alin. (1).
(2) Cu toate acestea, numai informațiile specificate la art. 779 pot fi utilizate pentru publicitatea la aceste medicamente.
Capitolul X - Farmacovigilenta
Art. 812 - (1) Ministerul Sănătății Publice ia toate măsurile adecvate pentru încurajarea medicilor și profesionistilor din domeniul sănătății să raporteze la Agenția Naționala a Medicamentului reactii adverse suspectate la medicamente.
(2) Ministerul Sănătății Publice poate impune cerințe specifice medicilor și altor profesionisti din domeniul sănătății privind raportarea reactiilor adverse grave suspectate sau neașteptate.
Art. 813 - (1) Pentru a se asigura adoptarea deciziilor de reglementare adecvate și armonizate privind medicamentele autorizate în Uniunea Europeană, având în vedere informațiile obținute privind reactiile adverse apărute la medicamente în condiții normale de utilizare, în Agenția Naționala a Medicamentului trebuie să funcționeze un sistem de farmacovigilenta; acest sistem trebuie să fie folosit pentru colectarea informațiilor utile în supravegherea medicamentelor, cu referire specială la reactiile adverse apărute la om și pentru evaluarea științifică a acestora.
(2) Agenția Naționala a Medicamentului ia măsurile necesare pentru a se asigura ca informațiile adecvate colectate prin acest sistem sunt comunicate statelor membre ale Uniunii Europene și Agenției Europene a Medicamentelor.
(3) Acest sistem trebuie să ia în considerare și orice informație disponibilă privind utilizarea gresita și abuzul de medicamente ce pot avea un impact asupra evaluării riscurilor și beneficiilor.
Art. 814 - Administrarea fondurilor destinate activităților legate de farmacovigilenta, operarea rețelelor de comunicare și supraveghere a pieței se afla sub controlul permanent al Agenției Naționale a Medicamentului pentru a le garanta independenta.
Art. 815 - Deținătorul autorizației de punere pe piața trebuie să aibă permanent și continuu la dispoziția sa o persoană calificată corespunzător, responsabilă de activitatea de farmacovigilenta; aceasta persoana calificată trebuie să fie stabilită în România sau în Uniunea Europeană și trebuie să fie responsabilă de următoarele:
a) stabilirea și menținerea unui sistem care să asigure ca informațiile despre toate reactiile adverse suspectate ce sunt raportate personalului companiei și reprezentanților ei medicali sunt colectate pentru a fi accesibile cel puțin într-un loc din Uniunea Europeană;
b) pregătirea pentru Agenția Naționala a Medicamentului a rapoartelor prevăzute la art. 816, în forma solicitată de Agenția Naționala a Medicamentului, conform ghidului menționat la art. 818 alin. (1);
c) asigurarea ca orice solicitare de la Agenția Naționala a Medicamentului pentru furnizarea de informații suplimentare necesare pentru evaluarea beneficiilor și riscurilor asociate unui medicament primește un răspuns complet și prompt, inclusiv furnizarea de informații despre volumul vânzărilor sau prescrierilor medicamentului în cauza;
d) comunicarea la Agenția Naționala a Medicamentului a oricăror alte informații referitoare la evaluarea riscurilor și beneficiilor unui medicament, inclusiv informații corespunzătoare privind studiile de siguranță post-autorizare.
Art. 816 - (1) Deținătorul autorizației de punere pe piața trebuie să păstreze înregistrări detaliate ale tuturor reactiilor adverse suspectate apărute în România, Uniunea Europeană sau într-o țara terta; în afară situațiilor excepționale, aceste reactii sunt comunicate electronic sub forma unui raport prezentat conform prevederilor ghidului la care se face referire la art. 818 alin. (1).
(2) Deținătorul autorizației de punere pe piața înregistrează toate reactiile adverse grave suspectate care îi sunt aduse la cunoștința de către profesioniștii din domeniul sănătății și le raportează prompt la Agenția Naționala a Medicamentului sau la autoritatea competentă din statul membru al Uniunii Europene pe teritoriul căruia a avut loc incidentul, în cel mult 15 zile de la primirea informatiei.
(3) Deținătorul autorizației de punere pe piața înregistrează toate celelalte reactii adverse grave suspectate ce îndeplinesc criteriile de notificare în acord cu ghidul menționat la art. 818 alin. (1), de a căror existenta se presupune în mod rezonabil ca are cunoștința, și le raportează la Agenția Naționala a Medicamentului sau la autoritatea competentă din statul membru al Uniunii Europene pe teritoriul căruia a avut loc incidentul, în cel mult 15 zile de la primirea informatiei.
(4) Deținătorul autorizației de punere pe piața se asigura ca toate reactiile adverse grave suspectate și neașteptate și orice transmitere suspectata printr-un medicament a unui agent infectios pe teritoriul unei tari terțe sunt raportate prompt în acord cu ghidul menționat la art. 818 alin. (1), astfel încât Agenția Europeană a Medicamentelor, Agenția Naționala a Medicamentului și autoritățile competente din statele membre ale Uniunii Europene în care medicamentul este autorizat să fie informate despre aceasta, în cel mult 15 zile de la primirea informatiei.
(5) Se vor face excepții de la prevederile alin. (2), (3) și (4) în cazul medicamentelor care intra sub incidența Directivei 87/22/CEE privind armonizarea măsurilor naționale referitoare la punerea pe piața a medicamentelor de înaltă tehnologie și în special a celor obținute prin biotehnologie sau care îndeplinesc criteriile pentru procedurile prevăzute la art. 736 și 737 sau care au fost supuse procedurilor prevăzute la art. 32, 33 și 34 din Directiva 2001/83/CE ; deținătorul autorizației de punere pe piața trebuie să se asigure de asemenea ca toate reactiile adverse grave suspectate apărute în România și în Uniunea Europeană sunt astfel raportate încât sunt accesibile statului membru de referința sau oricărei autorități competente actionand ca stat membru de referința; statul membru de referința își asuma responsabilitatea analizei și monitorizarii acestor reactii adverse.
(6) Dacă nu se stabilesc alte cerințe pentru eliberarea autorizației de punere pe piața sau ulterior, conform ghidului menționat la art. 818 alin. (1), raportarile tuturor reactiilor adverse trebuie să fie depuse la Agenția Naționala a Medicamentului în forma unui raport periodic actualizat referitor la siguranța, la cerere sau cel puțin o dată la 6 luni după autorizare și până la punerea pe piața. Rapoartele periodice actualizate referitoare la siguranța sunt de asemenea depuse la cerere sau cel puțin o dată la 6 luni în timpul primilor 2 ani de la punerea pe piața inițială și o dată pe an în următorii 2 ani. După acest interval, rapoartele se depun la intervale de 3 ani sau la cerere.
Raportul periodic actualizat referitor la siguranța include o evaluare științifică a raportului risc-beneficiu al medicamentului.
(7) După eliberarea unei autorizații de punere pe piața, deținătorul acesteia poate cere modificarea perioadelor prevăzute la alin. (6) în acord cu procedura prevăzută de Regulamentul Comisiei nr. 1.084/2003 referitor la examinarea variatiilor la termenii unei autorizații de punere pe piața pentru medicamente de uz uman și veterinar, eliberata de autoritatea competentă a unui stat membru, și cu prevederile Ordinului ministrului sănătății nr. 1.127/2003 pentru aprobarea Ghidului referitor la conținutul dosarului pentru notificările de tip IA și IB.
(8) Deținătorul unei autorizații de punere pe piața nu poate comunică informații de farmacovigilenta publicului larg în legătură cu medicamentul sau autorizat, fără notificarea anterioară sau simultană către Agenția Naționala a Medicamentului; în orice caz, deținătorul autorizației de punere pe piața trebuie să se asigure ca informațiile sunt prezentate obiectiv și nu sunt inselatoare.
Art. 817 - (1) Prin utilizarea rețelei de procesare a datelor pentru facilitarea schimbului de informații de farmacovigilenta privind medicamentele comercializate în Uniunea Europeană, Agenția Naționala a Medicamentului se asigura ca rapoartele de reactii adverse grave suspectate care au avut loc pe teritoriul României sunt disponibile prompt Agenției Europene a Medicamentelor și celorlalte state membre ale Uniunii Europene și, în orice caz, în cel mult 15 zile de la notificarea lor.
(2) Agenția Naționala a Medicamentului se asigura ca rapoartele de reactii adverse grave suspectate care au avut loc pe teritoriul României sunt imediat disponibile deținătorului autorizației de punere pe piața și, în orice caz, în cel mult 15 zile de la notificarea lor.
Art. 818 - (1) Agenția Naționala a Medicamentului aplica prevederile ghidurilor privind colectarea, verificarea și prezentarea rapoartelor referitoare la reactiile adverse, cerințele tehnice pentru schimbul electronic al informațiilor de farmacovigilenta conform formatelor internaționale acceptate, elaborate și publicate de Comisia Europeană, și comunică terminologia medicală internațional acceptată la care se va face referire; actionand conform ghidurilor, deținătorul autorizației de punere pe piața trebuie să folosească terminologia medicală internațional acceptată pentru raportarea reactiilor adverse.
(2) Pentru interpretarea definitiilor la care se face referire la pct. 11-16 ale art. 695 și a principiilor definite în prezentul capitol, deținătorul autorizației de punere pe piața și Agenția Naționala a Medicamentului trebuie să urmeze ghidurile menționate la alin. (1).
Art. 819 - (1) Dacă, în urma evaluării datelor de farmacovigilenta, Agenția Naționala a Medicamentului considera ca o autorizație de punere pe piața trebuie să fie suspendată, retrasă sau modificată conform ghidurilor menționate la art. 818 alin. (1), informează imediat Agenția Europeană a Medicamentelor, statele membre ale Uniunii Europene și deținătorul autorizației de punere pe piața.
(2) Dacă sunt necesare acțiuni urgente pentru protecția sănătății publice, Agenția Naționala a Medicamentului poate suspenda autorizația de punere pe piața a medicamentului, cu condiția ca Agenția Europeană a Medicamentelor, Comisia Europeană și statele membre ale Uniunii Europene să fie informate nu mai târziu de următoarea zi lucrătoare.
(3) Dacă Agenția Europeană a Medicamentelor este informată conform alin. (1) în legătură cu suspendarile și retragerile sau conform alin. (2), Comitetul pentru medicamente de uz uman trebuie să pregătească o opinie într-un interval de timp depinzand de urgenta problemei; în legătură cu variatiile, Comitetul pentru medicamente de uz uman poate, pe baza solicitării Agenției Naționale a Medicamentului, sa pregătească o opinie.
(4) Actionand pe baza acestei opinii, Comisia Europeană poate cere tuturor statelor membre ale Uniunii Europene unde produsul este pus pe piața sa ia imediat măsuri temporare; măsurile finale vor fi adoptate conform procedurilor europene.
Art. 820 - Agenția Naționala a Medicamentului aplica orice modificări care pot aparea ca fiind necesare pentru actualizarea prevederilor art. 812-819, pentru a lua în considerare progresul științific și tehnic, după adoptarea acestora de Comisia Europeană.
Capitolul XI - Prevederi speciale pentru medicamentele derivate din sânge uman și plasma umană
Art. 821 - Pentru colectarea și testarea sângelui uman și a plasmei umane se aplică prevederile legislației naționale care transpune prevederile Directivei 2002/98/CE a Parlamentului și Consiliului din 27 ianuarie 2003 privind stabilirea standardelor de calitate și siguranța pentru colectarea, testarea, procesarea, depozitarea și distribuirea sângelui uman și a componentelor sângelui și care modifica Directiva 2001/83/CE.
Art. 822 - Ministerul Sănătății Publice trebuie să ia măsurile necesare pentru promovarea autosuficientei sângelui uman sau a plasmei umane în România; în acest scop, trebuie să încurajeze donarile voluntare neplătite de sânge și plasma și sa ia măsurile necesare pentru dezvoltarea fabricației și utilizării produselor derivate din sânge uman sau plasma umană provenind din donari neplătite; Ministerul Sănătății Publice notifica Comisiei Europene astfel de măsuri.
Capitolul XII - Supraveghere și sancțiuni
Art. 823 - (1) Agenția Naționala a Medicamentului se asigura ca cerințele legale privind medicamentele sunt respectate, prin inspecții repetate și, dacă este cazul, inspecții neanuntate; după caz, Agenția Naționala a Medicamentului cere laboratoarelor proprii de control sau unui laborator certificat/recunoscut de Agenția Naționala a Medicamentului în acest scop să efectueze teste asupra probelor de medicamente.
Agenția Naționala a Medicamentului poate, de asemenea, să efectueze inspecții neanuntate la localurile fabricantilor de substanțe active folosite ca materii prime sau la localurile deținătorilor autorizației de punere pe piața, ori de câte ori considera ca exista motive pentru a suspecta nerespectarea principiilor și ghidurilor de buna practica de fabricație menționate la art. 756.
Agenția Naționala a Medicamentului poate efectua inspecții la fabricantii de materii prime și la cererea specială a acestora.
Astfel de inspecții sunt efectuate de inspectori ai Agenției Naționale a Medicamentului, care sunt împuterniciți:
a) sa inspecteze localurile de fabricație sau comerciale ale fabricantilor de medicamente ori de substanțe active folosite ca materii prime și orice laboratoare folosite de deținătorul autorizației de fabricație, pentru a efectua verificări conform art. 725;
b) sa ia probe inclusiv în scopul unor teste independente efectuate de un laborator al Agenției Naționale a Medicamentului sau de un laborator certificat/recunoscut de Agenția Naționala a Medicamentului; contravaloarea probelor prelevate în cadrul activității de supraveghere se suporta, după caz, de către fabricant sau unitatea de distribuție; costul analizelor efectuate de Agenția Naționala a Medicamentului sau de laboratoare recunoscute de Agenția Naționala a Medicamentului se suporta din bugetul Agenției Naționale a Medicamentului, dacă produsul este corespunzător calitativ, și de către fabricantul sau distribuitorul în culpa, dacă produsul este necorespunzător calitativ;
c) sa examineze orice document care are legătură cu obiectul inspecției, respectând prevederile naționale în vigoare care stabilesc restrictii asupra acestor puteri în ceea ce privește descrierea metodei de fabricație;
d) sa inspecteze localurile, înregistrările și documentele deținătorilor autorizației de punere pe piața sau ale oricăror firme folosite de către deținătorul autorizației de punere pe piața pentru efectuarea activităților prevăzute la cap. X al prezentului titlu și în special la art. 815 și 816.
(2) Agenția Naționala a Medicamentului acționează pentru a se asigura ca procesele de fabricație utilizate la fabricarea produselor imunologice sunt corect validate și ca se obține aceeași consistenta de la serie la serie.
(3) După fiecare inspecție menționată la alin. (1), inspectorii Agenției Naționale a Medicamentului raportează dacă fabricantul respecta principiile și ghidurile de buna practica de fabricație stabilite la art. 756 sau, după caz, cerințele stabilite la art. 812-820; conținutul acestor rapoarte este comunicat fabricantului sau deținătorului autorizației de punere pe piața la care s-a efectuat inspecția.
(4) Fără a contraveni altor acorduri care au fost încheiate între Uniunea Europeană și tari terțe, Agenția Naționala a Medicamentului poate cere unui producător stabilit într-o țara terta să se supună unei inspecții conform cu prevederile alin. (1).
(5) În termen de 90 de zile de la inspecția efectuată în conformitate cu prevederile alin. (1), se emite un certificat de buna practica de fabricație, dacă inspecția demonstreaza ca fabricantul respecta principiile și ghidurile de buna practica de fabricație conform legislației naționale; dacă inspecțiile sunt efectuate ca parte a procedurii de certificare pentru monografiile Farmacopeii Europene, se întocmește un certificat de buna practica de fabricație.
(6) Agenția Naționala a Medicamentului introduce certificatele de buna practica de fabricație pe care le eliberează într-o baza de date a Uniunii Europene, administrată de Agenția Europeană a Medicamentelor în numele Uniunii Europene.
(7) Dacă rezultatul inspecției conform alin. (1) indica faptul ca fabricantul nu respecta principiile și ghidurile de buna practica de fabricație conform legislației naționale, informațiile se introduc în baza de date a Uniunii Europene menționată la alin. (6).
(8) Inspecțiile prevăzute la alin. (1) pot fi de asemenea efectuate la cererea unui stat membru al Uniunii Europene, a Comisiei Europene sau a Agenției Europene a Medicamentelor.
Art. 824 - Agenția Naționala a Medicamentului ia toate măsurile necesare pentru a se asigura ca deținătorul autorizației de punere pe piața pentru un medicament și, după caz, deținătorul autorizației de fabricație fac dovada controalelor efectuate privind medicamentul și/sau ingredientele și a controalelor efectuate în stadii intermediare ale procesului de fabricație, conform metodelor stabilite la art. 702 alin. (4) lit. i).
Art. 825 - În scopul implementarii prevederilor art. 824, Agenția Naționala a Medicamentului poate cere fabricantilor de produse imunologice să depună la Agenția Naționala a Medicamentului copiile tuturor rapoartelor de control semnate de persoana calificată conform art. 760.
Art. 826 - (1) Dacă Agenția Naționala a Medicamentului considera ca este necesar în interesul sănătății publice, poate cere deținătorului autorizației de punere pe piața pentru:
– vaccinuri vii;
– medicamente imunologice utilizate în imunizarea primara a copiilor sau altor grupe de risc;
– medicamente imunologice utilizate în programele de imunizare pentru sănătatea publică;
– medicamente imunologice noi sau medicamente imunologice fabricate folosind tehnici noi ori tehnologii modificate sau noi pentru un anume fabricant, în timpul unei perioade de tranzitie în mod normal specificate în autorizația de punere pe piața,
să depună probe pentru fiecare serie de producție pentru examinare de către un laborator propriu sau un laborator certificat/recunoscut de Agenția Naționala a Medicamentului în acest scop, înainte de punerea pe piața, dacă, în cazul unei serii fabricate într-un stat membru al Uniunii Europene, autoritatea competentă a acelui stat membru nu a examinat seria respectiva și nu a declarat-o a fi în conformitate cu specificățiile aprobate.
Agenția Naționala a Medicamentului se asigura ca orice astfel de examinare este finalizată în termen de 60 de zile de la recepția probelor.
(2) În interesul sănătății publice, Agenția Naționala a Medicamentului poate cere deținătorului autorizației de punere pe piața pentru medicamente derivate din sânge uman sau plasma umană să depună probe din fiecare serie de fabricație a produsului vrac pentru testarea de către un laborator propriu sau un laborator certificat/recunoscut de Agenția Naționala a Medicamentului în acest scop, înainte de intrarea în circuitul terapeutic, dacă autoritatea competentă a unui stat membru al Uniunii Europene nu a examinat anterior seria respectiva și nu a declarat-o a fi în conformitate cu specificățiile aprobate. Agenția Naționala a Medicamentului se asigura ca orice astfel de examinare este completată în termen de 60 de zile de la recepția probelor.
Art. 827 - (1) Agenția Naționala a Medicamentului ia toate măsurile necesare pentru a se asigura ca procesele de fabricație și purificare utilizate în prepararea medicamentelor derivate din sânge uman sau plasma umană sunt validate corespunzător, ating aceeași consistenta de la serie la serie și garantează, conform stadiului tehnologic actual, absenta contaminarii virale specifice.
(2) În acest scop, fabricantii notifica Agenției Naționale a Medicamentului metoda utilizata pentru a reduce sau a elimina virusurile patogene ce pot fi transmise de medicamente derivate din sânge uman sau din plasma umană.
(3) Agenția Naționala a Medicamentului poate depune probe din seria respectiva pentru testare de către un laborator propriu sau un laborator certificat/recunoscut de Agenția Naționala a Medicamentului în acest scop, fie în timpul examinării cererii conform art. 724, fie după ce a fost acordată o autorizație de punere pe piața.
Art. 828 - (1) Agenția Naționala a Medicamentului suspenda, retrage sau modifica o autorizație de punere pe piața dacă se dovedește ca produsul este periculos în condiții normale de folosire sau dacă este lipsit de eficacitate terapeutică ori dacă raportul risc-beneficiu nu este pozitiv în condiții normale de utilizare sau dacă compozitia calitativă ori cantitativă nu este conformă cu aceea declarata; eficacitatea terapeutică este absenta dacă se ajunge la concluzia că nu pot fi obținute rezultate terapeutice cu medicamentul respectiv.
(2) Autorizația este de asemenea suspendată, retrasă sau modificată dacă datele de sustinere a cererii prevăzute la art. 702 sau art. 704, 705, 706, 707 și 708 sunt incorecte ori nu au fost modificate conform prevederilor art. 728 sau dacă nu au fost efectuate controalele menționate la art. 824.
Art. 829 - (1) Cu respectarea măsurilor prevăzute la art. 828, Agenția Naționala a Medicamentului ia toate măsurile necesare pentru a se asigura ca furnizarea medicamentului este interzisă și medicamentul este retras de pe piața dacă se observa ca:
a) medicamentul este periculos în condiții normale de utilizare; sau
b) nu are eficacitate terapeutică; sau
c) raportul risc-beneficiu nu este favorabil în condițiile de utilizare autorizate; sau
d) compozitia calitativă și cantitativă nu este conformă cu aceea declarata; sau
e) controalele medicamentului și/sau ale ingredientelor și controalele în stadiile intermediare de fabricație nu au fost efectuate sau alte cerințe ori obligații necesare acordării autorizației de fabricație nu au fost îndeplinite.
(2) Agenția Naționala a Medicamentului poate limita interdicția de furnizare a medicamentului sau de retragere de pe piața la acele serii care fac obiectul disputei.
Art. 830 - (1) Agenția Naționala a Medicamentului suspenda sau retrage autorizația de punere pe piața pentru o categorie de medicamente sau pentru toate medicamentele dacă una dintre cerințele prevăzute la art. 749 nu mai este îndeplinită.
(2) În plus față de măsurile prevăzute la art. 829, Agenția Naționala a Medicamentului poate suspenda fabricatia sau importurile de medicamente provenind din tari terțe sau suspenda ori retrage autorizația de fabricație pentru o categorie de medicamente sau pentru toate medicamentele dacă prevederile art. 750, 754, 760 și 824 nu mai sunt respectate.
Art. 831 - Prevederile prezentului capitol se aplică și pentru medicamentele homeopate.
Art. 832 - (1) Unitățile de distribuție angro și en detail au obligația de a informa Agenția Naționala a Medicamentului despre deficientele de calitate semnalate în legătură cu medicamentele.
(2) Agenția Naționala a Medicamentului analizează reclamațiile privind deficientele de calitate și propune măsurile administrative necesare.
(3) Unitățile farmaceutice au obligația să respecte prevederile legale privind retragerea din consum a medicamentelor necorespunzătoare.
(4) Orice unitate de producție sau de distribuție a medicamentelor procedează la distrugerea medicamentelor necorespunzătoare calitativ sau expirate, în acord cu reglementările în vigoare; medicamentele stupefiante și psihotrope sunt distruse în conformitate cu legislația în vigoare.
(5) Orice persoană care utilizează medicamente poate să informeze Agenția Naționala a Medicamentului despre deficientele de calitate sesizate în legătură cu medicamentele utilizate.
Art. 833 - Nerespectarea prevederilor prezentului titlu atrage răspunderea disciplinară, civilă, contravențională sau penală, după caz.
Art. 834 - (1) Contrafacerea sau punerea în circulație de medicamente fără respectarea prevederilor prezentului titlu constituie infracțiune și se pedepsește cu închisoare de la 3 luni la 3 ani.
(2) Dacă medicamentele contrafăcute sau puse în circulație fără respectarea prevederilor prezentului titlu sunt vătămătoare sănătății, fapta se pedepsește cu închisoare de la un an la 8 ani.
(3) Dacă faptele prevăzute la alin. (1) sau (2) au avut ca urmare îmbolnăvirea sau agravarea bolii unei persoane, pedeapsa este închisoarea de la 2 ani la 8 ani, iar dacă a avut ca urmare decesul, pedeapsa este închisoarea de la 5 ani la 15 ani.
Art. 835 - (1) Nerespectarea de către personalul calificat în studiul clinic al medicamentelor a Regulilor de buna practica în studiul clinic constituie infracțiune și se pedepsește cu închisoare de la 3 luni la 6 luni sau cu amendă de la 10.000 lei (RON) la 20.000 lei (RON).
(2) Efectuarea de către personal necalificat în studiul clinic al medicamentelor a unor studii care necesita aprobarea Agenției Naționale a Medicamentului, precum și nerespectarea Regulilor de buna practica în studiul clinic atrag răspunderea penală a acestuia și se pedepsesc cu închisoare de la un an la 2 ani.
(3) Dacă fapta prevăzută la alin. (1) sau (2) a avut ca urmare decesul, îmbolnăvirea sau agravarea bolii ori vătămarea integrității corporale a unei persoane, pedeapsa este închisoarea de la 2 ani la 5 ani.
Art. 836 - (1) Constituie contravenții următoarele fapte și se sancționează de către inspectorii din Agenția Naționala a Medicamentului și, după caz, din Ministerul Sănătății Publice, astfel:
a) cu amendă de la 10.000 lei (RON) la 30.000 lei (RON) aplicată fabricantului și cu închiderea unității, în cazul funcționarii unității de producție de medicamente fără autorizație de fabricație emisă de Agenția Naționala a Medicamentului; se sancționează cu aceeași amenda distribuitorul și cu închiderea unității de distribuție angro a medicamentelor, care funcționează fără autorizație emisă de Ministerul Sănătății Publice;
b) cu amendă de la 5.000 lei (RON) la 10.000 lei (RON), în cazul nerespectării Regulilor de buna practica de laborator de către laboratoarele care efectuează teste farmacotoxicologice în vederea întocmirii documentației de autorizare de punere pe piața a medicamentelor de uz uman;
c) cu amendă de la 5.000 lei (RON) la 10.000 lei (RON), aplicată fabricantului sau distribuitorului, după caz, pentru practicarea în cadrul unității de producție sau de distribuție a medicamentelor a altor activități decât a celor pentru care au fost autorizate, distribuția de la fabricant sau din depozitele de medicamente a medicamentelor către unități neautorizate de Ministerul Sănătății Publice în condițiile legii, participarea persoanelor necalificate la operațiuni tehnice care necesita calificare de specialitate în procesul de fabricație și în cel de distribuție, precum și nerespectarea prevederilor referitoare la clasificarea pentru eliberarea, inscriptionarea și prospectul medicamentelor, publicitatea medicamentelor, raportarea schimbărilor survenite în activitatea de producție sau de distribuție, retrageri, nerespectarea Regulilor de buna practica în activitatea de farmacovigilenta desfășurată de deținătorul autorizației de punere pe piața;
d) cu amendă de la 5.000 lei (RON) la 10.000 lei (RON) aplicată fabricantului în cazul nerespectării condițiilor de funcționare a unității de producție de medicamente pentru care a fost autorizat sau în cazul nerespectării Regulilor de buna practica de fabricație;
e) cu amendă de la 10.000 lei (RON la 20.000 lei (RON), în cazul fabricării și distribuției medicamentelor fără documente care să ateste proveniență și/sau calitatea acestora, în cazul nerespectării prevederilor privind procedura de retragere a medicamentelor de către fabricanti și distribuitori, precum și în cazul deținerii și distribuirii medicamentelor cu termen de valabilitate depășit sau cu buletin de analiza necorespunzător;
f) cu amendă de la 5.000 lei (RON) la 10.000 lei (RON), lipsa din unitățile de distribuție a farmacistului-șef sau a înlocuitorului acestuia pe perioada în care unitatea funcționează, precum și împiedicarea exercitării activității de inspecție;
g) cu amendă de la 10.000 lei (RON) la 30.000 lei (RON) și suspendarea autorizației de funcționare a unității de distribuție pe o durată de un an în cazul repetarii într-o perioadă de 3 luni a uneia dintre contravențiile constatate, prevăzute la lit. c) și e);
h) cu amendă de la 5.000 lei (RON) la 20.000 lei (RON) și suspendarea autorizației de funcționare a unității de distribuție, în cazul nerespectării Regulilor de distribuție angro, până la remedierea deficiențelor constatate;
i) cu amendă de la 2.000 lei (RON) la 5.000 lei (RON), în cazul în care deținătorul autorizației de punere pe piața nu raportează la Agenția Naționala a Medicamentului reactiile adverse care i-au fost aduse la cunoștința.
(2) Limitele amenzilor prevăzute la alin. (1) pot fi modificate periodic prin hotărâre a Guvernului.
Art. 837 - Dispozițiile art. 836 se completează cu prevederile Ordonanței Guvernului nr. 2/2001 privind regimul juridic al contravențiilor, aprobată cu modificări și completări prin Legea nr. 180/2002, cu modificările și completările ulterioare.
Art. 838 - Încălcarea prevederilor legale privind regimul medicamentelor stupefiante și psihotrope se sancționează potrivit legislației în vigoare.
Capitolul XIII - Dispoziții generale
Art. 839 - (1) Ministerul Sănătății Publice ia toate măsurile necesare pentru a se asigura ca Agenția Naționala a Medicamentului transmite celorlalte autorități competente din statele membre ale Uniunii Europene informațiile corespunzătoare pentru a garanta ca cerințele conținute în autorizațiile menționate la art. 748 și 788, în certificatele menționate la art. 823 alin. (5) sau în autorizațiile de punere pe piața sunt îndeplinite.
(2) În urma unor solicitări justificate, Agenția Naționala a Medicamentului comunică de îndată rapoartele menționate la art. 823 alin. (3) autorității competente din alt stat membru al Uniunii Europene.
(3) Concluziile obținute conform art. 823 alin. (1) sunt valabile pe tot teritoriul Uniunii Europene. Totuși, în cazuri excepționale, dacă Agenția Naționala a Medicamentului nu poate să accepte, din motive de sănătate publică, concluziile rezultate dintr-o inspecție efectuată în conformitate cu art. 823 alin. (1), trebuie să informeze despre aceasta Comisia Europeană și Agenția Europeană a Medicamentelor.
Art. 840 - (1) Agenția Naționala a Medicamentului ia toate măsurile necesare pentru a se asigura ca deciziile de autorizare de punere pe piața, refuzare sau retragere a unei autorizații de punere pe piața, anularea unei decizii de refuzare sau de retragere a unei autorizații de punere pe piața, de interzicere a furnizarii sau retragerii unui produs de pe piața, împreună cu motivele care au determinat astfel de decizii, sunt aduse imediat la cunoștința Agenției Europene a Medicamentelor.
(2) Deținătorul autorizației de punere pe piața este obligat sa notifice imediat Agenției Naționale a Medicamentului, precum și autorităților competente din alte state membre interesate ale Uniunii Europene în legătură cu orice acțiune pe care a initiat-o pentru suspendarea punerii pe piața a unui medicament sau pentru retragerea unui medicament de pe piața, împreună cu motivele care au determinat aceasta acțiune, dacă aceasta are legătură cu eficacitatea medicamentului sau cu protecția sănătății publice; Agenția Naționala a Medicamentului se asigura ca aceasta informație este adusă la cunoștința Agenției Europene a Medicamentelor.
(3) Agenția Naționala a Medicamentului se asigura ca informațiile corespunzătoare despre acțiunile menționate la alin. (1) și (2), care pot afecta protecția sănătății publice în tari terțe, sunt transmise imediat în atenția Organizației Mondiale a Sănătății, cu o copie la Agenția Europeană a Medicamentelor.
(4) Agenția Naționala a Medicamentului ia în considerare lista medicamentelor interzise în Uniunea Europeană, publicată anual de Comisia Europeană.
Art. 841 - Agenția Naționala a Medicamentului comunică cu statele membre ale Uniunii Europene și primește de la acestea informații necesare pentru a garanta calitatea și siguranța medicamentelor homeopate fabricate și comercializate pe teritoriul României și al Uniunii Europene și, în special, informațiile menționate la art. 839 și 840.
Art. 842 - (1) Orice decizie menționată în prezentul titlu, care este luată de Agenția Naționala a Medicamentului, trebuie să menționeze în detaliu motivele pe care se bazează.
(2) O astfel de decizie este notificată părții interesate, împreună cu informații privind calea de atac conform legislației în vigoare și termenul limita pentru accesul la aceasta.
(3) Deciziile de acordare sau de retragere a unei autorizații de punere pe piața sunt făcute publice.
Art. 843 - (1) O autorizație de punere pe piața a unui medicament nu este refuzată, suspendată sau retrasă decât pentru motivele stabilite în prezentul titlu.
(2) Nu se poate lua o decizie privind suspendarea fabricației sau importului de medicamente din tari terțe, interzicerea de furnizare sau retragerea de pe piața decât pe baza condițiilor prevăzute la art. 829 și 830.
Art. 844 - (1) În absenta unei autorizații de punere pe piața sau a unei cereri de autorizare depuse pentru un medicament autorizat în alt stat membru al Uniunii Europene conform Directivei 2001/83/CE , Agenția Naționala a Medicamentului poate, pe motive de sănătate publică, sa autorizeze punerea pe piața a medicamentului respectiv.
(2) Dacă Agenția Naționala a Medicamentului folosește aceasta posibilitate, adopta toate măsurile necesare pentru a se asigura ca cerințele prezentului titlu sunt respectate, în special cele menționate în cap. V, VI, VIII, X și XII din prezentul titlu.
(3) Înainte de acordarea unei astfel de autorizații, Agenția Naționala a Medicamentului:
a) notifica deținătorului autorizației de punere pe piața din statul membru al Uniunii Europene în care medicamentul în cauza este autorizat despre propunerea de acordare a unei autorizații conform prezentului articol; și
b) cere autorității competente din acel stat membru al Uniunii Europene sa furnizeze o copie a raportului de evaluare menționat la art. 21 alin. 4 din Directiva 2001/83/CE și a autorizației de punere pe piața în vigoare a medicamentului în cauza.
(4) Agenția Naționala a Medicamentului notifica Comisiei Europene dacă un medicament este autorizat sau încetează sa mai fie autorizat, conform alin. (1), inclusiv numele sau denumirea și adresa permanenta ale deținătorului autorizației de punere pe piața.
Art. 845 - (1) Pentru a garanta independenta și transparenta, Agenția Naționala a Medicamentului se asigura ca personalul sau responsabil cu acordarea autorizațiilor, raportorii și experții implicați în autorizarea și supravegherea medicamentelor nu au nici un interes financiar sau alte interese în industria farmaceutica, care le-ar putea afecta imparțialitatea; aceste persoane vor face o declarație anuală de interese.
(2) În plus, Agenția Naționala a Medicamentului face publice regulile proprii de procedura și pe acelea ale consiliilor și comisiilor sale, agendele și rapoartele intalnirilor, însoțite de deciziile luate, detalii despre voturi și explicații ale voturilor, inclusiv opiniile minoritare.
Art. 846 - (1) La cererea fabricantului, exportatorului sau a autorităților dintr-o țara importatoare terta, Agenția Naționala a Medicamentului certifica faptul ca un fabricant de medicamente deține o autorizație de fabricație; la eliberarea acestui fel de certificate, Agenția Naționala a Medicamentului trebuie să se conformeze următoarelor condiții:
a) sa țină seama de recomandările Organizației Mondiale a Sănătății;
b) pentru medicamentele destinate exportului, deja autorizate în România, sa furnizeze rezumatul caracteristicilor produsului aprobat conform art. 726.
(2) Dacă fabricantul nu deține o autorizație de punere pe piața, acesta furnizează Agenției Naționale a Medicamentului o declarație în care explica de ce nu este disponibilă o autorizație de punere pe piața.
Art. 847 - În cazul medicamentelor autorizate prin procedura centralizata, Agenția Naționala a Medicamentului implementeaza condițiile sau restricțiile referitoare la siguranța și utilizarea eficace a medicamentelor, prevăzute în opinia Comitetului pentru medicamente de uz uman al Agenției Europene a Medicamentelor.
Art. 848 - Ministerul Sănătății Publice se asigura ca exista sisteme adecvate de colectare a medicamentelor nefolosite sau expirate.
Art. 849 - Dispozițiile prezentului titlu se aplică și medicamentelor cu conținut stupefiant și psihotrop, precum și medicamentelor conținând substanțe chimice periculoase, reglementate prin Legea nr. 360/2003 privind regimul substanțelor și preparatelor chimice periculoase, cu modificările și completările ulterioare.
Art. 850 - Guvernul, la propunerea Ministerului Sănătății Publice, pe motive legate de interesul sănătății publice, poate să limiteze sau sa interzică pentru anumite perioade de timp exportul unor medicamente de uz uman.
Art. 851 - Ministerul Sănătății Publice stabilește și avizează prețurile medicamentelor din import și din țara, cu excepția medicamentelor care se eliberează fără prescripție medicală (OTC).
Capitolul XIV - Dispoziții finale și tranzitorii
Art. 852 - (1) Pentru medicamentele de referința autorizate de punere pe piața sau pentru care au fost depuse cereri de autorizare în România ori în statele membre ale Uniunii Europene înainte de data de 30 octombrie 2005, respectiv la Agenția Europeană a Medicamentelor pentru autorizare prin procedura centralizata înainte de data de 20 noiembrie 2005, se aplică prevederile alin. (2)-(9).
(2) Ca excepție de la prevederile art. 702 alin. (4) lit. j), cu respectarea legislației privind protecția proprietății industriale și comerciale, solicitantul nu trebuie să furnizeze rezultatele testelor preclinice și ale studiilor clinice, dacă poate demonstra ca medicamentul este un generic al unui medicament de referința care este ori a fost autorizat în România, într-un stat membru al Uniunii Europene sau în Uniunea Europeană prin procedura centralizata.
(3) Solicitantul se poate prevala de dreptul prevăzut la alin. (2) numai după trecerea a cel puțin 6 ani de la autorizarea medicamentului de referința în România sau în unul dintre statele membre ale Uniunii Europene, respectiv cel puțin 10 ani de la autorizare pentru medicamentele de înaltă tehnologie autorizate în Uniunea Europeană prin procedura centralizata (perioada de exclusivitate a datelor).
(4) Perioada de exclusivitate a datelor se calculează de la data autorizării medicamentului de referința în România, în unul dintre statele membre ale Uniunii Europene sau în Uniunea Europeană prin procedura centralizata, oricare dintre aceste autorizari a survenit mai întâi.
(5) În cazul în care medicamentul de referința nu a fost autorizat în România, solicitantul trebuie să indice în documentația depusa numele statului membru al Uniunii Europene în care medicamentul de referința este sau a fost autorizat ori faptul ca medicamentul a fost autorizat în Uniunea Europeană prin procedura centralizata. Agenția Naționala a Medicamentului solicita autorității competente din statul membru al Uniunii Europene indicat de solicitant, respectiv Agenției Europene a Medicamentelor, confirmarea faptului ca medicamentul de referința este sau a fost autorizat, compozitia completa a medicamentului de referința și, dacă este cazul, alta documentație relevanta.
(6) În înțelesul prezentului articol, medicamente de înaltă tehnologie înseamnă orice medicament care se încadrează în una dintre categoriile de mai jos și care a fost autorizat prin procedura centralizata:
a) medicamentele obținute prin unul dintre următoarele procese biotehnologice:
– tehnologia ADN recombinat;
– expresia controlată a genelor care codifica proteine biologic active în celulele procariote și eucariote, inclusiv în celulele transformate de mamifere;
– metodele cu hibridomi și anticorpi monoclonali;
b) medicamentele obținute prin alte procese biotehnologice decât cele menționate la lit. a) și care constituie o inovație semnificativă;
c) medicamentele administrate cu ajutorul unor sisteme de eliberare noi și care constituie o inovație semnificativă;
d) medicamentele pentru o indicație terapeutică complet noua și care prezintă un interes terapeutic important;
e) medicamentele bazate pe izotopi radioactivi și care prezintă un interes terapeutic important;
f) medicamentele derivate din sânge și plasma umană;
g) medicamentele pentru a căror fabricație se folosesc procese tehnologice avansate, cum ar fi electroforeza bidimensionala sub microgravitatie;
h) medicamentele conținând o substanța activa noua care nu a fost autorizata pentru utilizare în medicamente de uz uman în nici unul dintre statele membre ale Uniunii Europene înainte de data de 1 ianuarie 1995.
(7) Cu toate acestea, în cazul în care se intenționează ca medicamentul să fie folosit pentru o alta indicație terapeutică decât aceea a celorlalte medicamente aflate pe piața sau să fie administrat pe cai diferite ori în doze diferite, este necesar să fie transmise rezultatele testelor toxicologice și farmacologice și/sau ale studiilor clinice adecvate.
(8) Agenția Naționala a Medicamentului poate primi cereri de autorizare pentru medicamente generice numai după expirarea perioadei de exclusivitate a datelor, acordată în România pentru un medicament de referința.
(9) În înțelesul prezentului articol, termenii medicament de referința și medicament generic vor avea același înțeles ca în art. 704 alin. (2).
Art. 853 - În privinta procedurii de autorizare de punere pe piața, pentru cererile depuse la Agenția Naționala a Medicamentului până la data intrării în vigoare a prezentului titlu, se respecta prevederile legale în vigoare la momentul depunerii cererii.
Art. 854 - La depunerea documentației în vederea obținerii autorizației de punere pe piața, solicitanții plătesc la Agenția Naționala a Medicamentului o taxa de autorizare de punere pe piața de 100 euro sau echivalentul în lei la cursul Băncii Naționale a României, care se virează la bugetul de stat.
Art. 855 - Autorizarea de punere pe piața a medicamentelor nu se supune reglementărilor privind procedura aprobării tacite, cu excepția prevederilor art. 771 alin. (3).
Art. 856 - (1) La depunerea documentației pentru autorizarea de funcționare, depozitele farmaceutice plătesc în contul Ministerul Sănătății Publice suma de 4.000 lei (RON).
(2) Sumele încasate potrivit alin. (1) de către Ministerul Sănătății Publice se virează la bugetul de stat, potrivit dispozițiilor legale.
Art. 857 - Tarifele propuse de Agenția Naționala a Medicamentului pentru activitățile desfășurate de aceasta se aproba prin ordin al ministrului sănătății publice, care se publică în Monitorul Oficial al României, Partea I.
Art. 858 - Cheltuielile necesare pentru efectuarea de către salariații Ministerului Sănătății Publice a inspecțiilor în vederea acordării autorizației de funcționare pentru depozite farmaceutice sau a altor tipuri de inspecții sunt asigurate din bugetul acestui minister.
Art. 859 - Perioada de exclusivitate a datelor prevăzută la art. 704 alin. (1) se aplică medicamentelor de referința pentru care au fost depuse cereri de autorizare la Agenția Naționala a Medicamentului sau în statele membre ale Uniunii Europene după data de 30 octombrie 2005, respectiv la Agenția Europeană a Medicamentelor pentru autorizare prin procedura centralizata după data de 20 noiembrie 2005.
Art. 860 - Pentru medicamentele din plante medicinale traditionale care sunt deja pe piața la momentul intrării în vigoare a prezentului titlu, Agenția Naționala a Medicamentului aplica prevederile acestui titlu pe un termen de 7 ani de la intrarea în vigoare a prezentului titlu.
Art. 861 - (1) La data intrării în vigoare a prevederilor prezentului titlu se abroga Ordonanța de urgenta a Guvernului nr. 152/1999 privind produsele medicamentoase de uz uman, publicată în Monitorul Oficial al României, Partea I, nr. 508 din 20 octombrie 1999, aprobată cu modificări și completări prin Legea nr. 336/2002, cu modificările și completările ulterioare, cu excepția art. 109 alin. 1^1), precum și orice alte dispoziții contrare prevederilor prezentei legi.
(2) Legislația secundară elaborata în baza Ordonanței de urgenta a Guvernului nr. 152/1999, aprobată cu modificări și completări prin Legea nr. 336/2002, cu modificările și completările ulterioare, rămâne în vigoare în măsura în care nu contravine prezentului titlu.
(3) Prin excepție de la prevederile alin. (1), următoarele prevederi se abroga la 3 zile de la data publicării prezentei legi:
a) art. 23^1 din Ordonanța de urgenta a Guvernului nr. 152/1999, aprobată cu modificări și completări de Legea nr. 336/2002, cu modificările și completările ulterioare;
b) art. 9 pct. 2 lit. a) subpct. (iii) din anexa nr. 1 „Reglementări privind autorizarea de punere pe piața și supravegherea produselor medicamentoase de uz uman” la Ordinul ministrului sănătății și familiei nr. 263/2003 pentru aprobarea Reglementărilor privind autorizarea de punere pe piața, supravegherea, publicitatea, etichetarea și prospectul produselor medicamentoase de uz uman, publicat în Monitorul Oficial al României, Partea I, nr. 336 și nr. 336 bis din 19 mai 2003;
c) Ordinul ministrului sănătății nr. 1.443/2004 privind aprobarea Normelor de aplicare a prevederilor Ordonanței de urgenta a Guvernului nr. 152/1999 privind produsele medicamentoase de uz uman, aprobată cu modificări și completări prin Legea nr. 336/2002, cu modificările și completările ulterioare, referitoare la exclusivitatea datelor, publicat în Monitorul Oficial al României, Partea I, nr. 1.077 din 19 noiembrie 2004.
Art. 862 - Următoarele prevederi ale prezentului titlu se abroga la data aderării României la Uniunea Europeană;
– art. 700 alin. (2);
– art. 730 alin. (3);
– art. 733;
– art. 735 alin. (2);
– art. 787 alin. (1).
Prezentul titlu transpune Directiva 2001/83/CEdin 6 noiembrie 2001 instituind codul comunitar al medicamentelor de uz uman, publicată în J.O. nr. L 311 din 28 noiembrie 2001, cu excepția anexei, amendata prin: Directiva 2002/98/CE din 27 ianuarie 2003 care stabilește standardele de calitate și siguranța pentru colectarea, testarea, procesarea, depozitarea și distribuirea sângelui uman și componentelor din sânge, care modifica Directiva 2001/83/CE , publicată în J.O. nr. L 33 din 8 februarie 2003, Directiva 2004/24/CE din 31 martie 2004 care modifica Directiva 2001/83/CE în ceea ce privește medicamentele din plante medicinale traditionale, publicată în J.O. nr. L 136 din 30 aprilie 2004, și Directiva 2004/27/CE din 31 martie 2004 care modifica Directiva 2001/83/CE , publicată în J.O. nr. L 136 din 30 aprilie 2004.
Art. 863 - Prezenta lege intră în vigoare astfel:
a) la 3 zile de la publicare: titlul XI „Finanțarea unor cheltuieli de sănătate”, titlul XII „Exercitarea profesiei de medic. Organizarea și funcționarea Colegiului Medicilor din România”, titlul XIII „Exercitarea profesiei de medic dentist. Organizarea și funcționarea Colegiului Medicilor Dentisti din România”, titlul XIV „Exercitarea profesiei de farmacist. Organizarea și funcționarea Colegiului Farmacistilor din România”, precum și art. 704 alin. (2) și art. 852;
b) la 30 de zile de la publicare: titlul I „Sănătatea publică”, titlul II „Programele naționale de sănătate”, titlul V „Asistența medicală comunitara”, titlul VII „Spitalele”, titlul VIII „Asigurările sociale de sănătate”, titlul XVI „Înființarea, organizarea și funcționarea Școlii Naționale de Sănătate Publică și Management Sanitar”;
c) la 90 de zile de la publicare: titlul III „Asistența medicală primara”, titlul IV „Sistemul național de asistența medicală de urgenta și de prim ajutor calificat”, titlul VI „Efectuarea prelevarii și transplantului de organe, tesuturi și celule de origine umană în scop terapeutic”, titlul IX „Cardul european și cardul național de asigurări sociale de sănătate”, titlul X „Asigurările voluntare de sănătate”, titlul XV „Răspunderea civilă a personalului medical și a furnizorului de produse și servicii medicale, sanitare și farmaceutice”, titlul XVII „Medicamentul”;
d) de la data aderării României la Uniunea Europeană: art. 700 alin. (1), art. 702 alin. (2), art. 704 alin. (5), art. 710 alin. (2), art. 716 alin. (1) lit. c), art. 716 alin. (4), art. 717 alin. (2), art. 718 alin. (2), art. 719 alin. (1), art. 721 alin. (1) și (3), art. 722 alin. (1) teza a doua, art. 722 alin. (2), art. 723, art. 726 alin. (3), art. 726 alin. (4) teza a doua, art. 727 alin. (3), art. 730 alin. (5)-(8), art. 735 alin. (1), art. 736-747, art. 748 alin. (4), art. 749 alin. (1) lit. b), art. 759 alin. (1), art. 767, art. 768, art. 769 alin. (1) lif. f) pct. (vi), art. 769 alin. (1) lit. g), art. 769 alin. (3), art. 771 alin. (3), art. 775, art. 785, art. 786, art. 787 alin. (3) lit. a), art. 787 alin. (4), art. 788 alin. (4), art. 788 alin. (6) teza a doua, art. 788 alin. (7), art. 791 lit. g), art. 792 alin. (1), art. 792 alin. (3), art. 813, art. 814, art. 816 alin. (6) teza a doua, art. 817, art. 822, art. 823 alin. (4), art. 823 alin. (6)-(8), art. 839, art. 840 alin. (2)-(4), art. 844, art. 845 alin. (2) și art. 848;
e) la 6 luni de la data aderării României la Uniunea Europeană: art. 320-329;
f) la un an de la data aderării României la Uniunea Europeană: art. 766.
Această lege a fost adoptată în temeiul prevederilor art. 114 alin. (3) din Constituția României, republicată, în urma angajării răspunderii Guvernului în fața Camerei Deputaților și a Senatului, în ședința comuna din data de 21 februarie 2006.
PREȘEDINTELE CAMEREI DEPUTAȚILOR
ADRIAN NASTASE
PREȘEDINTELE SENATULUI
NICOLAE VACAROIU
București, 14 aprilie 2006.
Nr. 95.
ANEXA Nr. 1
DECLARAȚIE
Subsemnatul (subsemnata) ………………………………………….., informat (informată) și constient (conștiență) asupra riscurilor donarii de organe și/sau tesuturi și/sau celule, în concordanta cu dispozițiile legale în vigoare, declar că sunt de acord cu donarea următoarelor organe și/sau tesuturi și/sau celule: ……………………. pentru efectuarea procedurilor de transplant către ………………………………….., care este …………………………….. (gradul de rudenie DA/NU).Înțeleg gestul meu ca fiind un act profund umanitar. Asupra mea nu au fost făcute nici un fel de presiuni. Nu condiționez aceasta donare de obținerea vreunei recompense materiale pentru mine, familia mea sau terțe persoane.
Data ………………….
Donatorul ……………..
Primitorul …………….
Comisia de avizare a donarii de la donatorul viu – membri:
1. ………
2. ………
3. ………
ANEXA Nr. 2
DECLARAȚIE
Subsemnatul (subsemnata) ……………………………………. (tatăl, mama, reprezentantul legal) al numitului (numitei) ………………….., minor (minora), informat (informată) și constient (conștiență) asupra riscurilor prelevarii de celule suse (stem) hematopoietice medulare sau periferice, în concordanta cu dispozițiile legale în vigoare referitoare la prelevarea și transplantul de organe, tesuturi și celule umane, declar că sunt de acord cu recoltarea și donarea de celule suse (stem) hematopoietice medulare sau periferice în beneficiul …………………………. .Înțeleg gestul meu ca fiind un act profund umanitar. Asupra mea nu au fost făcute nici un fel de presiuni.
Data ……………………….
Tatăl ………………………
Mama ……………………….
Reprezentantul legal …………
Președintele Tribunalului …….
ANEXA Nr. 3
CRITERII DE DIAGNOSTIC pentru confirmarea morții cerebraleDatele pe care trebuie să le conțină actul constatator
I. Diagnosticul morții cerebrale se stabilește pe baza următoarelor criterii:
1. Examen clinic:
– starea de coma profunda, flasca, reactiva;
– absenta reflexelor de trunchi cerebral.
2. Absenta ventilatiei spontane, confirmată de testul de apnee (la un Pa CO2 de 60 mm Hg).
3. Traseu electroencefalografic care să ateste lipsa electrogenezei corticale.
Cele 3 examene care confirma moartea cerebrala se repeta la un interval de cel puțin 6 ore pentru adulti. Pentru copii, intervalul este de 48 ore pentru nou-nascutul cu vârsta între 7 zile-2 luni, 24 de ore pentru copilul cu vârsta între 2 luni-2 ani și 12 ore pentru copilul cu vârsta între 2-7 ani. Pentru copiii cu vârsta peste 7 ani, intervalul este același ca la adulti. La nou-nascutul cu vârsta mai mica de 7 zile nu se declara moartea cerebrala.
II. Cauza care a determinat moartea cerebrala trebuie să fie clar stabilită.
III. Excluderea altor cauze reversibile care ar putea produce un tablou clinic și un traseu EEG, asemănătoare cu cele din moartea cerebrala (hipotermia, mai mica de 35 grade C, medicamente depresoare ale sistemului nervos central, hipertensiune arteriala – presiune arteriala medie mai mica de 55 mm Hg).
IV. Diagnosticul de moarte cerebrala va fi stabilit de doi anestezisti reanimatori diferiți sau de un anestezist reanimator și un neurolog sau neurochirurg.
V. Diagnosticul de moarte cerebrala va fi înregistrat în următorul protocol
PROTOCOL DE DECLARARE A MORȚII CEREBRALE
Numele donatorului: ……. vârsta: …………………….
F.O. nr. …………. Cauza morții cerebrale: …………..
Debutul comei: ……….. Data: ………… Ora: ……….
Criterii de diagnosticare a morții cerebrale:
anexa-3-legea-nr-95-2006 Electroencefalograma:
A = Medic Primar AȚI
B = Medic Primar Neurolog, Neurochirurg sau AȚI
ANEXA Nr. 4
DECLARAȚIE
Subsemnatul (subsemnata) ……………………………………., în calitate de soț/sotie, părinte, copil major, frate, sora a numitului (numitei) ……………………………….., decedat (decedata), declar că sunt de acord cu recoltarea și cu donarea următoarelor organe și/sau tesuturi și/sau celule: ………………………………………………. .Declar că înțeleg gestul meu ca fiind un act profund umanitar și nu am nici un fel de pretenții materiale sau de alta natură.
Data ………………………………….
Reprezentantul donatorului ………………. (gradul de rudenie)
ANEXA Nr. 5
DECLARAȚIE-DECIZIE
Subsemnatul (subsemnata) …………………………., informat (informată) și constient (conștiență) asupra riscurilor și beneficiului transplantului de organe, tesuturi și celule umane, în concordanta cu dispozițiile legale în vigoare referitoare la prelevarea și transplantul de organe, tesuturi și celule umane, declar că sunt de acord cu înscrierea mea ca donator voluntar post-mortem pentru următoarele organe, tesuturi și celule: ……………………. .Sunt de acord cu investigarea mea periodică și gratuita privind starea mea de sănătate.
Potrivit legii, asupra hotărârii mele pot reveni oricând, cu condiția ca actul scris de revenire să fie semnat și de doi martori.
Data ………………………..
Semnatura ……………………
Notar ……………………….
ANEXA Nr. 6
Protocol de resuscitare
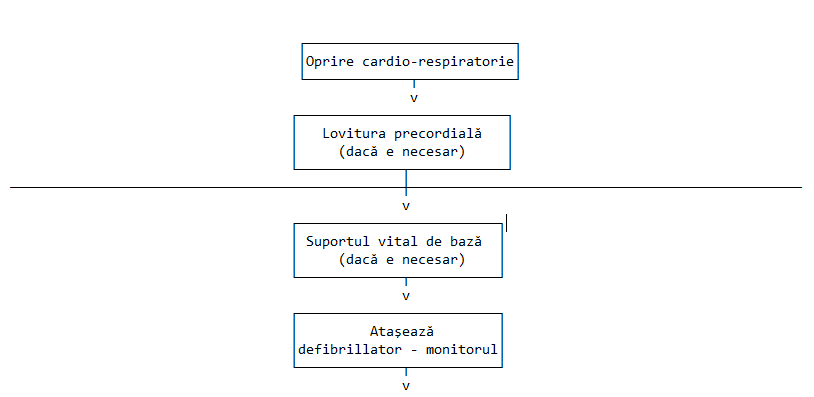

ANEXA Nr. 7
ROMÂNIA
MINISTERUL SĂNĂTĂȚII PUBLICE
AGENȚIA NAȚIONALA DE TRANSPLANT
Nr. ……/Data ………
AUTORIZAȚIE DE EXPORT
Având în vedere faptul ca pe teritoriul României nu exista nici un primitorMINISTERUL SĂNĂTĂȚII PUBLICE
AGENȚIA NAȚIONALA DE TRANSPLANT
Nr. ……/Data ………
AUTORIZAȚIE DE EXPORT
compatibil pentru următoarele organe și/sau tesuturi și/sau celule de origine
umană și/sau alte elemente ori produse ale corpului uman ………………..
……………………………………………………………….
în baza art. 3 lit. k) din Ordonanța Guvernului nr. 79/2004 pentru
înființarea Agenției Naționale de Transplant, aprobată cu modificări și
completări prin Legea nr. 588/2004, și în baza art. 12 lit. k) și art. 21
lit. j) din Ordinul ministrului sănătății nr. 183/2005 privind aprobarea
Regulamentului de organizare și funcționare, a organigramei și a componentei
Consiliului științific al Agenției Naționale de Transplant, cu modificările
și completările ulterioare,
se autorizeaza echipa de transplant ……………………………..
condusă de prof. dr. …………………………, legitimat cu pasaport
nr. …………, pentru prelevarea și transportul către …………….
a următoarelor organe și/sau tesuturi și/sau celule umane
………………………………………., recoltate de la un donator
decedat la Spitalul ……………………………………………..,
pentru utilizare terapeutică.
Președintele Consiliului științific al
Agenției Naționale de Transplant,
……………………………………
Directorul executiv al
Agenției Naționale de Transplant,
…………………………………
Jurist al Agenției Naționale de Transplant,
……………………………………..
Agenției Naționale de Transplant,
……………………………………
Directorul executiv al
Agenției Naționale de Transplant,
…………………………………
Jurist al Agenției Naționale de Transplant,
……………………………………..
ANEXA Nr. 8
DECIZIE
Prelevarea în scop terapeutic de la cadavrul ………………………. din spațiul ……………… a următoarelor organe …………………….., tesuturi …………………… și celule ………………., în vederea efectuării procedurilor de transplant, nu afectează rezultatele autopsiei medico-legale.Data și ora ………………….
Medic legist …………………
ANEXA Nr. 9
ROMÂNIAMINISTERUL SĂNĂTĂȚII PUBLICE
AGENȚIA NAȚIONALA DE TRANSPLANT
Nr. ……../Data ……
AUTORIZAȚIE DE IMPORT
Având în vedere faptul ca pe teritoriul României nu exista nici un organ și/sau tesut și/sau celula și/sau alt element sau produs al corpului uman …………………………………………………… compatibile și disponibile pentru pacientul …………………………………. cu diagnosticul ……………………………………………….,
în baza art. 3 lit. k) din Ordonanța Guvernului nr. 79/2004 pentru înființarea Agenției Naționale de Transplant, aprobată cu modificări și completări prin Legea nr. 588/2004, și în baza art. 12 lit. k) și art. 21 lit. j) din Ordinul ministrului sănătății nr. 183/2005 privind aprobarea Regulamentului de organizare și funcționare, a organigramei și a componentei Consiliului științific al Agenției Naționale de Transplant, cu modificările și completările ulterioare,
se autorizeaza importul (organ, tesut, celula, alte elemente sau produse ale corpului uman) ……………………………. de la …………………… din țara ………………………….. pentru a fi utilizat în scop terapeutic în (secția/spitalul) ………………………………………….. .
Autorizația s-a eliberat ca urmare a cererii înaintate de către (secția, spitalul) ……………….., înregistrată cu nr. …………………. la data de ………………………………. .
Președintele Consiliului științific al
Agenției Naționale de Transplant,
…………………………………….
Directorul executiv al
Agenției Naționale de Transplant,
……………………………………….
Jurist al Agenției Naționale de Transplant,
………………………………………
ANEXA Nr. 10
Fișa prelevare organe și tesuturi
anexa-10-1-legea-nr-95-2006FIȘA PENTRU DECLARAREA DONATORULUI
ANEXA Nr. 11
DECLARAȚIE
Subsemnatul (subsemnata) ……………………….. informat (informată) și constient (conștiență) asupra riscurilor și beneficiului transplantului de organe, tesuturi și celule umane, în concordanta cu dispozițiile legale în vigoare referitoare la prelevarea și transplantul de organe, tesuturi și celule umane, declar că sunt de acord cu primirea următoarelor organe și/sau tesuturi și/sau celule umane: ……………………………………… .Data ………………………………..
Semnatura reprezentantului legal ……….
ANEXA Nr. 12
DECLARAȚIE-DECIZIE
Conducerea secției ……………………………………….. din spitalul ……………………………….. a încercat prin toate mijloacele uzuale sa ia legătură cu familia (urmașii, reprezentanții legali) numitului (numitei) …………………………, aflat (aflată) pe lista de asteptare în vederea transplantului de ………………………………….. .Întrucât acest lucru nu a fost posibil în intervalul de timp avut la dispoziție, pentru evitarea decesului primitorului, s-a hotărât începerea transplantului în ziua de …………, ora ……… .
Data …………………….
Medic șef de secție ……….
Medic curant ……………..
ANEXA Nr. 13
DECLARAȚIE
Subsemnatul (subsemnații) …………………………………, părinți (copil major, frate, sora, reprezentanți legali) ai numitului (numitei) ……………………………………………, minor (minora) [handicapat (handicapata) mintal], informat (informati) și constient (constienti) asupra riscurilor și beneficiului transplantului de organe, tesuturi și celule umane, în concordanta cu dispozițiile legale în vigoare referitoare la prelevarea și transplantul de organe, tesuturi și celule umane, declar (declaram) ca sunt (suntem) de acord cu primirea următoarelor organe și/sau tesuturi și/sau celule umane: ………………………….. pentru ……………………. .Data ……………………
Semnatura reprezentantului legal …………
Medic șef de secție …………….